不同药物诱导的小鼠癫痫模型的差异性研究
胡 琳,张华丹,陈亚天,华 男,曾玲晖
(浙江大学城市学院医学院,浙江 杭州 310015)
癫痫(Epilepsy)是最常见的神经系统疾病之一,患者常表现为突然、短暂的运动、感觉、意识或精神等异常。反复的痫性发作严重影响患者生活和心理,甚至损害认知功能。资料显示,癫痫患者的生活质量明显低于正常人群,且低于其他慢性疾病患者,如高血压、糖尿病等。迄今为止,癫痫的发病机制仍不清楚,其治疗主要依靠药物和手术,而且抗癫痫药物通常需长期服用,且有明显的副作用[1-3]。目前,与癫痫相关的发病机理及药物治疗研究仍主要依靠动物模型。另外,由于癫痫的发作没有预见性,发作程度也不能人为控制,从而给研究癫痫带来困难。因此建立实验性动物癫痫模型,对于筛选、评价抗癫痫药物的作用,具有重要意义。
匹罗卡品、红藻氨酸和戊四氮是目前常用的几种化学致痫药物[4-7]。以往报道中模型动物的选取基本以大鼠和近交系小鼠多见,采用ICR 小鼠的研究较少,而ICR 小鼠价格低廉。明确ICR 小鼠对常见化学致痫药物的反应性,在抗癫痫药物筛选和毒理学研究等方面有良好的应用前景。本研究在ICR 小鼠分别腹腔注射上述3 种药物后,观察癫痫急性发作情况,包括潜伏期、癫痫发作级别、以及死亡率等,并通过对比3 种模型中兴奋性神经元及苔藓纤维发芽程度,探讨ICR 品系小鼠对3 种药物诱导的癫痫模型反应性的差异。
1 材料和方法
1.1 实验动物以及试剂年龄为6 周的雄性ICR 小鼠,购自上海斯莱克实验动物有限公司(动物许可证号:SYXK(沪)2012-0002)。动物使用严格参照浙江大学动物管理委员会的规定执行。匹罗卡品、红藻氨酸、氢溴酸东莨菪碱和阿拉伯胶军钩子Sigma 公司,USA;地西泮购自江西制药有限公司;其他试剂均为市售分析纯。
1.2 实验分组及处理 按照随机区组法将动物按体重分成若干区组,再给每个区组中的动物编号,利用随机数表法分配到各组。由于预实验中各组死亡率不同,正式实验中采用分批的方式确保可用于后续实验的动物数一致。实验小鼠分为匹罗卡品组(pilocarpine,Pilo)、红藻氨酸组(kainic acid,KA)、戊四氮组(pentylenetetrazol,PTZ)和 对 照组(control,Cont)。匹罗卡品组:ICR 小鼠先腹腔注射氢溴酸东莨菪碱1 mg/kg,30 min 后再腹腔注射盐酸匹罗卡品30 mg/kg。红藻氨酸组:ICR 小鼠腹腔注射红藻氨酸30 mg/kg。戊四氮组:ICR 小鼠腹腔注射戊四氮40 mg/kg,10 min 后20 mg/kg,之后每10 min 腹腔注射10 mg/kg,到出现Ⅳ-Ⅴ级癫痫发作。对照组:仅注射生理盐水。所有动物在一次SE 发作2 h 后,用安定(10 ml/kg)终止其发作。不同实验的样本量根据预实验的结果从效应强度和生物差异来确定。
癫痫的分级参照1972年Racine[8]制定的标准:一级:静止不动伴随有嘴部/面部运动;二级:点头及落水狗样抖动;三级:前肢阵挛;四级:站立及双侧前肢阵挛;五级:持续站立及跌倒;六级:狂奔及尖叫。
1.3 Fluro-Jade B(FJB)染色 在SE 造模后7 d,根据发作级别和持续时间,各组选取小鼠8只腹腔注射10%的水合氯醛,待完全麻醉后,分别用PBS 和4%多聚甲醛(PFA)进行心脏灌流。取出脑组织后,置于4%多聚甲醛内固定过夜,再转入30%蔗糖溶液中置于4℃冰箱中至脑组织沉入底部。
FJB 染色参照我们以前发表的文献[9]:切片用PBS 冲洗后,先用1%NaOH/80%酒精溶液浸泡5 min,然后依次在70%酒精和蒸馏水里各浸泡2 min。经0.06%的高锰酸钾溶液浸泡10 min(室温,摇床),切片稍经水洗后,置于0.1%醋酸配置的0.001%FJB 溶液中浸染20 min(避光,摇床)。封片后结果在显微镜下观察。
1.4 Timm 染色 在SE 造模后28 d,根据发作级别和持续时间,各组选取小鼠8 只腹腔注射10%的水合氯醛,待完全麻醉后,依次用生理盐水、1%硫化钠、生理盐水、4%多聚甲醛(3 min)进行心脏灌流固定。脑组织连续切片后,在含银的缓冲液(10%阿拉伯胶60 ml,柠檬酸缓冲液10 ml,5.67%对二苯酚30 ml,2%硝酸银2 ml)中避光孵育60~80 min,切片在蒸馏水洗10 min 后,脱水后封片,在显微镜下观测齿状回分子细胞层苔藓纤维发芽状况。
苔藓纤维出芽评分标准参照Buckmaster文献[10]:0 分:未见Timm 颗粒;1 分:偶见散在的片状分布的Timm 颗粒;2 分:较多片状分布的Timm 颗粒;3 分:Timm 颗粒接近连续分布;4分:浓密的Timm 颗粒带,连续或接近连续分布;5 分:浓密、层带状Timm 颗粒连续分布。
1.5 录像监测 在SE 后第2天,将待观察小鼠放入小鼠专用录像笼中,每天持续记录10 小时。观看视频,记录小鼠每日发生自发性癫痫的次数。
1.6 统计学处理 除造模成功率外,其余数据均采用均数±标准差()表示,经SPSS 15.0统计软件进行检验。造模成功率的比较采用卡方检验,癫痫发生潜伏期、癫痫发作次数及发生级别的比较采用one-way ANOVA 及S-N-K 分析,神经细胞死亡及苔藓纤维发芽采用one-way ANOVA 及Dunnetts 分析。P<0.05 认为差异有显著性意义。
2 结果
2.1 不同药物诱导的急性痫性发作的表现在匹罗卡品、红藻氨酸和戊四氮给药后,分别观察各组癫痫发生的症状、潜伏期、发作级别以及死亡率。注射红藻氨酸后,小鼠逐渐出现凝视、点头、面部及头部抽搐、全身肌阵挛、跌倒,大、小便失禁及流涎,最终发生全身强直-阵挛性发作、癫痫持续状态,其癫痫发作状态有逐渐由低级向高级发展的特点。如表1 所示,红藻氨酸组小鼠潜伏期最长,癫痫发作较稳定,造模成功率在3组中最高。匹罗卡品组小鼠潜伏期较长,癫痫发作等级较高,其死亡率相对于其他两组高。注射匹罗卡品后,小鼠初期表现为运动不能、面部抽搐、单肢阵挛、湿狗样抖动、点头和平衡失调等,之后很快出现肢体强直阵挛伴有站立及前肢阵挛等边缘系统运动性发作表现,最后大多数小鼠出现全身强直——阵挛发作伴有站立、跌倒,反复出现呈癫痫持续状态。戊四氮组小鼠潜伏期极短,癫痫发作等级非常高,死亡率也较高。一般在注射戊四氮后的1min 内,小鼠即出现躯体游走性痉挛、臀部上翘等表现,随后出现睑肌阵挛、凝视、点头运动、尾巴上翘,继之双前肢抬起阵挛或后肢伸展、头向左或右扭动,随后出现四肢抽搐;达到V 级以上发作的小鼠则表现为狂奔嘶叫、全身强直-阵挛性发作,同时伴有全身青紫。在之后观察的2 h 内,小鼠仍然会间歇性出现大于等于4 级的癫痫发作。

表1 不同药物诱发的小鼠急性痫性发作情况Table 1 Comparison of seizure latency,severity and success rate of modeling
2.2 不同药物诱导的癫痫模型对神经元死亡的影响 小鼠急性痫性发作后7 d,不同组别脑组织切片经FJB 染色。如图1 所示,对照组、匹罗卡品组、红藻氨酸组和戊四氮组小鼠脑组织切片海马CA1 区均未见到明显的神经元细胞死亡。同样,对照组、匹罗卡品组、红藻氨酸组和戊四氮组小鼠脑组织切片在海马CA3 区、DG 区也均未见到明显的神经元细胞死亡(数据未出示)。
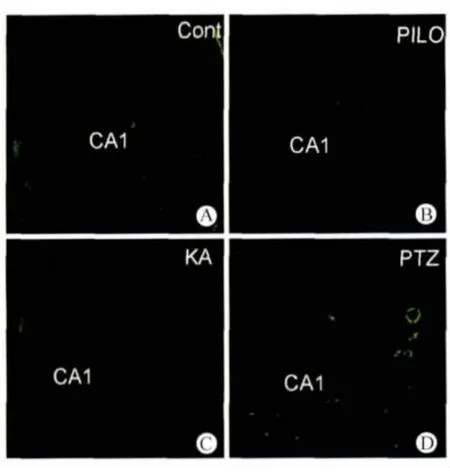
图1 不同药物诱导的小鼠癫痫模型均未出现神经细胞死亡Fig.1 No cell death was detected in different drug-induced seizure model
2.3 不同药物诱导的癫痫模型小鼠中苔藓纤维发芽程度的不同 苔藓纤维发芽是自发性癫痫的病理表现之一。为检测ICR 小鼠不同药物诱导的癫痫模型中苔藓纤维发芽有无不同,在急性痫性发作后第28天小鼠灌流取脑行Timm 染色。如图2 所示,匹罗卡品组(图2B)和红藻氨酸组(图2C)可见明显苔藓纤维发芽,但戊四氮组(图2D)与对照组相似,未见明显苔藓纤维发芽。对四组小鼠Timm 染色进行评分的结果见表2,与对照组相比,匹罗卡品组和红藻氨酸组均显著增高(P<0.001)。
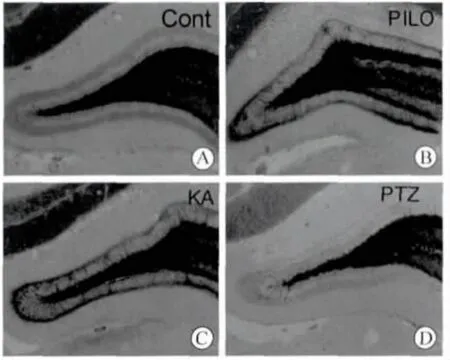
图2 不同药物诱导的癫痫模型中苔藓纤维发芽的差异Fig.2 Variability of mossy fiber sprouting in different drug-induced seizure model
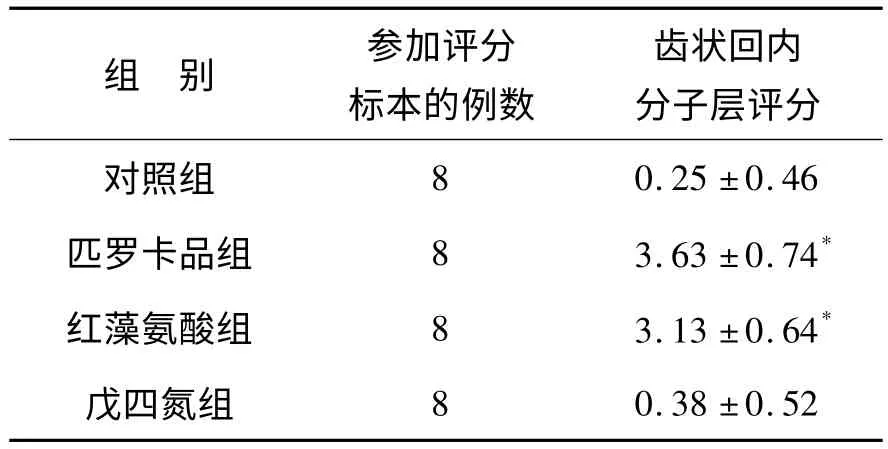
表2 不同药物诱导的癫痫小鼠模型中苔藓纤维发芽评分情况Table 2 Timm's score in different drug-induced seizure model
2.4 不同药物诱导的癫痫模型小鼠自发性癫痫的发作情况 在成功诱发急性痫性发作后次日,对小鼠每日采用录像记录,连续4 周,每组14 只。对照组小鼠和戊四氮组小鼠未观察到自发性癫痫发作,匹罗卡品组小鼠有8 只发生自发性癫痫,发生率为57.1%;红藻氨酸组小鼠有6 只发生自发性癫痫,发生率为42.9%。对小鼠逐周的癫痫发生次数进行统计,发现随着时间的推移匹罗卡品和红藻氨酸模型组癫痫的发作频率均升高(图3)。
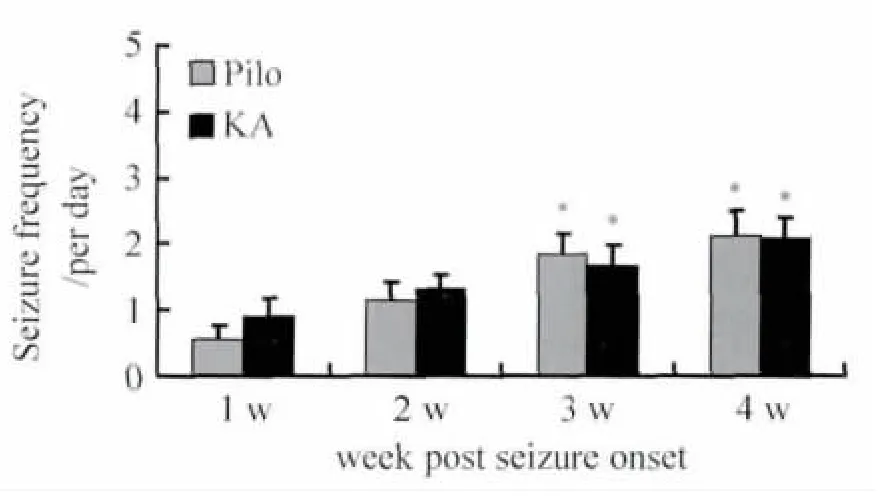
图3 自发性癫痫发生频率随时间的推移而增加Fig.3 The frequency of spontaneous seizure increased with time
3 讨论
不同化学药物诱导的癫痫模拟临床不同的癫痫类型,匹罗卡品、红藻氨酸和戊四氮是目前最常用的几种癫痫模型的化学药物[4-7]。既往的研究以SD 大鼠和C57BL6 小鼠为研究对象居多,然而SD 大鼠和C57BL6 价格是ICR 小鼠的4~6 倍。本研究系统观察了ICR 小鼠对匹罗卡品、红藻氨酸和戊四氮诱发的癫痫的行为学特征、神经元丢失,苔藓纤维出芽及自发性癫痫的发生状况。结果显示,ICR 小鼠对三种致痫药物的反应与SD 大鼠相似:匹罗卡品和红藻氨酸单次注射即能诱发癫痫持续状态,在终止发作后一个月内半数左右的动物会出现反复自发性发作,其表现类似于人类慢性颞叶癫痫;与匹罗卡品组相比,红藻氨酸阶段性明显、行为学表现规律、稳定、死亡率低。戊四唑阈下剂量反复注射,经过多次刺激,半数以上的ICR 小鼠能够成功点燃,但在其后的一个月内未观测到自发性癫痫发生,表现类似于人类急性失神性癫痫发作。因此,作为癫痫发病机制研究和药物筛选,ICR 小鼠不失为一个既经济又有效的品系。
不同品系的小鼠对化学药物诱导的癫痫呈现不同的反应性[11-13]。比如红藻氨酸诱发的痫性发作在C57BL6 品系的小鼠不易发生神经元凋亡和苔藓纤维出芽,而FBV 品系则容易出现细胞毒性。而在匹罗卡品诱发的急性痫性发作中,C57BL6 则出现明显的神经元死亡和自发性癫痫发作。在本研究中,我们发现匹罗卡品和红藻氨酸诱导急性痫性发作2 h 后,ICR 小鼠表现为明显的苔藓纤维发芽和自发性癫痫发生,但未见神经元细胞死亡。不同品系的动物对不同癫痫药物反应性的差异与动物的遗传特性以及不同致痫药物的药理作用及毒理作用机制高度相关。
神经元死亡[14-15]和苔藓纤维发芽[16-17]是癫痫持续状态诱发的典型病理表现,从而导致神经环路兴奋性增高和自发性癫痫的发生。本研究中发现匹罗卡品和红藻氨酸诱发急性痫性发作2 h 后,在ICR 小鼠能检测到明显苔藓纤维发芽和自发性癫痫发作,但并没有观测到神经元死亡,提示自发性癫痫发生可能与苔藓纤维发芽直接相关,与以往相关报道一致[18],具体机制尚待进一步研究。
由于样本量大,本研究中对自发性癫痫的观测采用每日录像记录10 h 的不连续方式,与连续脑电图记录相比,数据可能存在一定偏差。且仅观测到造模后4 周,有的小鼠初始脑损伤的潜伏期长,可能在4 周后才开始出现自发性癫痫发作,因此数据可能有遗漏。但从本研究结果仍然可看出,在匹罗卡品和红藻氨酸诱发急性痫性发作后,半数左右的ICR 小鼠呈现自发性癫痫的发作,且发作频率随着时间的推移呈上升趋势。
总之,本研究结果表明,ICR 小鼠在匹罗卡品、红藻氨酸和戊四氮给药后均显示出与大鼠或C57BL6 小鼠相似的急性痫性发作。匹罗卡品和红藻氨酸诱发ICR 小时2 小时的急性癫痫发作后未见明显细胞死亡,但苔藓纤维发芽明显,可能与自发性癫痫的发生相关联。
[1]ELGER C E,SCHMIDT D.Modern management of epilepsy:a practical approach [J].Epilepsy Behav,2008,12:501-539.
[2]FRENCH J A.Refractory epilepsy:clinical overview[J].Epilepsia,2007,48(Suppl 1):3-7.
[3]KOBOW K,AUVIN S,JENSEN F,et al.Finding a better drug for epilepsy:antiepileptogenesis targets[J].Epilepsia,2012,53(11):1868-1876.
[4]GUO W,LI Y W,CHANG C R(郭 炜,李优伟,常春然).Research review on epileptic model[J].Neural Injury and Functional Reconstruction(神经损伤与功能重建),2010,5(3):213-216.(in Chinese)
[5]MELLO L E,CAVALHEIRO E A,TAN A M,et al.Circuit Mechanisms of Seizures in the Pilocarpine Model of Chronic Epilepsy:Cell Loss and Mossy Fiber Sprouting[J].Epilepsia,1993,36(6):985-995.
[6]GOLARAI G,CAVAZOS J E,SUTULA T P.Activation of the dentate gyrus by pentylenetrazol evoked seizures induces mossy fiber synaptic reorganization[J].Brain Res,1992,593(2):257-264.
[7]STRIEBEL J F,RACE B,PATHMAJEYAN M,et al.Lack of influence of prion protein gene expression on kainate-induced seizures in mice:Studies using congenic,coisogenic and transgenic strains[J].Neuroscience,2013,238:11-18.
[8]RACINE R J.Modification of seizure activity by electrical stimulation:II.Motor Seizure [J].Electroencephalogr Clin Neurophysiol,1972,32(30):255-310.
[9]ZENG L H,RENSING N R,WONG M.The mammalian target of rapamycin signaling pathway mediates epileptogenesis in a model of temporal lobe epilepsy[J].J Neurosci,2009,29(21):6964-6972.
[10]BUCKMASTER P S.Prolonged infusion of tetrodotoxin does not block mossy fiber sprouting in pilocarpine-treated rats[J].Epilepsia,2004,45:452-458.
[11]SHIBLEY H,SMITH B N.Pilocarpine-induced status epilepticus results in mossy fiber sprouting and spontaneous seizures in C57BL/6 and CD-1 mice[J].Epilepsy Res,2002,49:109-120.
[12]MULLER C J,BANKSTAHL M,GROTICKE I,et al.Pilocarpine vs.Lithium-pilocarpine for Induction of Status Epilepticus in Mice:Development of Spontaneous Seizures,Behavioral Alterations And Neuronal Damage [J].Eur J Pharmacol,2009,619:15-24.
[13]MULLER C J,GROTICKE I,BANKSTAHL M,et al.Behavioral and Cognitive Alterations,Spontaneous Seizures,and Neuropathology Developing after a Pilocarpine-induced Status Epilepticus in C57BL/6 Mice[J].Exp Neurol,2009,219:284-297.
[14]HENSHALL D C,CHEN J,SIMON R P.Involvement of easpase-3-like protease in the mechanism of cell death following focally evoked limbic seizures[J].J Neurochem,2000,74(3):1215-1223.
[15]MENG L,MENG J,LIU W X,et al(孟 丽,孟杰,刘云霞,等).Effect of epileptic seizures on hippocampal neurons of rats induced by pentetrazole [J].Modern Preventive Medicine(现代预防医学),2007,34(16):3051-3055.(in Chinese)
[16]LIU H F,LI X,LI Z R,et al(刘洪付,李 晓,李晓冉,等).Comparison study of behavioral and histological between pilocarpine-induced epilepsy model and pentylenetetrazole kindling model in the neonatal rat [J].Journal of Binzhou Medical University(滨州医学院学报),2009,32(3):171-173.(in Chinese)
[17]LEW F H,BUCKMASTER P S.Is there a critical period for mossy fiber sprouting in a mouse model of temporal lobe epilepsy [J]?Epilepsia,2011,52(12):2326-2332.
[18]CHEN L L,FENG H F,MAO X X,et al.One hour of pilocarpine-induced status epilepticus is sufficient to develop chronic epilepsy in mice,and is associated with mossy fiber sprouting but not neuronal death[J].Neurosci Bull,2013,29(3):295-302.

