侧脑室注射链脲佐菌素致大鼠脑内胰岛素通路障碍和认知水平降低
杨文青, 马 晶, 刘 争, 芦永良, 余华荣△
阿尔茨海默病(Alzheimer disease,AD)是一种老年人最常见的神经退行性疾病,以进行性的认知行为障碍为临床特征。1906年该病被正式命名并明确其病理改变主要为神经元的丢失以及老年斑和神经纤维缠结的形成。到上世纪八十年代,随着分子技术的发展,明确了老年斑的主要成分是淀粉样β蛋白(amyloid β-protein,Aβ),而神经纤维缠结的主要成分是过度磷酸化的tau蛋白。
根据国际疾病分类,AD分为家族遗传性AD(familial Alzheimer disease,FAD)和散发性AD(sporadic Alzheimer disease,SAD),其中 FAD 占总 AD 的5%,且病因明确,主要由淀粉样蛋白前体(amyloid protein precursor,APP)、早 老 素 1(presinilin 1,PS1)、早老素2(presinilin 2,PS2)等基因突变所致;而SAD则病因不明确,倾向于多因素、多途径、多方面共同作用的结果。近来研究表明,AD患者在疾病早期尚未出现病理改变和临床症状之前就已经出现了大脑对葡萄糖利用的降低[1],而流行病学调查发现2型糖尿病和AD有着密切联系[2],因此,科学家提出AD是一种“3型糖尿病”,亦是中枢神经系统的内分泌疾病[3]。
链脲佐菌素(streptozotocin,STZ)是一种甲基亚硝基脲产物,分子量为265 D,具有抗菌、抗肿瘤的性能和致糖尿病的副作用。在外周,STZ可以选择性地破坏胰腺β细胞,引起糖尿病。脑室注射STZ可以破坏中枢胰岛素受体的磷酸化,引起胰岛素信号通路障碍。有不少研究表明[4],侧脑室(intracerebroventricular,ICV)注射小剂量STZ能导致脑局部的糖利用和能量代谢障碍,引起大鼠学习记忆障碍和胆碱能神经元丢失,而外周的胰岛结构和胰岛素的基因表达未受影响。目前用于研究AD的动物模型主要有药物损伤模型、转基因动物模型和自然衰老模型等,但没有哪一种模型能较全面地再现AD的病理改变及分子变化。本实验通过ICV-STZ建立AD动物模型并系统检测大脑胰岛素信号通路中相关分子的改变,较全面地反映胰岛素信号通路在AD中的作用,探讨引起AD可能的作用机制。
材料和方法
1 材料
1.1 动物 清洁级雄性Sprague-Dawley(SD)大鼠16只,体重320~380 g,购自重庆医科大学实验动物中心,采用Excel表自动产生随机数字将大鼠分成2组,即对照组(control)和模型组(STZ)。饲养于重庆医科大学实验动物中心SPF,每4只一笼,大鼠自由进食和摄水。
1.2 试剂 STZ(Sigma);糖原合成酶激酶 3β(glycogen synthase kinase 3β,GSK-3β)抗体,磷酸化糖原合成酶激酶 3β(p-GSK-3β)抗体,tau抗体,p-tau抗体(Bioworld);Aβ1-40,Aβ1-42(北京博奥森);胰岛素降解酶(insulin-degrading enzyme,IDE)抗体(武汉三鹰生物公司);Ⅱ抗均购自北京中杉金桥生物公司;免疫组化试剂盒购自北京中杉金桥生物公司;逆转录试剂盒和PCR反应液(TaKaRa,中国大连)。
2 方法
2.1 侧脑室注射STZ SD大鼠用10%水合氯醛(4 mg/kg)麻醉后固定在颅脑立体定位仪(成都泰盛科技有限公司)上,常规局部消毒,头顶部沿矢状缝切开皮肤,分离骨膜,根据包新民的《大鼠脑立体定向图谱》定位,在前囟后0.8 mm、矢状缝旁开1.5 mm处用锥颅器钻开颅骨,暴露硬脑膜,25 μL微量进样器自定位点进针,深度3.5 mm缓慢注入约5 μL液体(注射时间为5 min,STZ组注射1.5 mg/kg STZ,用生理盐水溶解,control组则用等量生理盐水代替STZ),注入后留针5 min,以保证溶液充分弥散,再缓慢退出。术后第3 d再重复注射1次。
2.2 行为学检测 第1次手术后21 d采用Morris水迷宫进行行为学检测。Morris水迷宫为一个不锈钢的圆柱形水池,直径120 cm,高50 cm,水池壁标明4个入水点,盛水后水深约30 cm,水温控制在22~25℃,将一直径11 cm、高29 cm的平台放置于水池中间,平台在水面下1 cm。(1)定位航行实验:将大鼠面向池壁放入水中,记录其在120 s内寻找到平台的时间,即为逃避潜伏期。如大鼠不能在120 s内找到平台,则由实验者用手牵引其到平台上停留30 s,再放回笼中,间隔30 min再进行下一次实验。此项实验反映大鼠的学习能力。(2)空间探索实验:撤走平台,将大鼠从任意一个入水点放入池中,记录其在120 s内在原平台所在象限活动的时间,测试大鼠的记忆保持能力。
2.3 动物取材 每组各取3只大鼠,用10%水合氯醛麻醉后,剪开胸腹腔,暴露心脏和肝脏,剪开右心耳,从左心室用生理盐水灌注至肝脏无血色,再用4%多聚甲醛灌注约120 mL,然后迅速取出脑组织,放入4%多聚甲醛固定24 h,行免疫组化切片染色。其余大鼠均采用断颈取脑,然后分离出皮质和海马放入液氮中备用。
2.4 免疫组织化学染色 首先将组织进行石蜡包埋,行冠状面切片,贴片后烘烤。再将片架和玻片一同放入60℃二甲苯Ⅰ和Ⅱ中各20 min,后依次放入不同浓度乙醇各3 min,PBS洗5 min。接着用枸橼酸缓冲液充分暴露抗原,再将标本浸于封闭血清20 min后再滴Ⅰ抗4℃过夜。第2 d,37℃复温1 h后再滴Ⅱ抗和Ⅲ抗各37℃ 20 min。DBA显色,苏木素染色,5组乙醇脱水各1 min,3组二甲苯透明各5 min,封片。显微镜观察并拍照。
2.5 Western blotting 先将组织放入玻璃匀浆器中的球状部位,碾碎组织,再加入相应裂解液和PMSF,使裂解液中的PMSF的浓度为1 mmol/L,采用超声波细胞粉碎机进行组织粉碎,放置约30 min后移入EP管中,4℃、11 000×g离心5 min,取少量上清液做BCA蛋白定量分析,其余上清液按4∶1加入5×蛋白上样缓冲液,100℃水中煮沸5 min后放入-80F℃冰箱备用。每组取适量样本行SDS-PAGE凝胶电泳分离蛋白,再将蛋白转移至PVDF膜(Millipore)上,5% 脱脂奶粉封闭,Ⅰ抗(IDE 1∶125、tau 1∶25、ptau 1∶500、GSK-3β 1∶500和 p-GSK-3β 1∶500)4℃孵育过夜,TBST洗膜3×5 min,Ⅱ抗室温孵育1 h,TBST 洗膜 3×5 min,通过 Bio-Rad ChemiDocXRS化学发光成像系统,进行曝光分析显影。
2.6 实时定量RT-PCR 取约30 mg的组织放入研钵中,边加液氮边研磨直至成粉末状,再加入约1 mL的Trizol继续研磨至液体清亮;移入EP管中,4℃、12 000×g离心5 min;取上清液加入约0.3 mL的氯仿,剧烈振荡混匀,4℃、12 000×g离心15 min,取上清液,加入等量的异丙醇,4℃ 12 000×g离心10 min;弃去上清,加入 1 mL 75%乙醇,4℃、12 000×g离心5 min;弃上清加入适量的DEPC水,检测mRNA的浓度。用TaKaRa逆转录试剂盒将mRNA逆转录为cDNA,再配成10 μL体系的PCR反应液。PCR反应条件为:95℃ 2 min预变性;95℃ 5 s,60℃ 30 s,75℃ 30 s,40个循环。引物序列见表1。
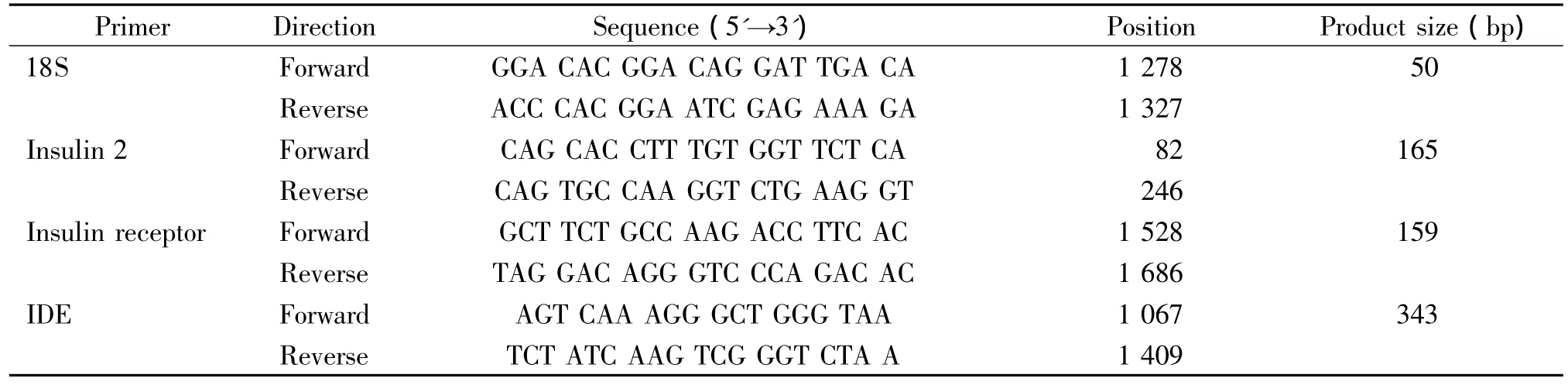
表1 实时定量RT-PCR各引物的序列Table 1.Primer pairs for real-time quantitative RT-PCR
3 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 18.0软件对各组数据进行正态检验以及方差齐性检验,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 体重变化
大鼠手术后出现不同程度的体重下降,在第3周开始回升。与control组相比,STZ组体重下降更为明显,且恢复也相对较慢,但差异无统计学意义(P>0.05),见图1。
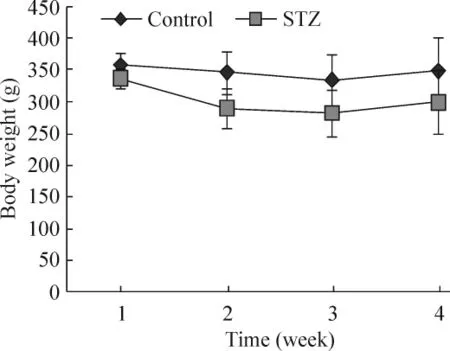
Figure 1.Body weight of the rats in control group and STZ group at different time points.Mean±SD.n=8.图1 2组大鼠不同时期的体重
2 血糖变化
分别于脑室注射药物前(第1 d)和动物处死前(第26 d)取尾静脉血检测末梢血糖,2组大鼠在处死前血糖检测结果无明显差异(P>0.05),见图2。
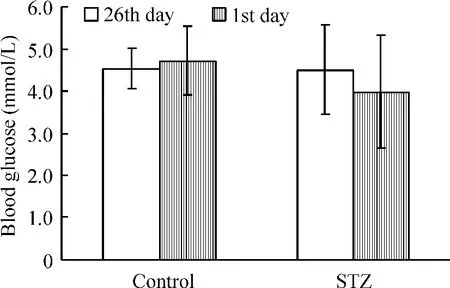
Figure 2.Blood glucose in control group and STZ group.Mean± SD.n=8.图2 2组大鼠在建模前后血糖的比较
3 大脑重量变化
大鼠处死后立即取出大脑组织进行称重,STZ组的大脑重量较control组偏轻,但差异无统计学意义(P >0.05),见图3。
4 Morris水迷宫结果
4.1 定位航行实验 在4 d的定位航行训练中,2组大鼠均表现出一定的学习记忆能力,但STZ组大鼠从第1 d起逃避潜伏期就较control组明显延长(P<0.01),并且主要沿池壁游,表现出一定的盲目性,表明其学习能力较control组明显降低,见图4。
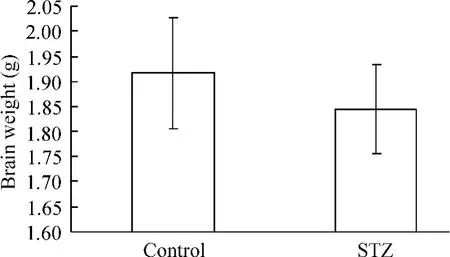
Figure 3.Brain weight at the end of the experiment.Mean±SD.n=8.图3 2组大鼠处死后大脑重量的比较
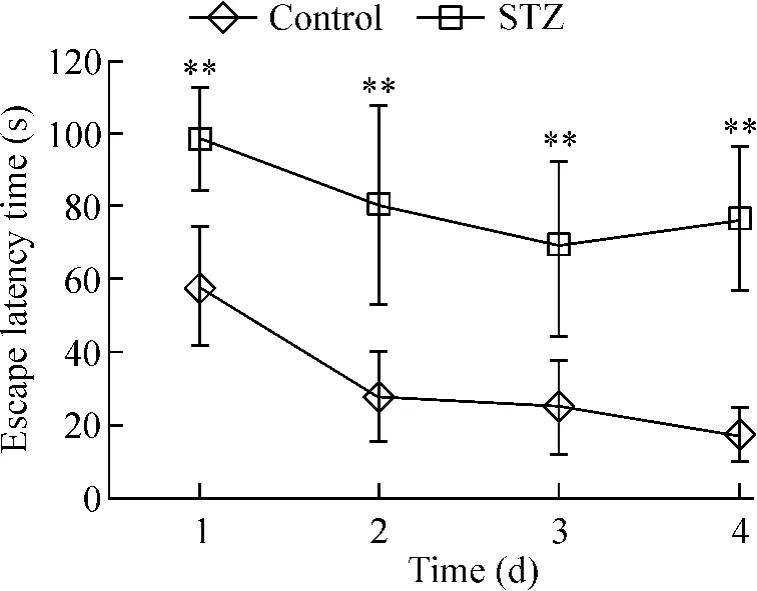
Figure 4.Comparison of escape latency time of rats in the two groups in Morris water maze test.Mean ± SD.n=8.**P <0.01 vs control.图4 2组大鼠逃避潜伏时间的比较
4.2 空间探索实验 第5 d撤走平台后,control组大鼠在原平台所在象限停留的时间明显较长,而STZ组大鼠停留时间短,两者有显著差异(P<0.01),表明STZ组大鼠的记忆能力明显降低,见图5。
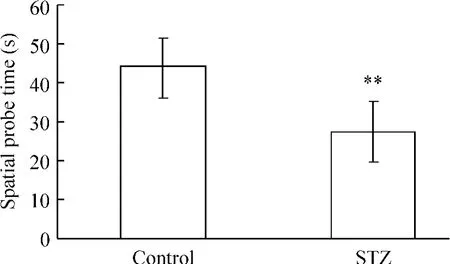
Figure 5.Comparison of spatial probe time of rats in the two groups.Mean ± SD.n=8.**P <0.01 vs control.图5 2组大鼠空间探索时间的比较
5 大鼠大脑Aβ1-40和Aβ1-42的变化
STZ组大鼠 Aβ1-40和 Aβ1f-42较 control组明显增加(主要在皮质区,海马区不明显),而control组则几乎未见Aβ沉积,见图6。
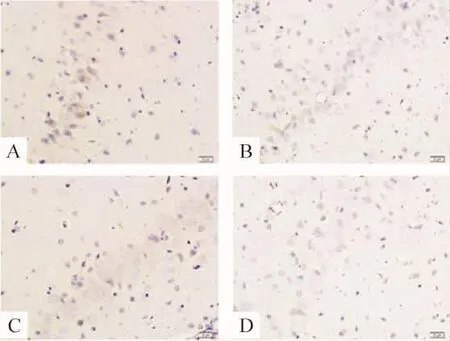
Figure 6.STZ increased Aβ1-42(A,B)and Aβ1-40(C,D)levels in the cerebral cortex(immunohistochemical staining,×400).A,C:STZ group;B,D:control group.图6 STZ导致Aβ1-40和Aβ1-42在皮质区沉积的增加
6 ICV-STZ对大脑胰岛素信号通路的影响
ICV-STZ导致皮质和海马的胰岛素mRNA和胰岛素受体mRNA较control组均明显减少,差异有统计学意义(P <0.05或 P <0.01),见图7。
7 ICV-STZ对IDE mRNA和蛋白质表达的影响
STZ组大鼠的IDE水平明显减少,与control组比较有显著差异(P <0.05或 P <0.01),见图8。
8 ICV-STZ增加GSK-3β的活性和tau蛋白的磷酸化水平
STZ组的 p-GSK-3β量明显减少,p-GSK-3β/GSK-3β的比值明显低于对照组(P<0.05)。2组中总tau蛋白的水平无显著差异,但STZ组p-tau的水平较control组明显升高(P<0.01),见图9。
讨 论
人体大脑只占人体体重的2%,但是在基础代谢下,大脑对葡萄糖的消耗占人体葡萄糖消耗总量的50%[5],人体大脑储存能量及利用其它营养物质的能力十分有限,脑的糖原储存只有0.1%,仅够维持几分钟的正常活动,并且不能自身合成和分泌葡萄糖。因此,只能通过外周血液持续将葡萄糖运送至大脑以维持大脑的正常功能。随着年龄的增加,人体大脑对葡萄糖的利用会有不同程度的下降,而在AD病人这种下降程度则更加明显[6]。近年来采用脑正电子发射断层扫描成像(positron emission tomography,PET)技术发现在AD患者疾病早期阶段就已经出现了大脑对葡萄糖利用的降低[7],有研究发现在AD早期阶段大脑葡萄糖利用下降了45%。以上研究提示大脑葡萄糖代谢降低很可能是AD的一个病因,而不是AD发展的结果。而胰岛素调节机体组织对葡萄糖的摄取和利用,近30年来人们研究发现大脑胰岛素受体主要分布在嗅球、大脑皮层、海马、脑扁桃体和下丘脑;大脑胰岛素受体的主要功能包括控制机体的能量平衡,调控突触的可塑性和调节认知功能以及与年龄相关的神经退行性变[8],当侧脑室注射STZ后,STZ破坏了胰岛素信号通路,引起葡萄糖利用降低,影响了乙酰辅酶A和乙酰胆碱的水平,阻碍胆碱能神经系统功能,最终导致学习记忆能力下降[9]。
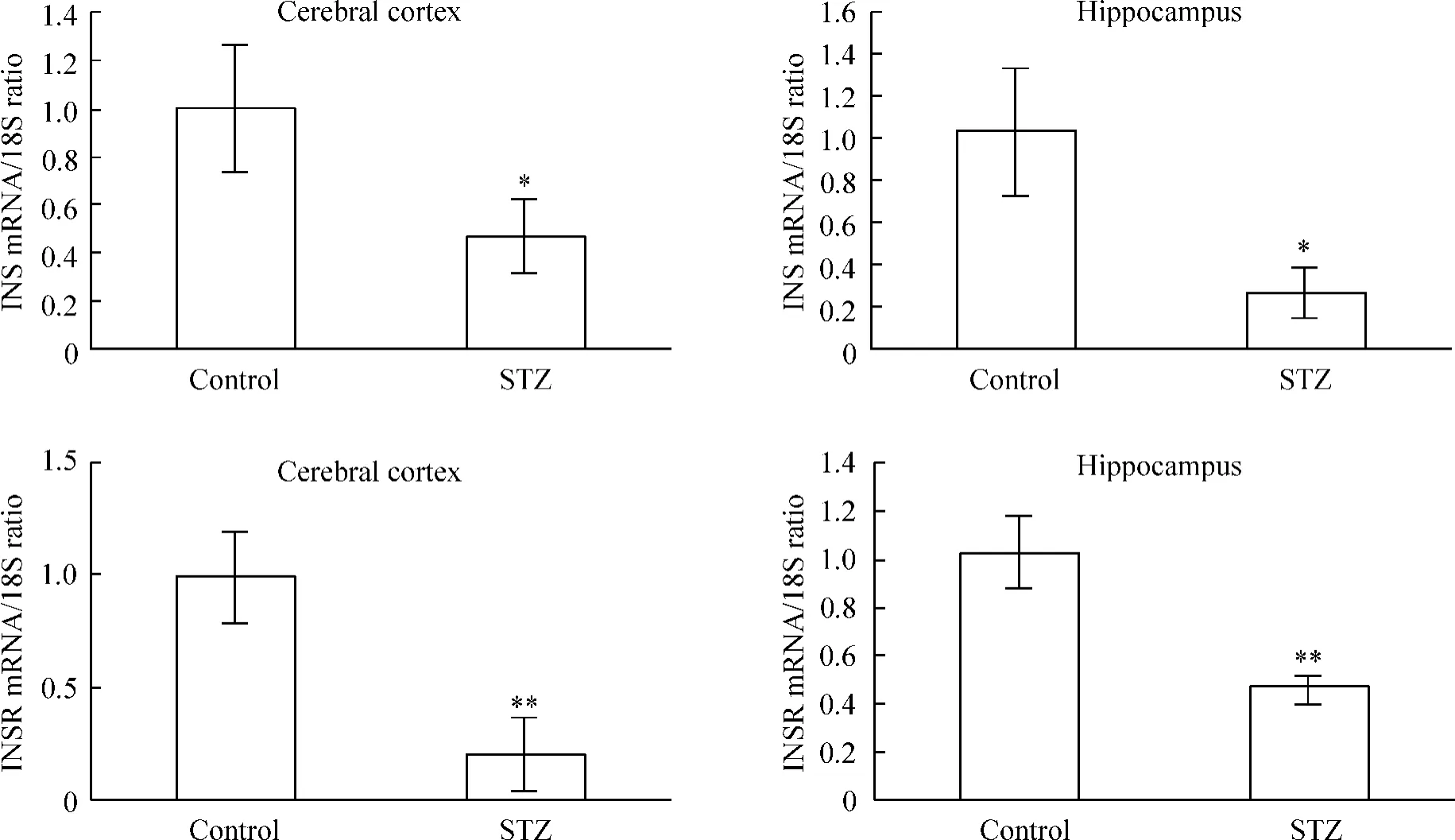
Figure 7.Effects of ICV-STZ on insulin(INS)and insulin receptor(INSR)mRNA expression in cerebral cortex and hippocampus.The mRNA expression was measured by real-time quantitative RT-PCR and normalized to 18S RNA.Mean±SD.n=5.*P <0.05,**P <0.01 vs control.图7 ICV-STZ对大脑皮质和海马的胰岛素和胰岛素受体mRNA表达的影响
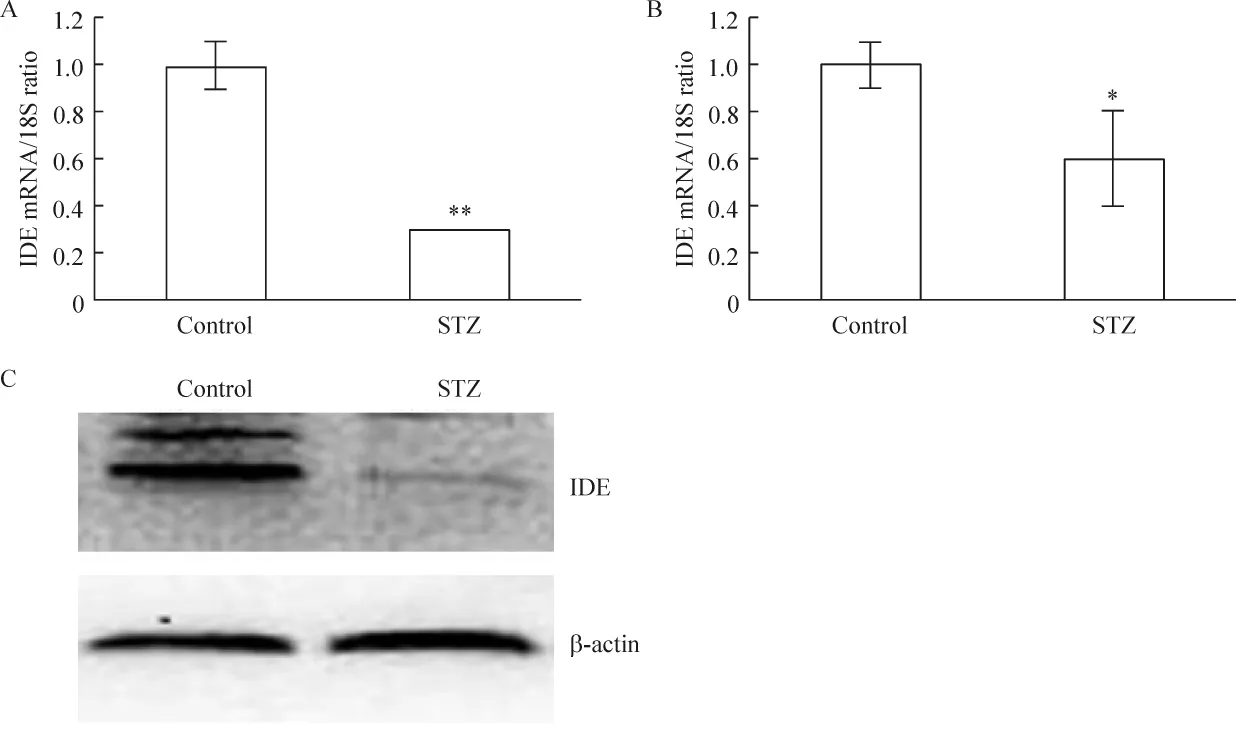
Figure 8.Effects of ICV-STZ on insulin-degrating enzyme(IDE)mRNA and protein expression.The mRNA expression in the cerebral cortex(A)and hippocampus(B)was measured by real-time quantitative RT-PCR and normalized to 18S RNA.The protein expression in the hippocampus(C)was measured by Western blotting and normalized to β-actin.Mean ± SD.n=5.*P <0.05,**P <0.01 vs control.图8 ICV-STZ对IDE mRNA和蛋白质表达的影响
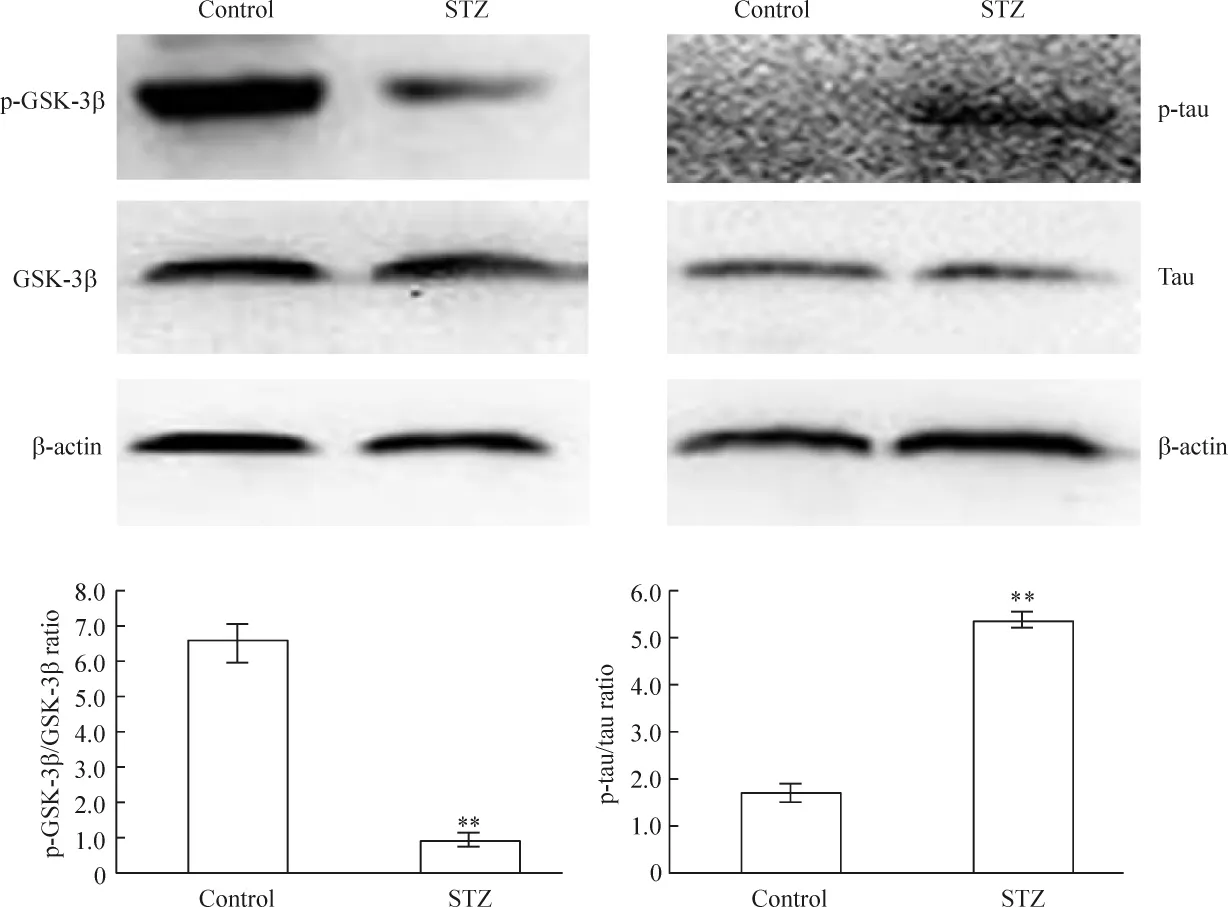
Figure 9.ICV-STZ enhanced GSK-3β activity and tau phosphorylation.The protein expression in the hippocampus was measured by Western blotting.Mean ± SD.n=5.**P <0.01 vs control.图9 ICV-STZ增加GSK-3β的活性和tau的磷酸化水平
中枢神经组织的胰岛素与胰岛素受体结合后主要通过2条途径将信号下传,一条是经胰岛素受体底物(insulin receptor substrate,IRS)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)调节葡萄糖代谢;另一条是经Shc/Raf/MAPK调节基因转录和细胞增殖,分化。GSK-3β作为胰岛素信号通路中一种重要的激酶,其活性受胰岛素信号调节,当胰岛素信号通路发生障碍,则通过IRS-PI3K-Akt(蛋白激酶B)途径使GSK-3β的磷酸化水平降低,增加GSK-3β的活性,调节糖原的合成;同时GSK-3β与tau的磷酸化有密切联系[10]。GSK-3β被认为是tau重要的激酶之一,其活性增加可促进p-tau的增多,进而导致神经纤维缠结的形成。有研究发现,在AD患者大脑中,tau至少有10个过度磷酸化的位点,异常磷酸化的tau丧失了与微管结合的生物学活性,并在神经元内异常聚集最终形成神经纤维缠结,增加了氧化应激反应从而引起神经纤维退行性变以及诱发一系列病理生理反应,最终导致细胞凋亡、线粒体功能的障碍和坏死[11]。我们的研究结果发现:胰岛素和胰岛素受体水平降低表明STZ损伤胰岛素信号通路,抑制了PI3K和Akt,从而增加了GSK-3β的活性,进而导致tau蛋白的过度磷酸化,而本实验各组总tau无明显改变,故p-tau/tau的比值增大。但亦有研究表明tau缺乏可以缓解Aβ诱导的LTP损伤[12],表明Aβ与tau之间存在较为复杂的关系。
Aβ被认为是引起AD认知障碍最重要的病理特征,由APP被APP β位分解酶1(β-site APP-clfeaving enzyme 1,BACE1)经过一系列蛋白水解反应催化而来,主要包括Aβ1-40和Aβ1-42。通常认为Aβ的异常积累导致其过分聚合,而正是这些过度聚合的Aβ分子对神经网络具有损害作用[8]。但是有研究显示,在ICV-STZ的AD转基因动物模型中,早期出现认知障碍时,动物大脑中Aβ的沉积并不明显,因此Aβ并非是引起SAD的罪魁祸首,而可能是通过正反馈途径加重了大脑的功能障碍。有研究表明,胰岛素能通过影响APP的代谢来调节Aβ的形成,而Aβ可以竞争性结合胰岛素受体,从而阻碍胰岛素信号通路,进而导致Aβ和p-tau的增多,因此形成一种恶性循环。IDE是一种既能催化胰岛素降解和负性调控胰岛素信号,同时也能降解可溶性Aβ,从而调节细胞外Aβ水平的酶。有研究表明,在AD患者大脑IDE降解Aβ的能力下降了50%;在IDE基因敲除的小鼠中发现其大脑Aβ聚集明显增加同时伴有葡萄糖不耐受和血清胰岛素浓度的增加[13]。本文研究可知,胰岛素mRNA表达降低一方面使胰岛素信号下传减少,另一方面则使得IDE表达水平也随之减少,导致Aβ的降解减少进而促使Aβ的沉积增加,而Aβ与tau之间可能存在着某些相互作用从而加重AD的病理改变和认知障碍。
STZ是一种选择性破坏具有合成和分泌胰岛素功能的细胞的药物,在外周可以直接破坏胰岛β细胞引起Ⅰ型糖尿病或胰岛素抵抗;而在中枢神经系统,本文研究表明STZ可以减少皮质和海马的胰岛素和胰岛素受体mRNA的表达,从而破坏中枢神经系统自身胰岛素的合成,降低了中枢神经系统对外周胰岛素的敏感性,进而导致中枢神经系统胰岛素信号的障碍。本研究亦表明,胰岛素信号通路的损害导致其下游GSK-3β的活性增加,IDE表达减少,最终使得Aβ沉积增加,p-tau表达增多,tau的微管结合能力降低。而这些在大鼠模型脑组织的病理改变与AD患者的表现是一致的。因此,大脑胰岛素信号通路障碍可以引起阿尔茨海默病样的病理改变和临床特征,亦揭示了AD可能的发病机制:(1)胰岛素信号通路障碍导致胆碱能神经系统功能降低,表现为学习记忆能力下降;(2)胰岛素信号通路障碍影响葡萄糖转运体,导致细胞摄入葡萄糖减少,能量代谢降低,表现为神经元功能下降、萎缩或丢失;(3)胰岛素信号通路障碍使其下游的GSK-3β活性增加,导致tau蛋白过度磷酸化;(4)胰岛素相关的IDE表达异常使Aβ不能被及时有效清除,导致Aβ沉积增加最终加重了病理改变和临床特征。同时ICV-STZ可以作为一种用于研究AD的可行的动物模型。
[1] Mosconi L,Tsui WH,Rusinek H,et al.Quantitation,regional vulnerability,and kinetic modeling of brain glucose metabolism in mild Alzheimer's disease[J].Eur J Nucl Med Mol Imaging,2007,34(9):1467-1479.
[2] Profenno LA,Porsteinsson AP,Faraone SV,et al.Metaanalysis of Alzheimer's disease risk with obesity,diabetes,and related disorders[J].Biol Psychiatry,2010,67(6):505-512.
[3] Steen E,Terry BM,Rivera EJ,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease:is this type 3 diabetes?[J].J Alzheimers Dis,2005,7(1):63-80.
[4] Lester-Coll N,Rivera EJ,Soscia SJ,et al.Intracerebral streptozotocin model of type 3 diabetes:relevance to sporadic Alzheimer's disease[J].J Alzheimers Dis,2006,9(1):13-33.
[5] Fehm HL,Kern W,Peters A.The selfish brain:competition for energy resources[J].Prog Brain Res,2006,153:129-140.
[6] Ivançevic'V,Alavi A,Souder E,et al.Regional cerebral glucose metabolism in healthy volunteers determined by fluordeoxyglucose positron emission tomography:appearance and variance in the transaxial,coronal,and sagittal planes[J].Clin Nucl Med,2000,25(8):596-602.
[7] Mosconi L,Tsui WH,Herholz K,et al.Multicenter standardized 18F-FDG PET diagnosis of mild cognitive impairment,Alzheimer's disease,and other dementias[J].J Nucl Med,2008,49(3):390-398.
[8] Zhao WQ,Townsend M.Insulin resistance and amyloidogenesis as common molecular foundation for type 2 diabetes and Alzheimer's disease[J].Biochim Biophys Acta,2009,1792(5):482-496.
[9] Rivera E,Goldin A,Fulmer N,et al.Insulin and insulinlike growth factor expression and function deteriorate with progression of Alzheimer's disease:link to brain reductions in acetylcholine[J].J Alzheimer Dis,2005,8(3):247-268.
[10] 张晓洁,杨思思,张木勋,等.2型糖尿病与阿尔茨海默病互为发病风险的机制探讨[J].中国病理生理杂志,2010,26(6):1107-1114.
[11] de la Monte SM.Insulin resistance and Alzheimer's disease[J].BMB Rep,2009,42(8):475-481.
[12] Shipton OA,Leitz JR,Dworzak J,et al.Tau protein is required for amyloid β-induced impairment of hippocampal long-term potentiation[J].J Neurosci,2011,31(5):1688-1692.
[13] Farris W,Mansourian S,Chang Y,et al.Insulin-degrading enzyme regulates the levels of insulin,amyloid β-protein,and the β-amyloid precursor protein intracellular domain in vivo[J].Proc Natl Acad Sci U S A,2003,100(7):4162-4167.

