GATA-4在妊娠期糖尿病胎鼠心脏中的表达*
孙凤杰, 任建兵, 黄 晓, 吴 瑕, 李 艳, 杨雪松, 柳国胜△
(暨南大学 1附属第一医院新生儿科, 2医学院组织与胚胎学系,广东 广州 510632)
GATA-4在妊娠期糖尿病胎鼠心脏中的表达*
孙凤杰1, 任建兵1, 黄 晓1, 吴 瑕1, 李 艳2, 杨雪松2, 柳国胜1△
(暨南大学1附属第一医院新生儿科,2医学院组织与胚胎学系,广东 广州 510632)
目的了解妊娠期糖尿病(gestational diabetes mellitus, GDM)胎鼠心脏发育过程中锌指转录因子GATA结合蛋白4(GATA binding protein 4, GATA-4)的变化规律,为深入探讨其在GDM胎鼠心脏发育异常中的作用机制奠定基础。方法80只SPF级成年SD雌鼠随机分为对照组(n=40)和GDM组(n= 40),通过阴道涂片确定受孕后,GDM 组予腹腔注射2%链脲佐菌素(streptozotocin, STZ;每只40 mg/kg),对照组予腹腔注射等量的柠檬酸-柠檬酸钠缓冲液。给药72 h后每天监测血糖,各组分别于孕12、15、19 d剖取胎鼠心脏组织,HE染色观察心脏组织病理变化,免疫组化检测GATA-4的表达,实时荧光定量RT-PCR检测GATA-4 mRNA的表达,Western blotting检测GATA-4蛋白的变化。结果对照组及GDM组GATA-4蛋白的表达呈动态变化:孕12 d可见表达,孕15 d表达最高,孕19 d表达下降;与对照组相比,GDM组GATA-4 mRNA及蛋白的表达呈现下降趋势,差异有统计学意义(P<0.05)。结论妊娠期糖尿病胎鼠心脏发育异常率显著增高,GATA-4与GDM胎鼠心脏发育异常可能有相关性。
GATA结合蛋白4; 妊娠期糖尿病; 心脏发育
妊娠期糖尿病(gestational diabetes mellitus, GDM)发病率呈现逐年增高的趋势,已成为备受关注的公共健康问题之一。GDM可致胎儿发育异常如巨大儿、死胎、先天畸形等,其中GDM胎儿心脏畸形发生率较高,严重影响患儿的生存质量[1-2]。
锌指转录因子GATA结合蛋白4(GATA binding protein 4, GATA-4)作为与心脏发育密切相关的调控因子之一,是心脏形成过程中的一个剂量敏感型调控子[3],该基因突变可致基因产物的转录活性下降,并影响其它心脏发育相关因子发挥作用,进而导致先天性心脏病;GATA-4亦是启动心肌细胞分化发育过程的关键因子之一[4]。但目前就GATA-4与GDM胚胎心脏发育异常关系的报道较为少见,因此本研究旨在了解GDM胎鼠心脏发育过程中GATA-4表达的变化规律,为深入探讨其在GDM胎鼠心脏发育异常中的作用机制奠定基础。
材 料 和 方 法
1材料
1.1动物 SPF级健康成年SD雌鼠80只、体质量(220±20)g,SD雄鼠25只、体质量(300±20)g,购于广东省医学实验动物中心,实验动物许可证号为SCXK (粤) 2008-0002,粤监证字为2008A020。
1.2主要试剂 链脲佐菌素(streptozotocin, STZ)购自Sigma;GATA-4抗体购自Santa Cruz;Trizol提取液购自Invitrogen;SYBR Green荧光定量PCR试剂盒购自TaKaRa;HRP标记的GAPDH优质内参购自上海康成生物公司;蛋白样品初步定量采用南京凯基生物发展有限公司提供的试剂盒(型号为KGPBCA);其它生化试剂均为进口分装或国产分析纯。
2方法
2.1实验分组及建立GDM模型鼠 将SD鼠适应性饲养1周,均给予正常饮食饮水,按昼夜规律控制光线,每天更换垫料,称量体重、检测血糖(血糖≥7.0 mmol/L者剔除,本实验中尚无剔除者)并编号。取SD雌鼠与雄鼠(雌雄比例为3∶1)合笼过夜后次晨将雌鼠行阴道分泌物涂片、镜检,发现精子者记为妊娠0 d,标记孕鼠并计算孕期,进行隔离喂养,随机分为对照组和GDM组。
GDM组:将镜检发现精子的雌鼠空腹8 h后,采用0.1 mol/L、pH 4.4的柠檬酸-柠檬酸钠缓冲液配制成2% STZ新鲜溶液,按每只40 mg/kg单侧腹腔注射,4 h后给予正常饮食,72 h后测定血糖并称量体重;若血糖≥ 8.12 mmol/L纳入该组[5]。对照组:按照上述方法注射等量的柠檬酸-柠檬酸钠缓冲液作为对照研究。 再次将对照组及GDM组孕鼠依据剖宫日期随机分为孕12、15、19 d 3个亚组。
2.2标本收集及样本制备 给药72 h后每天检测孕鼠血糖及体重,各组分别于孕12、15、19 d随机剖宫,观察孕鼠流产情况,检查胎鼠的外部形态(包括活胎、死胎及吸收胎等),称量胎鼠体重并取材。
2.3苏木素-伊红(hematoxylin-eosion,HE)染色 采用4%多聚甲醛溶液固定各实验分组之心脏组织,常规脱水及石蜡包埋,制备成3 μm连续切片后行HE染色,光镜下观察各组胎鼠心脏组织的病理学改变。
2.4免疫组化检测胎鼠心脏组织GATA-4蛋白的表达 将石蜡包埋的心脏组织进行脱蜡处理、组织抗原修复,依据链霉菌抗生物素蛋白-过氧化物酶连接法(streptavidin-peroxidase conjunction method, S-P法)操作说明书处理,DAB染色、苏木素复染、脱水、中性树胶封固,拍照保存并运用Image-Pro Plus 6.0行图像分析。
2.5胎鼠心脏组织GATA-4 mRNA测定 采用Trizol法抽提胎鼠心脏组织总RNA,紫外分光光度计检测总RNA的纯度及浓度,要求A260/A280=1.8~2.0,根据所测RNA的浓度值,调整每管RNA的浓度以备下一步反转录使用;按逆转录试剂盒说明书方法,逆转录合成第1条cDNA;以β-actin为内参照,采用实时荧光定量RT-PCR进行GATA-4和β-actin产物扩增及结果分析。登陆GenBank ( http://ncbi.nlm.nih.gov/pubmed/fulltext.htlm)库获得GATA-4及β-actin cDNA序列(GATA-4: NM-144730.1;β-actin: NM-007393),引物由广州英骏生物科技有限公司合成。GATA-4上游引物5’-TCTTGACTGAGTTCTGGGCATC-3’,下游引物5’-GCAACAATCTTTAGGCTCTGGT-3’;β-actin上游引物5’-CACCCGCGAGTACAACCTTC-3’,下游引物5’-CCCATACCCACCATCACACC-3’。采用两步法PCR扩增标准程序,在其它条件不变的情况下以2 ℃为温度梯度递增,在53~63 ℃区间内进行退火温度的优化,在PCR扩增后进行熔解曲线分析,为消除加样误差,每管设3个复孔。通过检测Ct值的结果进行相对定量,采用GATA-4的Ct值减去内参β-actin的Ct值得到ΔCt,GDM组与对照组的基因表达相对定量用2-ΔΔCt表示,其意义是GDM组与对照组GATA-4 mRNA表达的倍比关系,其中ΔΔCt=ΔCtGDM组-ΔCt对照组,将上述方法所得数据行统计学分析。
2.6胎鼠心脏组织GATA-4蛋白测定 取胎鼠心脏组织约100 mg,冰上操作加500 μL RIPA裂解液(含PMSF和Cocktail)于匀浆器中反复碾碎并离心以提取总蛋白;依据试剂盒说明书对蛋白样品初步定量,取含蛋白10 μL的溶液体积为上样量,加入样品处理液,煮沸5 min,SDS-PAGE电泳120 min转至PVDF膜后,室温下用5%脱脂奶粉(脱脂奶粉+TBST)封闭1 h;洗膜后加I抗,室温孵育4 ℃过夜,TBST洗膜3次,每次5 min;加II抗,室温孵育1 h,TBST漂洗3次,每次5 min;将化学荧光发光底物均匀地加到膜的表面,且反应持续5 min;去除膜表面的残液,置于曝光盒中曝光、显影、定影;采用凝胶图像处理系统分析条带灰度值并行统计学分析。
3统计学处理
数据采用SPSS 13.0行统计学分析,数据以均数±标准差(mean±SD)表示,组内各时点采用单因素方差分析并做两两比较;同一时点GDM组和对照组之间采用t检验。以P<0.05为差异有统计学意义。
结 果
1对照组与GDM组胎鼠心脏发育畸形的比较
与对照组相比较,各时点中GDM组胎鼠心脏发育异常发生率增高,差异有统计学意义(P<0.05),见表1。

表1 对照组与GDM组胎鼠心脏畸形例数的比较
△P<0.05vscontrol group at the same time point.
2各组胎鼠心脏组织病理变化
对照组:胎鼠发育至第12 d房间孔已基本发育完全,部分与心内膜垫之间存有室间孔;至第15 d室间隔膜部形成,心房壁上出现肌小梁结构、心室壁增厚;第19 d心房心室壁继续增厚,肌小梁增多、增粗。同一时点对照组心脏大小匀称、心室规整、各瓣膜未见明显异常;高倍镜下可见心肌细胞呈椭圆形、排列整齐且肌浆丰富,位于细胞中央的细胞核呈圆形或椭圆形且染色均匀,见图1。
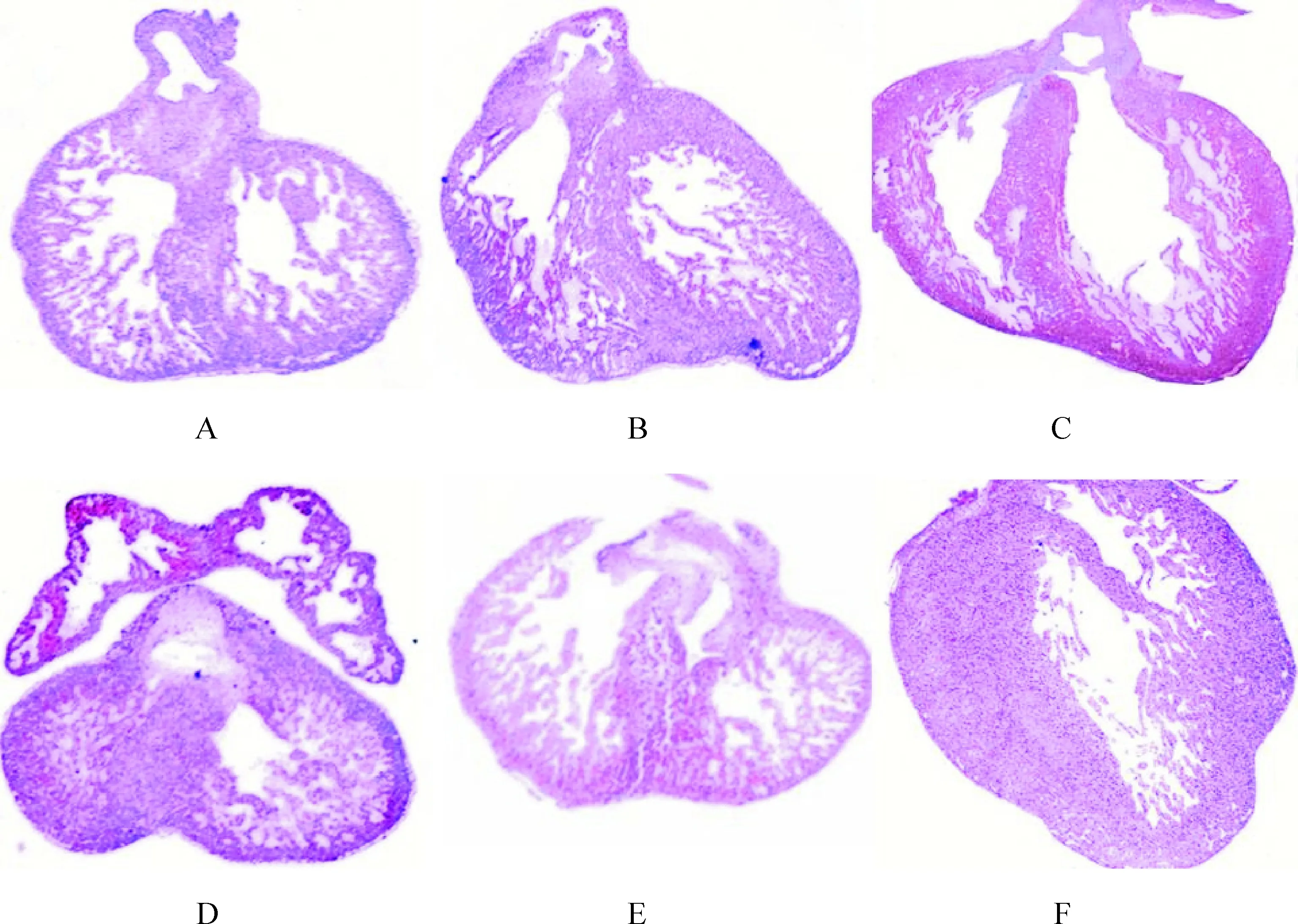
Figure 1. The changes of fetal cardiac tissues on E12, E15 and E19 in control and GDM groups (HE staining, ×25). A, B, C: control group on E12, E15 and E19, respectively; D: GDM group on E12, truncus arteriosus communis; E: GDM group on E15, interventricular septum rupture; F: GDM group on E19, myocardial hypertrophy.
图1对照组和GDM组孕12、15和19d胎鼠心脏组织的变化
GDM组:畸心胎数目较多,胚胎第12 d可见动脉单干等圆锥干发育畸形;胚胎第15 d有室间隔缺损及室间隔裂等病变;至第19 d可见心肌壁肥厚等畸形。高倍镜下可见心肌细胞结构紊乱伴水肿及坏死,成片的无结构区、胞浆溶解、胞核形态不规则且大小不一伴染色不均,见图1。
3免疫组化检测各组胎鼠心脏组织GATA-4蛋白的表达
GATA-4蛋白的表达呈现动态变化,胚胎第12 d表达于心房、心室的心肌细胞等部位;胚胎第15 d在房、室间隔等处的心肌、心内膜及瓣膜处表达较明显;胚胎第19 d仍表达于以上部位但表达不明显,见图2。在同一时点GDM组GATA-4的表达较对照组下降,差异有统计学意义(P<0.05),见表2。
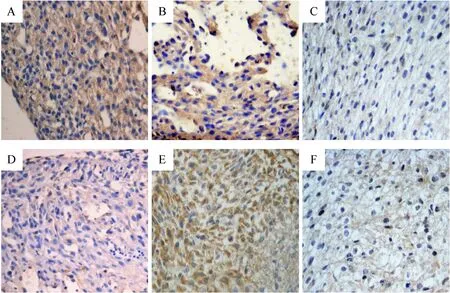
Figure 2. The expression of GATA-4 on E12, E15 and E19 in control and GDM groups (immunohistochemical staining, ×200). A, B, C: control group on E12, E15 and E19, respectively; D, E, F: GDM group on E12, E15 and E19, respectively. Compared with control group on E12, E15 and E19, the expression of GATA-4 in GDM group deceased at the same time points.
图2对照组和GDM组孕12、15和19d胎鼠心脏组织GATA-4的表达
表2免疫组化检测胎鼠心脏组织GATA-4蛋白的表达
Table 2. The expression of GATA-4 protein in cardiac tissues of fetal mice detected by immunohistochemistry (mean±SD.n=9)

GroupE12E15E19Control1.15±0.011.53±0.09★0.92±0.06GDM0.84±0.07▲1.28±0.04▲★0.71±0.02▲
▲P<0.05vscontrol group at the same time point;★P<0.05vsthe same group on E12 and E19.
4各组胎鼠心脏组织GATA-4mRNA的表达水平
与对照组相比较,各时点的GDM组胎鼠心脏组织GATA-4 mRNA表达下降,差异有统计学意义(P<0.05),见图3。
5各组胎鼠心脏组织GATA-4蛋白的表达变化
Western blotting检测结果显示,各组胎鼠心脏组织中均有GATA-4蛋白的表达,与对照组相比,各时点GDM组GATA-4蛋白表达均减少 (P<0.05),见图4。
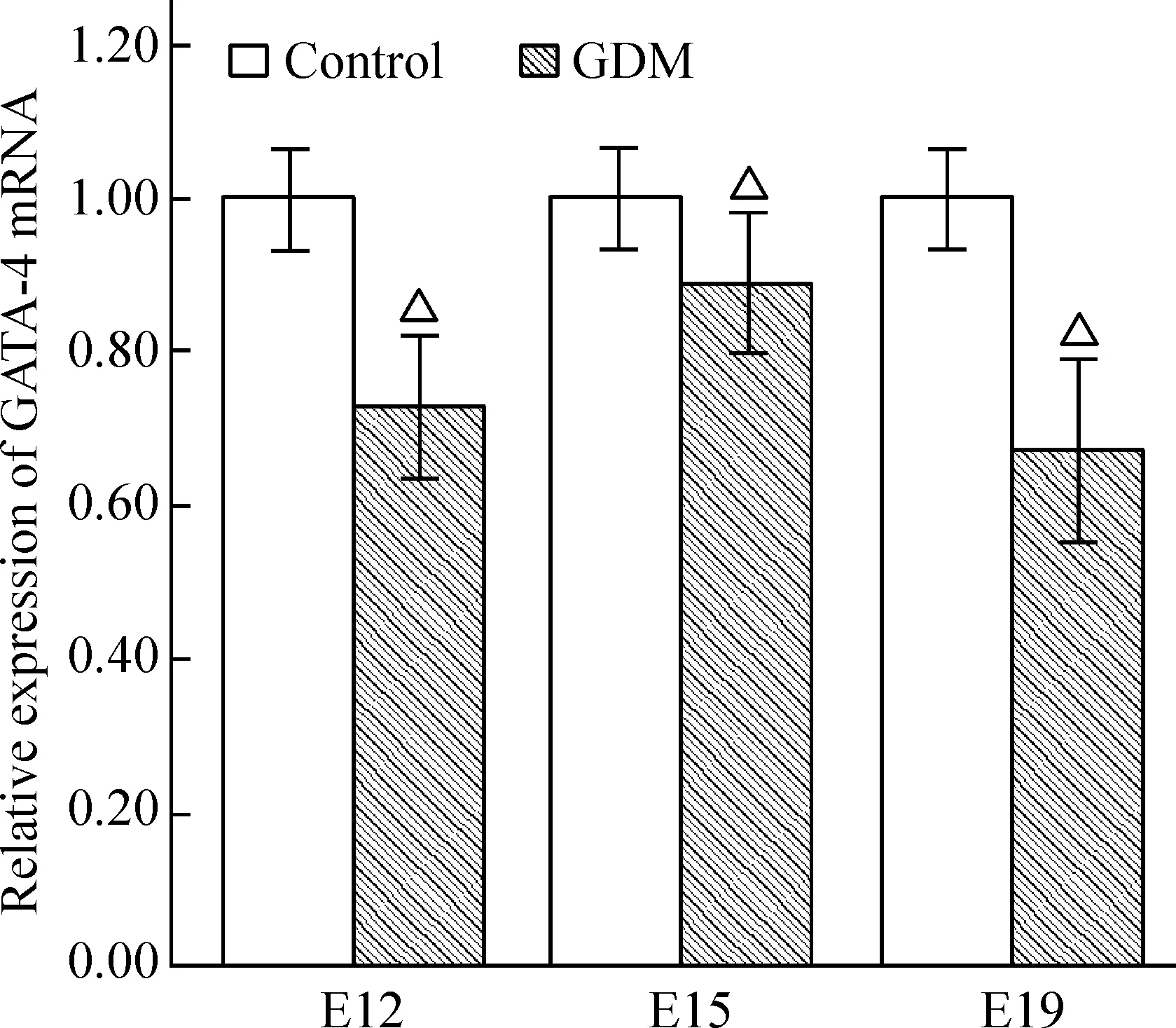
Figure 3. Expression of GATA-4 mRNA in fetal mouse cardiac tissues from each group measured by real-time fluorescence quantitative RT-PCR.Mean±SD.n=9.△P<0.05vscontrol group at the same time point.
图3实时荧光定量RT-PCR检测各组胎鼠心脏组织GATA-4mRNA的表达
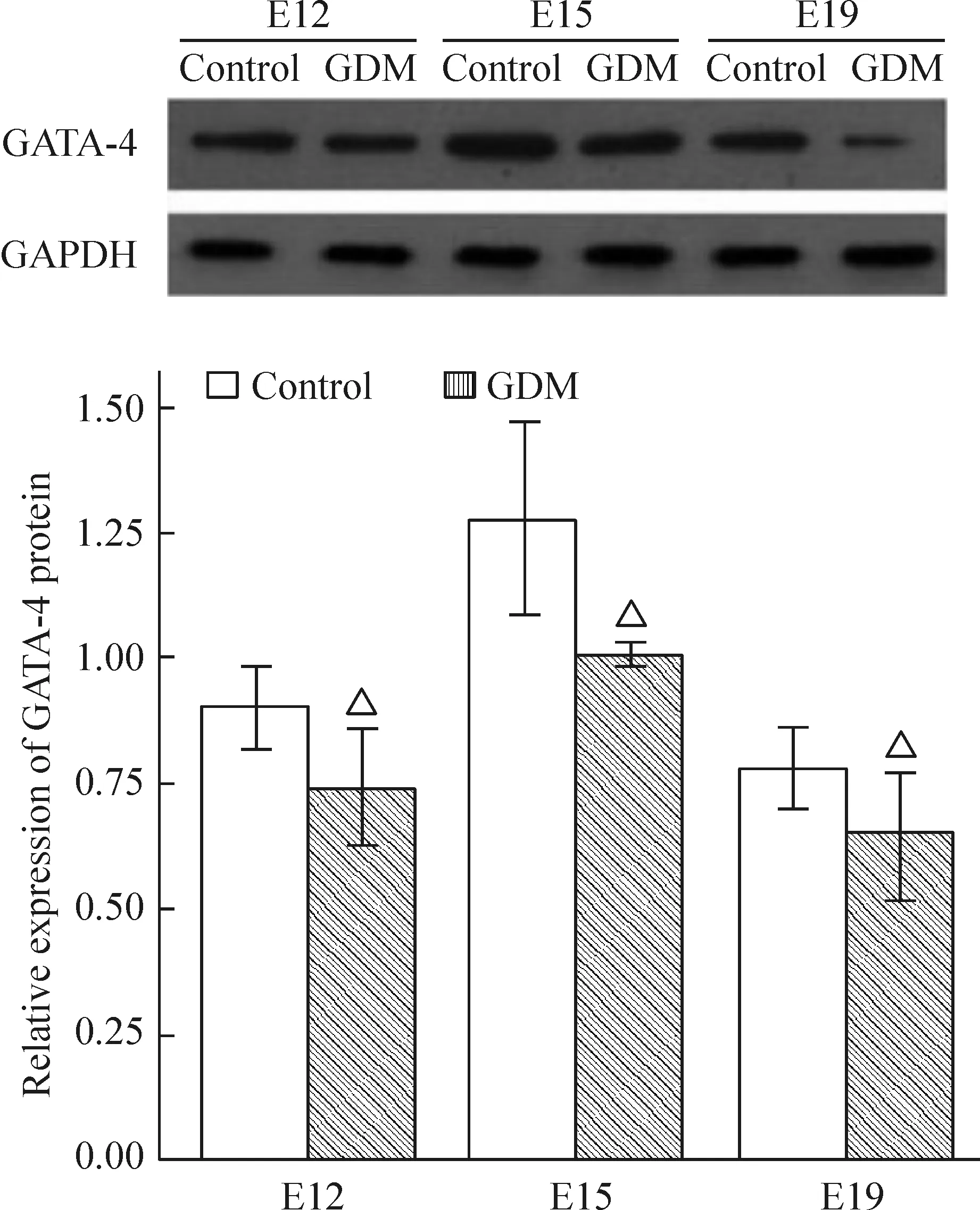
Figure 4. Expression of GATA-4 protein in fetal mouse cardiac tissues from each group measured by Western blotting. Mean±SD.n=3.△P<0.05vscontrol group at the same time point.
图4各组胎鼠心脏组织GATA-4的表达
讨 论
GDM是妊娠后首次发现或发病的糖尿病,糖尿病孕妇中80%以上为GDM[6],其对孕母及胎儿均有不良影响,是发生胚胎期心血管畸形的病因之一。GDM发病机制尚未完全阐明,高血糖通过许多生物化学机制诱导损害,但尤以高血糖诱发线粒体活性氧簇(reactive oxygen species,ROS)的产生[7]及细胞凋亡[8]为著;同时,GDM的发病也与遗传及免疫因素等相关[9]。本实验在采用2%STZ腹腔注射已受孕的SD雌鼠成功建立GDM模型鼠的基础上,发现GDM组中吸收胎、死胎、畸心胎、巨大胎儿等发育异常例数较对照组明显增高;GDM组胎鼠心脏发育异常(包括心室流出道梗阻、室间隔缺损及室间隔裂、肌壁肥厚、心腔扩大等)的发生率较对照组有明显升高,与临床资料中GDM孕母所致胎儿心脏发育异常之病理类型相符合[10]。
GATA-4贯穿于心脏发育的整个过程,是一个具有重要作用的转录因子,为心脏正常发育所必需,且调控许多心脏转录基因的表达,并通过其锌指结构与其它心脏转录因子相互作用[11]。GATA-4作为心脏发育调控网络的核心因子之一[12],主要表达于胚胎期的心脏、性腺、肝脏和内胚层等,与其它因子协同控制着心原细胞的特异性分化、心脏祖细胞的迁移及心管的形成等,然而由GDM诱导的胎鼠心脏发育过程中GATA-4所发挥的作用尚未明确。
本实验结果显示:孕12 d、孕15 d、孕19 d GDM组及对照组胎鼠心脏中均可检测到GATA-4的表达:孕12 d表达于心室和心房处的心肌细胞、心内膜垫、大动脉根部等,孕15 d表达有所上调且在房室间隔、瓣膜处等均可检测到,孕19 d表达有所下降,表明GATA-4在胚胎心脏发育过程中呈现一个动态的变化过程,上述结果与以往的文献报道相一致[13]。
Kobayashi等[14]研究发现:高血糖环境中大鼠心肌细胞表达的GATA-4蛋白含量明显下降,同时由STZ所诱导的糖尿病模型鼠之心脏组织中发现GATA-4蛋白水平亦减少,过表达GATA-4有阻止高血糖所致的GATA-4降解及心肌细胞死亡的作用,提示GATA-4蛋白降解的增多可能为高血糖致心脏畸形的一个重要作用机制,心脏的GATA-4基因失活可诱发凋亡和心脏功能的损害。本实验表明,与对照组相比较,孕12 d、孕15 d及孕19 d GDM模型鼠的mRNA水平呈下降趋势且差异有统计学意义(P<0.05);孕12 d、孕15 d及孕19 d GDM模型鼠GATA-4的蛋白水平较对照组下降(P<0.05),提示高血糖环境中胚胎体内的GATA-4存在着质或量的改变,致使处于发育阶段的心脏出现畸形改变。GATA-4是心脏发育过程中(尤其是早期阶段)的重要转录因子,很多心脏结构基因序列中存在GATA-4结合位点,在原始心肌细胞中此结合位点对于增强子的活性是必需的。GATA-4是心脏形成过程中一个必需的剂量依赖性转录因子,胚胎的存活及心脏发育均需GATA-4表达于正常阈值的30%~50%范围内,当GATA-4低于此水平时心肌细胞复制减少,引发心肌发育不全和心内膜垫缺损等畸形[3]。
GATA-4调控着多种心脏基因的表达,作为心脏发育的核心调控因子的GATA-4,其本身蛋白水平的变化可引发其它相关因子的瀑布式效应[12],继而导致胚胎期心脏发育异常,最终诱发心脏组织结构异常如突变型GATA-4致二尖瓣与三尖瓣肥厚[15]; GATA-4具有直接调控抗凋亡蛋白Bcl-XL和激活Bcl-2启动子的作用,进而阻止心肌细胞的程序性死亡[16];GATA-4作为一个抗凋亡因子,对心脏发育过程起着保护作用[17]。本实验中GATA-4蛋白表达降低可能与其抗凋亡作用减弱有关,进而导致心脏发育异常。与此同时研究表明:培养的心肌细胞中过表达GATA-4可上调Bcl-2的表达;作为GATA-4下游的抗凋亡蛋白,Bcl-2能够抑制细胞的自噬作用,且减少的GATA-4和细胞自噬作用的诱发是紧密相关的;GATA-4是作为一个能对许多心脏基因进行调节的正面转录调控体,既有抗凋亡作用也有抗细胞自噬作用的活性[18]。此外研究发现:培养的心肌细胞中高浓度糖可诱导ROS的产生及细胞死亡,给予糖尿病模型鼠抗氧化剂治疗对于延缓心脏发育的病理过程具有一定的作用,但其作用于人类糖尿病相关的心脏发育过程中具有很多的限制性效应,尚需前瞻性临床资料证实之。总之,阻止GATA-4蛋白表达的减少和/或提升GATA4-Bcl-2的表达之治疗策略有减少GDM所致的胎儿心脏发育异常之可能性。
[1] Bener A, Saleh NM, Al-Hamaq A. Prevalence of gestational diabetes and associated maternal and neonatal complications in a fast-developing community: global comparisons[J]. Int J Womens Health, 2011,3:367-373.
[2] Yessoufou A, Moutairou K.Maternal diabetes in pregnancy: early and long-term outcomes on the offspring and the concept of "metabolic memory"[J]. Exp Diabetes Res, 2011, 2011:218598.
[3] Oka T,Maillet M,Watt AJ,et al. Cardiac-specific deletion of GATA-4 reveals its requirement for hypertrophy, compensation, and myocyte viability[J]. Circ Res, 2006, 98(6):837-845.
[4] Takeuchi JK, Bruneau BG. Directed transdifferentiation of mouse mesoderm to heart tissue by defined factors[J]. Nature, 2009, 459(7247):708-711.
[5] 柳国胜,赵立华,刘海英,等. 链脲霉素致大鼠妊娠糖尿病影响子鼠发育的实验模型研究[J].中国新生儿科杂志,2008,23(1):26-29.
[6] 丰有吉, 沈 铿, 马 丁, 等. 妇产科学[M]. 第2版. 北京:人民卫生出版社, 2010:140-143.
[7] 王秋林,王浩毅,王 树. 氧化应激状态的评价[J].中国病理生理杂志,2005,21(10):2069-2074.
[8] 王红祥,赵 湜,李宾公,等. 高糖对糖尿病患者内皮祖细胞增殖凋亡的影响及其机制探讨[J]. 中国病理生理杂志,2007,23(11): 2210-2213.
[9] Gutierrez JC, Prater MR, Smith BJ,et al. Late-gestation ventricular myocardial reduction in fetuses of hyperglycemic CD1 mice is associated with increased apoptosis[J]. Birth Defects Res B Dev Reprod Toxicol, 2009, 86(5):409-415.
[10]Lisowski LA, Verheijen PM, Copel JA, et al. Congenital heart disease in pregnancies complicated by maternal diabetes mellitus. An international clinical collaboration, literature review, and meta-analysis[J]. Herz, 2010, 35(1):19-26.
[11]周 云,何晓宇. 转录因子GATA-4突变与先天性心脏病研究进展[J]. 国外医学:妇产科学分册,2006,33(6):401-404.
[12]Olson EN. Gene regulatory networks in the evolution and development of the heart[J]. Science, 2006, 313(5795):1922-1927.
[13]孙凤荣,龚 杰,钱玲梅,等.GATA-4基因在大鼠胚胎心脏中的表达[J]. 南京医科大学学报:自然科学版, 2007, 27(6):555-557.
[14]Kobayashi S, Mao K, Zheng H, et al. Diminished GATA4 protein levels contribute to hyperglycemia-induced cardiomyocyte injury[J]. J Biol Chem, 2007, 282(30):21945-21952.
[15]Laforest B, Nemer M. GATA5 interacts with GATA4 and GATA6 in outflow tract development[J]. Dev Biol, 2011,358(2):368-378.
[16]Little GH, Saw A, Bai Y, et al. Critical role of nuclear calcium/calmodulin-dependent protein kinase IIδB in cardiomyocyte survival in cardiomyopathy[J]. J Biol Chem, 2009, 284(37):24857-24868.
[17]Rysä J, Tenhunen O, Serpi R, et al. GATA-4 is an angiogenic survival factor of the infarcted heart[J]. Circ Heart Fail, 2010, 3(3):440-450.
[18]Kobayashi S, Volden P, Timm D, et al. Transcription factor GATA4 inhibits doxorubicin-induced autophagy and cardiomyocyte death[J]. J Biol Chem, 2010,285(1):793-804.
ExpressionoftranscriptionfactorGATA-4duringcardiacdevelopmentinfetalmicefromgestationaldiabetesmellitusmice
SUN Feng-jie1, REN Jian-bing1, HUANG Xiao1, WU Xia1, LI Yan2, YANG Xue-song2, LIU Guo-sheng1
(1DepartmentofNeonatology,theFirstAffiliatedHospital,2DepartmentofHistologyandEmbryology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tlgs@jnu.edu.cn)
AIM: To study the expression of transcription factor GATA binding protein 4 (GATA-4) in the development of the cardiac tissues in the fetal mice from gestational diabetes mellitus (GDM) mice, and to investigate the potential pathogenesis of GDM-induced congenital cardiac defects in mice.METHODSThe adult Sprague-Dawley female mice were randomly divided into control group (n=40) and GDM group (n=40). The GDM model was established by intraperitoneal injection of 2% streptozotocin (STZ, 40 mg/kg body weight in 0.1 mol/L sodium citrate, pH 4.4) to the pregnant mice on the successive days. The mice in control group were injected with citric acid-sodium citrate buffer solution in the same position. Blood glucose and body weight were examined every day after STZ injection for 72 h. On E12, E15 and E19, the mice were anaesthetized and the embryonic cardiac tissues were collected after caesarean section. The histopathological changes of the cardiac tissues were observed under microscope with HE staining. The expression of GATA-4 was analyzed by the method of immunohistochemistry. The expression of GATA-4 in cardiac tissues at mRNA and protein levels was determined by real-time fluorescence quantitative RT-PCR and Western blotting.RESULTSDuring the development of embryonic heart, the expression of GATA-4 protein in the cardiac tissue was observed on E12, and it was obviously increased on E15, but it was decreasd on E19. Compared with control group, the expression of GATA-4 protein in GDM group was decreased at the time points of E12, E15 and E19. The mRNA expression of GATA-4 in GDM group was lower than that in control group at the same time points. Compared with control group, the protein level of GATA-4 in GDM group was diminished.CONCLUSIONThe morbidity of fetal cardiac malformation is significantly increased in GDM group, suggesting that GATA-4 may be involve in the development of cardiac malformation in GDM.
GATA binding protein 4; Gestational diabetes mellitus; Cardiac development
R363
A
1000-4718(2013)03-0449-06
2012- 11- 04
2012- 12- 28
暨南大学第一临床医学院科研培育专项基金
△通讯作者 Tel:020-38688838; E-mail: tlgs@jnu.edu.cn
10.3969/j.issn.1000- 4718.2013.03.012

