过表达TAP1上调人胶质瘤细胞株U251 HLA-I的表达*
欧阳乐平, 张善义, 李军亮, 许新科, 翁胤仑, 郑眉光, 王圣文, 李方成
(中山大学孙逸仙纪念医院神经外科,广东 广州 510120)
过表达TAP1上调人胶质瘤细胞株U251 HLA-I的表达*
欧阳乐平, 张善义, 李军亮, 许新科, 翁胤仑, 郑眉光, 王圣文, 李方成△
(中山大学孙逸仙纪念医院神经外科,广东 广州 510120)
目的探讨抗原提呈相关转运蛋白1(TAP1)过表达对人胶质瘤细胞株U251人类白细胞抗原I(HLA-I)表达的影响。方法培养 U251细胞,构建慢病毒载体并转染U251细胞,获得稳定高表达TAP1的细胞株并设立转染空载体对照组,分别收集U251细胞组、空载体对照组和TAP1基因转染细胞组细胞的蛋白和RNA,行real-time PCR 和Western blotting分析过表达的TAP1对U251细胞HLA-I表达的影响,并用流式细胞术分析U251细胞HLA-I表面呈现的变化。结果成功建立TAP1高表达U251细胞株,TAP1 mRNA和蛋白分别升高(8.73±1.07)倍和(11.71±0.83)倍。高表达的TAP1促进U251细胞HLA-A、HLA-B、HLA-C(重链)和β2微球蛋白(轻链) mRNA表达上调,分别升高(3.51±0.36)倍、(4.78±0.85)倍、(2.94±0.28)倍和(3.23±0.24)倍, HLA-I蛋白表达升高(3.14±0.53)倍,同时U251细胞HLA-I的表面呈现明显增多,差异有统计学意义(P<0.05)。结论过表达TAP1能促进U251细胞HLA-I表达及其在细胞表面呈现的提高。
神经胶质瘤; U251细胞; 抗原提呈相关转运蛋白1; 人类白细胞抗原I
胶质瘤是中枢神经系统最常见的恶性肿瘤,因其浸润性生长,与正常脑组织分界不清,手术难以完全切除,且对放疗、化疗不敏感,治疗效果一直不理想。利用免疫学方法,通过增强机体抗肿瘤免疫反应,达到清除肿瘤的目的,是一种常见的治疗方式。抗原提呈系统(antigen-processing machinery, APM)是抗肿瘤免疫过程的重要组成部分,主要包括蛋白酶体复合物LMP2(low molecular mass polypeptide 2)/ LMP7(low molecular mass polypeptide 7)、抗原提呈相关转运蛋白TAP1(transporter associated with antigen processing 1)/TAP2(transporter associated with antigen processing 2)和HLA-I(human leukocyte antigen I)等。肿瘤抗原在蛋白酶体复合物中降解、切割成适合T细胞识别的肽段,然后由抗原提呈相关转运蛋白转运到内质网中,经过进一步的修饰后结合到HLA-I分子上并呈现于细胞表面供CD8+T细胞识别,从而启动特异性的抗肿瘤免疫反应。TAP1是抗原提呈系统的一个核心蛋白,当其表达异常时使抗原提呈的活性降低,同时影响HLA-I分子在细胞表面的呈现[1]。TAP1在包括胶质瘤在内的多种肿瘤中表达低下甚至缺失,且其表达水平与肿瘤的分期及预后密切相关。研究TAP1在抗原提呈系统中的表达及其在机体抗肿瘤免疫中的作用具有重要意义。本研究通过构建慢病毒包装载体高表达TAP1,初步探讨过表达的TAP1对U251胶质瘤细胞HLA-I表达及其表面呈现的影响。
材 料 和 方 法
1主要试剂及仪器
Lenti-X HTX 慢病毒包装试剂盒、限制性内切酶(EcoR I和BamH I)、TaKaRa T4连接酶、细胞RNA提取试剂盒、实时荧光定量逆转录试剂盒和SYBR Green PCR实时荧光定量PCR试剂盒均购自TaKaRa。ECL 显色液、DMEM 高糖培养基、胎牛血清(fetal bovine serum,FBS)和胰蛋白酶购自Invitrogen。10cm 细胞培养皿购自Corning。兔抗人TAP1、HLA-I、GAPDH多克隆IgG 抗体和羊抗兔IgGⅡ抗购于Abcam。慢病毒表达载体pSIN-EF2-IRES-GFP-puro和含有TAP1全长基因的GV230-TAP1质粒购自广州赛业生物公司。U251细胞株和293T细胞购自中山大学动物实验中心,大肠埃希菌菌株DH5α感受态购自天根公司。
2高表达TAP1的慢病毒载体构建
GV230-TAP1质粒与pSIN-EF2-IRES-GFP-puro 慢病毒载体分别经BamH I和EcoR I双酶切,酶切充分后用0.8%琼脂糖凝胶电泳。紫外灯观测分离片段,用Axygen 凝胶回收试剂盒回收。酶切产物TAP1片段及pSIN-EF2-IRES-GFP-puro混匀后,加TaKaRa T4 连接酶16 ℃连接过夜,并设立空载体对照组(不加入TAP1片段)。连接产物转化DH5α感受态细菌,置于预热后1 mL LB培养基内,并摇菌1 h。然后,取700 μL菌液离心,将沉淀用200 μL LB 培养基重悬,均匀涂布于含5 mg/L 嘌呤霉素的LB琼脂平板上,待其吸收后,倒置平皿,37 ℃培养16 h。选取9个pSIN-EF2-IRES-GFP-puro-TAP1克隆细菌菌落(分别编号为1~9号),摇菌过夜,提取质粒,分别用BamH I及EcoR I酶切,0.8%琼脂糖凝胶电泳,紫外灯下观察并照相,并将质粒送上海Invitrogen测序。酶切正确后的质粒转染293T细胞。种植5×106个293T细胞于10 cm 平皿内,汇合度达70%时,按 Lenti-X HT 慢病毒包装试剂盒说明,将pSIN-EF2-IRES-GFP-puro和psPAX、pMD2.G辅助质粒按慢病毒载体∶psPAX∶pMD2.G=4∶3∶1的比例转染293T细胞,静置于培养箱内。转染8 h后首次换液,继续换用含10%胎牛血清培养基培养,48 h后离心并分别收集上清,并用Millipore 公司0.45 μm孔径醋酸纤维素膜滤器过滤、分装(以上操作均在生物安全柜内操作),-80 ℃冰箱冻存。
3慢病毒载体感染U251细胞
种植2×105个U251 细胞于6孔板内,种植3孔,1孔用于确定筛选药物杀死正常对照细胞时间,另2孔用于感染病毒。分别用pSIN-EF2-IRES-GFP-puro载体和pSIN-EF2-TAP1-IRES-GFP-puro载体感染细胞。细胞感染24 h后,换用10%胎牛血清培养基培养。24 h后用含5 mg/L 嘌呤霉素10%胎牛血清培养基筛选细胞,直至正常对照细胞全部被杀死,得到稳定细胞株[2]。
4Real-time荧光定量PCR检测
提取细胞总RNA,分光光度计测量RNA的纯度及浓度,逆转录成 cDNA,采用SYBR Green染料法,用罗氏荧光PCR仪进行荧光PCR[3],反应条件如下:95 ℃变性2 min,以后每个循环条件为95 ℃ 10 s ,60 ℃ 10 s ,72 ℃ 30 s, 循环40次。引物序列如表1所示,以β-actin为内参照,通过 2-ΔΔCt方法进行相对定量分析。

表1 Real-time PCR引物序列
5Westernblotting分析
分别收集各组细胞,加入细胞裂解液及1%蛋白酶抑制剂提取蛋白,调整蛋白含量至各样本蛋白浓度一致。采用10% 聚丙烯酰胺凝胶电泳分离蛋白,湿转法将蛋白转移至聚偏氟烯(PVDF)膜,5%牛血清白蛋白封闭,以兔抗人IgG I抗4 ℃摇床过夜,羊抗兔Ⅱ抗室温孵育1 h,增强化学发光法显影。以GAPDH为内参照。应用Bio-Rad 公司Quantity One分析软件对显影图片进行相对定量分析。
6流式细胞术检测细胞HLA-I的表面呈现
常规消化各组细胞,PBS洗涤3次。将各组细胞与兔抗人HLA-I在4 ℃ 孵育30 min,洗涤后与PE标记的羊抗兔Ⅱ抗孵育30 min。流式细胞仪检测细胞HLA-I的表面呈现。
7统计学处理
采用SPSS 16.0软件分析,计量资料用均数±标准差(mean±SD)表示;多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1高表达TAP1的U251稳定细胞株的筛选及鉴定
U251细胞经嘌呤霉素筛选后荧光显微镜下观察,绿色荧光表现明显,见图1。行real-time PCR检测,与未转染组及空白对照组比较,转染目的基因的细胞组TAP1 mRNA表达明显升高,升高约(8.73±1.07)倍,见图2;Western blotting检测结果进一步证实,过表达组TAP1蛋白较未转染组及空白对照组升高(11.71±0.83)倍,见图3,而空载体转染组TAP1蛋白无升高。Real-time PCR和Western blotting检测结果表明,通过慢病毒载体介导,能有效地将TAP1基因导入U251胶质瘤细胞,并使其在mRNA和蛋白水平持续稳定高表达。
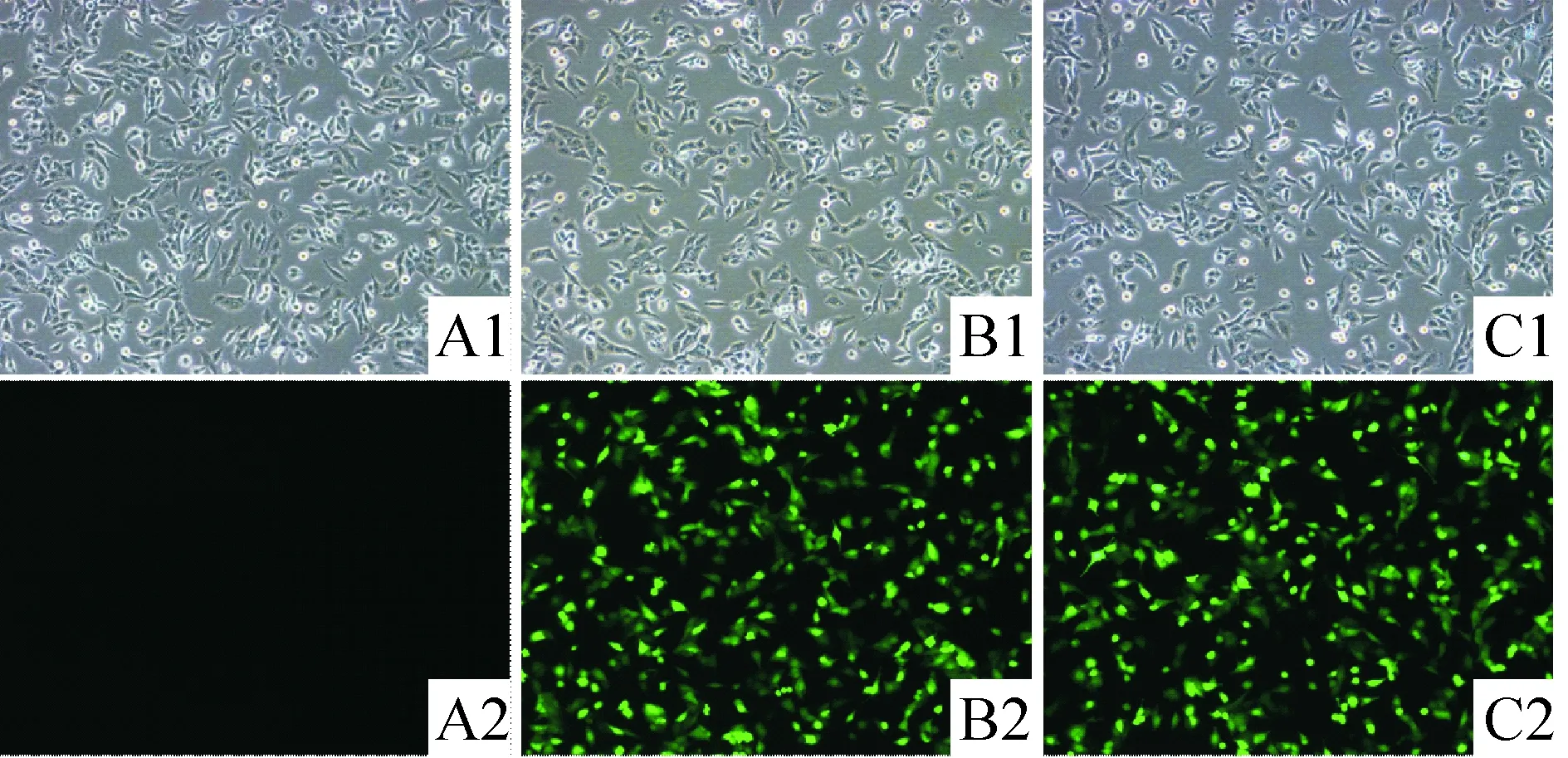
Figure 1. Transfection efficiency ofTAP1 gene in U251 cells under fluorescence microscope(×100). A1: U251 cells under white light; A2: U251 cells under purple fluorescence; B1: lenti-control under white light; B2: lenti-control under purple fluorescence; C1: lenti-TAP1 under white light; C2: lenti-TAP1 under purple fluorescence.
图1荧光显微镜下细胞绿色荧光蛋白的表达情况
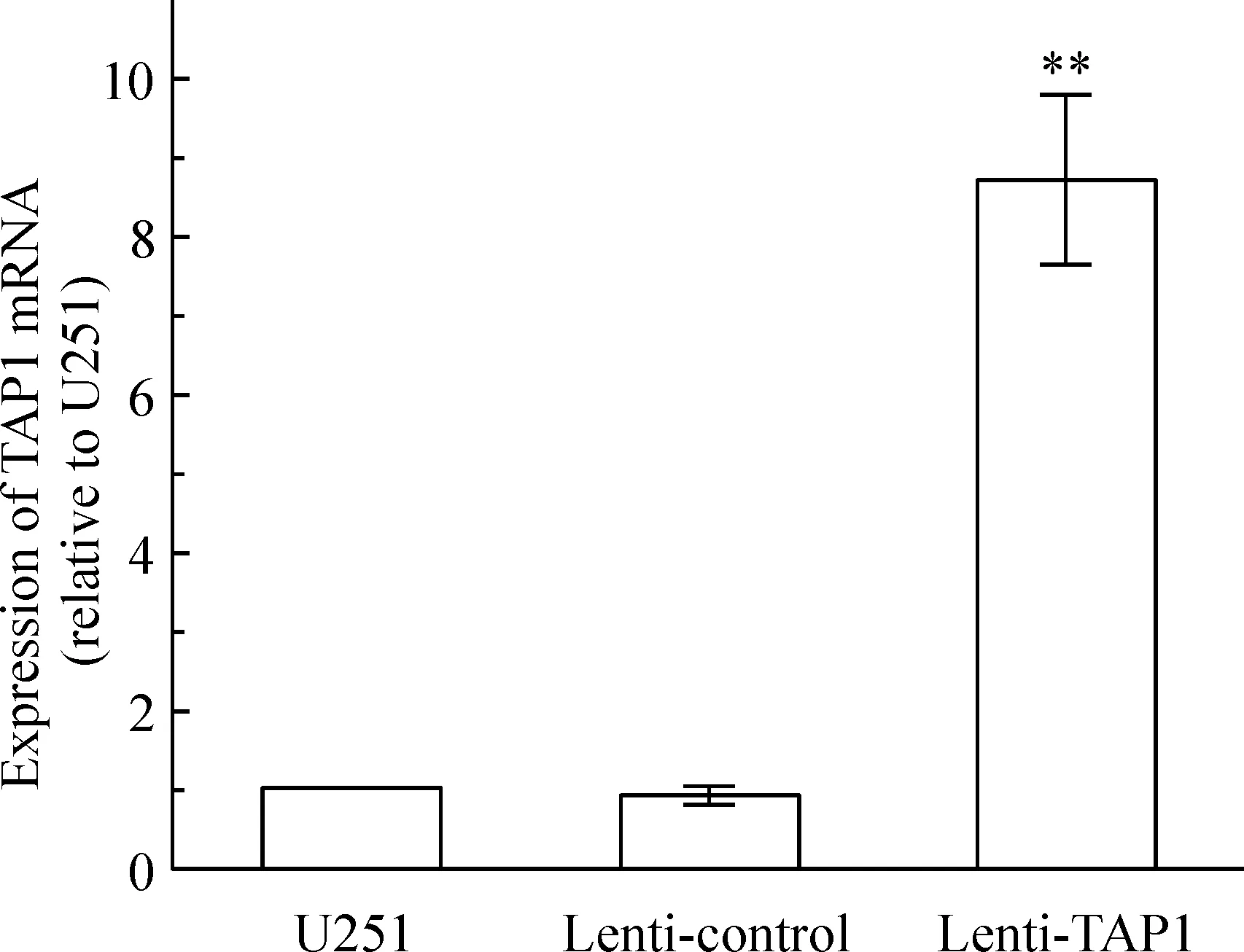
Figure 2. Overexpression of TAP1 mRNA in transfected U251 cells detected by real-time PCR. Mean±SD.n=3.**P<0.01vsU251 or lenti-control.
图2Real-timePCR检测3组细胞TAP1mRNA表达情况
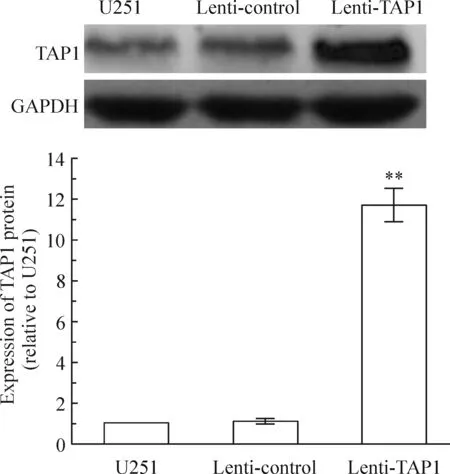
Figure 3. Expression of TAP1 protein in transfected U251 cells detected by Western blotting analysis. Mean±SD.n=3.**P<0.01vsU251 or lenti-control.
图3Westernblotting检测3组细胞TAP1蛋白的表达
2TAP1转染对U251细胞HLA-I表达的影响
Real-time PCR 分析显示,转染TAP1基因组细胞HLA-A、HLA-B、HLA-C和β2微球蛋白 mRNA水平分别较未转染组及空载体组升高(3.51±0.36)倍、(4.78±0.85)倍、(2.94±0.28)倍和(3.23±0.24)倍,见图4,空载体组与未转染组的表达水平未见明显差异。Western blotting实验显示,转染TAP1基因后,U251细胞HLA-I蛋白表达升高(3.14±0.53)倍,见图5。
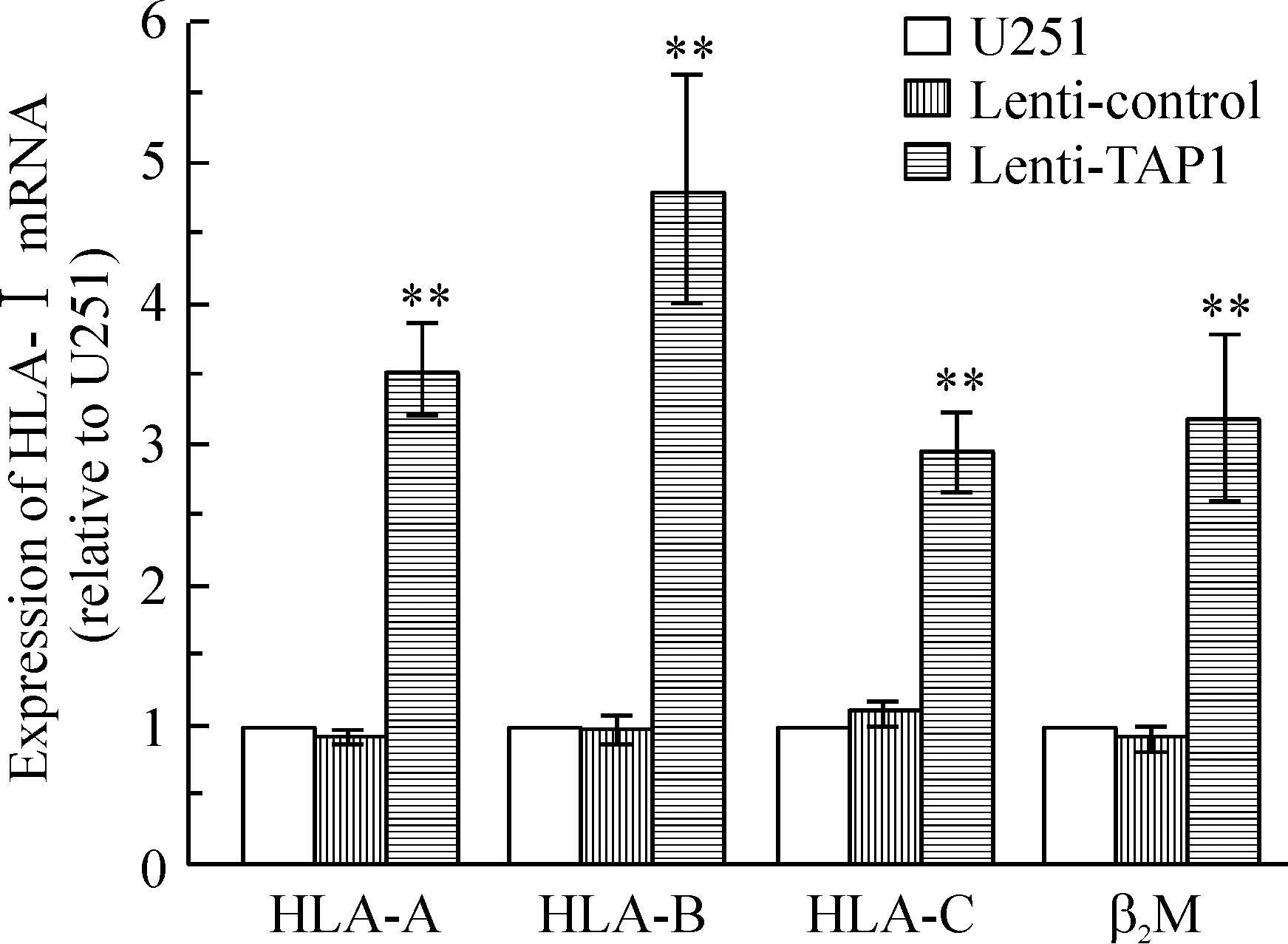
Figure 4. The expression of HLA-A, HLA-B, HLA-C and β2M mRNA in the three groups. Mean±SD.n=3.**P<0.01vsU251 or lenti-control.
图4Real-timePCR检测3组细胞HLA-A、HLA-B、HLA-C和β2微球蛋白mRNA的表达
3过表达的TAP1对细胞HLA-I表面呈现的影响
流式细胞术结果显示,U251细胞低呈现HLA-I,转染TAP1基因后,U251细胞表面HLA-I的呈现较未转染组与空载体组均明显增多,HLA-I阳性细胞数升高了(4.13±0.76)倍,差异有统计学意义(P<0.05)。未转染组与空载体组相比差异无统计学意义(P>0.05),见图6。
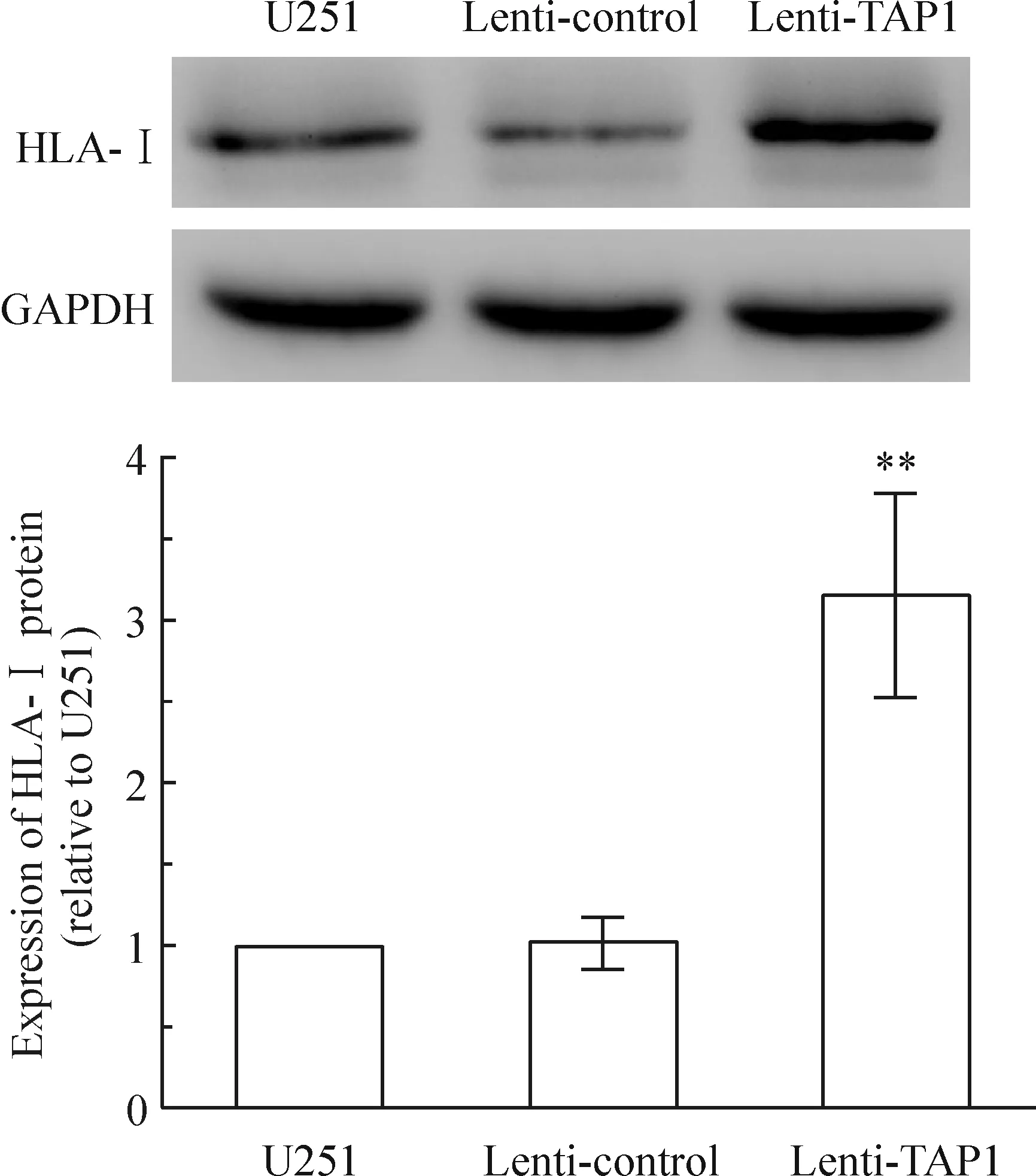
Figure 5. Expression of HLA-I protein in the three groups detected by Western blotting. Mean±SD.n=3.**P<0.01vsU251 or lenti-control.
图5Westernblotting检测3组细胞HLA-I蛋白的表达
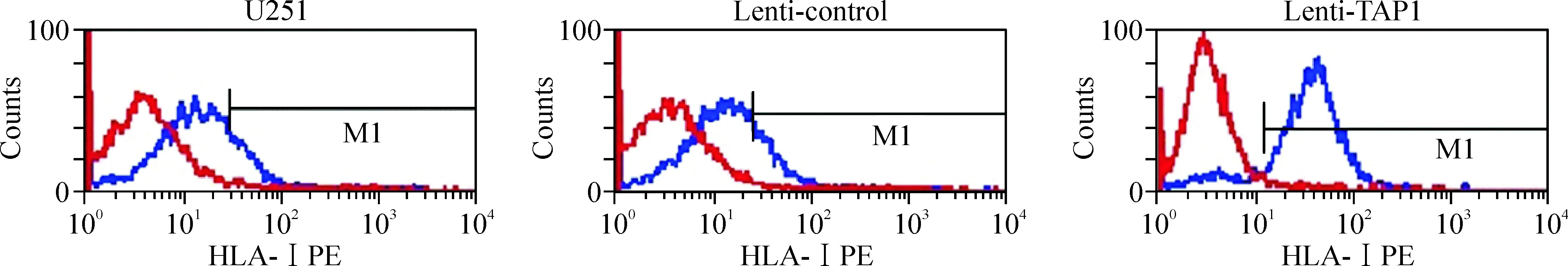
Figure 6. Up-regulated TAP1 increased the surface expression of HLA class I in U251 cells.
图6流式细胞术检测各组细胞表面HLA-I的表达
讨 论
抗肿瘤反应的关键在于激活CD8+T细胞,CD8+T细胞的活化依赖于其识别由细胞表面HLA-I分子提供的抗原肽。HLA-I分子是由重链(α链)和轻链(β链)经共价键连接成的异二聚体,α链主要由HLA-A、HLA-B和HLA-C基因编码,β链即β2微球蛋白。细胞膜上HLA-I分子表达需要α链和β链同时存在[4]。在肿瘤逃避机体免疫监视的机制中,HLA-I表达异常是常见的原因。有研究显示,HLA-I类分子在乳腺癌、前列腺癌、膀胱癌、黑色素瘤、小细胞肺癌等多种肿瘤中部分或整体表达低下或缺如,导致机体抗肿瘤反应的缺失,相似的报告亦见于胶质瘤[5]。影响HLA-I表达的因素众多,抗原提呈相关转运蛋白表达的下调或缺失是常见的原因[6]。抗原提呈相关转运蛋白是由TAP1/TAP2组成的二聚体复合物,跨膜镶嵌在内质网膜上,将蛋白酶体降解的肽段由细胞液中转运到内质网中的空HLA-I分子上从而启动特异性的细胞免疫反应, 在这一过程中,TAP1发挥着主要的作用[7]。有研究显示,IFN-λ在上调TAP1后能进一步导致HLA-I表达的增加[8]。在黑色素瘤中,通过导入TAP1基因可有效地重建HLA-I在肿瘤细胞表面的呈现从而启动特异性的抗肿瘤免疫反应[9]。在胶质瘤中,TAP1和HLA-I常表达低下或二者表达协同缺失。鉴于此,我们通过构建TAP1慢病毒载体并转染胶质瘤U251细胞,对TAP1和HLA-I的关系进行初步研究。
慢病毒载体是近年发展起来的基因转移载体,介导的基因转移可以整合入宿主的基因组中,具有可感染分裂细胞及非分裂细胞、转移基因片段容量较大、目的基因表达时间长、不易诱发宿主免疫反应等优点[10]。我们在实验中成功地构建TAP1慢病毒载体,并感染胶质瘤U251细胞,经过PCR和Western blotting证实,TAP1 mRNA及蛋白稳定高表达。随后,我们进一步检测了过表达的TAP1对U251细胞HLA-I类分子表达的影响,结果发现,TAP1转染组HLA-A、B、C和β2微球蛋白在mRNA水平表达明显增加。同时,我们利用Western blotting和流式细胞术对HLA-I蛋白进行检测发现,HLA-I蛋白表达水平同样升高,其在细胞表面的呈现较未转染组及空载体转染组皆明显上调,证明过表达的TAP1能够上调胶质瘤细胞HLA-I的表达及其在细胞表面的呈现。
TAP1上调HLA-I的机制尚不清楚。HLA-I α链与β2微球蛋白组装成HLA-I分子并呈现于细胞表面时需要与适当的抗原结合,当缺少TAP1时,细胞不能提供足够的抗原,HLA-I α链与β2微球蛋白变得不稳定并且很快被降解,导致HLA-I表面呈现的降低甚至缺失[11]。过表达的TAP1可能通过提呈足够抗原肽而使HLA-I更多地呈现于细胞表面。此外,TAP1基因与HLA-I基因位于基因组的相邻区域,且二者同时进化,该区域基因编码的蛋白超过40%参与了免疫反应[12]。TAP1有可能通过某种内在联系调节HLA-I的表达。
我们在前期研究中发现[13-16],TAP1与胶质瘤分级密切相关,其表达水平随胶质瘤分级增加表达下降。光动力处理后胶质瘤细胞的LMP2、LMP7、TAP1和HLA-I表达均上调,且用酸洗法制备的树突状细胞疫苗作用于光动力处理后的胶质瘤细胞,发现其抗肿瘤活性明显提高。构建TAP1慢病毒载体,对于研究抗原提呈系统在肿瘤免疫中的作用具有重要意义,同时也为我们的后续研究打下坚实的基础。
[1] Lankat-Buttgereit B, Tampé R. The transporter associated with antigen processing: function and implications in human diseases[J]. Physiol Rev,2002,82(1):187-204.
[2] 曾宪成,张 彤,李 华,等. 肝癌Hep3B细胞HLA-G过表达对NK细胞体外杀伤作用的影响[J]. 中国病理生理杂志,2012,28(4):613-618.
[3] 张 彤,曾宪成,李 华,等. HLA-E在肝癌细胞系中的表达[J]. 中国病理生理杂志,2012,28(10):1884-1886.
[4] Charron D. Immunogenetics today: HLA, MHC and much more[J]. Curr Opin Immunol,2005,17(5):493-497.
[5] Satoh E, Mabuchi T, Satoh H, et al. Reduced expression of the transporter associated with antigen processing 1 molecule in malignant glioma cells, and its restoration by interferon-γ and-β[J]. J Neurosurg,2006,104(2):264-271.
[6] Kaczmarek M, Frydrychowicz M, Rubis B, et al. Analysis of expression of MHC class I molecules and TAP genes in malignant human cell lines[J]. Folia Histochem Cytobiol,2007,45(3):205-214.
[7] Alimonti J, Zhang QJ, Gabathuler R, et al. TAP expression provides a general method for improving the recognition of malignant cellsinvivo[J]. Nat Biotechnol,2000,18(5):515-520.
[8] Ma W, Lehner PJ, Cresswell P, et al. Interferon-γ rapidly increases peptide transporter (TAP) subunit expression and peptide transport capacity in endothelial cells[J]. J Biol Chem,1997,272(26):16585-16590.
[9] Tao J, Li Y, Liu YQ, et al. Restoration of the expression of transports associated with antigen processing in human malignant melanoma increases tumor-specific immunity[J]. J Invest Dermatol,2008,128(8):1991-1996.
[10] Bartosch B, Cosset FL. Strategies for retargeted gene delivery using vectors derived from lentiviruses[J]. Curr Gene Ther,2004,4(4):427-443.
[11] Restifo NP, Esquivel F, Kawakami Y, et al. Identification of human cancers deficient in antigen processing[J]. J Exp Med,1993,177(2):265-272.
[12] Flajnik MF, Kasahara M. Comparative genomics of the MHC: glimpses into the evolution of the adaptive immune system[J]. Immunity,2001,15(3):351-362.
[13] 李方成,张善义,李军亮,等. 人类白细胞抗原Ⅰ类抗原转运相关蛋白1在胶质瘤组织中的表达及其与抗原转运相关蛋白-2的关系[J]. 中华实验外科杂志,2012,29(4):682-684.
[14] Yuan S, Sun X,Zhang S, et al. Antitumor efficacy of a photodynamic therapy-generated dendritic cell glioma vaccine[J]. Med Oncol,2011,28(Suppl 1):S453-S461.
[15] Zhang SY, Li JL, Xu XK, et al. HMME-based PDT restores expression and function of transporter associated with antigen processing 1 (TAP1) and surface presentation of MHC class I antigen in human glioma[J]. J Neurooncol,2011,105(2):199-210.
[16] 温铖彩,李军亮,张善义,等. 盐酸氨基酮戊酸介导的光动力疗法增高U251细胞蛋白酶体的表达[J]. 中国临床神经外科杂志,2012,17(3): 154-157.
OverexpressionofTAP1up-regulatesHLA-ΙinhumangliomaU251cells
OUYANG Le-ping, ZHANG Shan-yi, LI Jun-liang, XU Xin-ke, WENG Yin-lun, ZHENG Mei-guang, WANG Sheng-wen, LI Fang-cheng
(DepartmentofNeurosurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:lifangcheng001@163.com)
AIM: To investigate the relationship between the overexpression of transporter associated with antigen processing 1 (TAP1) and the human leukocyte antigen I (HLA-I).METHODSThe full length ofTAP1 gene was obtained from the cDNA library. The lentiviral vector pSIN-EF2-IRES-GFP-puro was digested byBamH I andEcoR I, and the full length ofTAP1 gene was inserted into the vector by T4 DNA ligase. Subsequently, the recombinant plasmid was transformed intoEscherichiacoliDH5α cells and the correct transformant was selected. The recombinant plasmid and the Lenti-X HTX packaging mixture were co-transfected into 293T cells, and the virus particle was acquired. Human glioma U251 cells were transfected with the lentivirus. The expression of TAP1 and HLA-I was determined by real-time fluorescence quantitative PCR, Western blotting and flow cytometric analysis.RESULTSTAP1 gene was successfully transfected into the U251 cells and stably expressed in the cell line. The expression of TAP1 in U251 cells at mRNA and protein levels increased by (8.73±1.07) and (11.71±0.83) folds, respectively. As a result, the mRNA expression of HLA-A, HLA-B, HLA-C (heavy chain) and β2-microglobulin (light chain) was up-regulated by (3.51±0.36), (4.78±0.85), (2.94±0.28) and (3.23±0.24) folds, respectively. The protein expression of HLA-I also increased to (3.14±0.53) fold. The surface expression of HLA-I on the U251 cells transfected withTAP1 gene was largely enhanced as well.CONCLUSIONOverexpression of TAP1 up-regulates the expression of HLA-I. TAP1 plays an important role in HLA-I processing pathway.
Glioma; U251 cells; Transporter associated with antigen processing 1; Human leukocyte antigen I
R363
A
1000- 4718(2013)03- 0425- 05
2012- 10- 12
2013- 01- 07
国家自然科学基金资助项目(No.81072081)
△通讯作者 Tel: 020-81332013; E-mail: lifangcheng001@163.com
10.3969/j.issn.1000- 4718.2013.03.008

