桂皮酸联合顺铂对人肝癌MHCC97细胞的增殖抑制和凋亡诱导作用
邵军良, 韩明芳, 黎运呈△
我国是肝癌高发国家,全世界50%以上的新发和死亡肝癌患者发生在中国。目前以手术、化疗和放疗为主的综合治疗的疗效不能令人满意,全世界总体5年生存率最高的国家只有10%左右,故寻找治疗肝癌的其它治疗方法就成为人们研究的焦点[1]。近年来,中西医结合治疗肝癌的研究成为当前的热点和前沿,其在改善临床症状、提高生存质量、顺利完成化疗、延长生存期等方面有一定的优势。
桂皮酸(cinnamic acid,CA)是传统中药肉桂中的一种重要成分,其抗肿瘤作用首次见于1995年Liu等[2]的报道,桂皮酸在体外能抑制肺癌、前列腺癌、恶性胶质瘤、黑色瘤细胞等癌细胞的增殖,且对黑色瘤细胞有促进分化的作用。综合近几年的国内外研究亦表明[3-8],桂皮酸具有广泛的抗实体瘤活性,包括黑色素瘤、激素难治性前列腺癌、肺癌、胶质细胞瘤、肝癌、白血病等,它对肿瘤细胞具有抑制其生长增殖、诱导其分化和凋亡的作用。本实验通过桂皮酸联合顺铂(cisplatin)对人肝癌MHCC97细胞的增殖抑制及凋亡诱导作用进行研究,为临床联合桂皮酸治疗肝癌提供可靠的实验依据。
材料和方法
1 材料
1.1 桂皮酸 购自Alfa Aesar化学产品有限公司。使用时用0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)溶解于含10%胎牛血清的RPMI-1640培养基后,用0.45 μm一次性滤器过滤后配成不同浓度。
1.2 化学药品和试剂 Cisplatin(齐鲁制药有限公司,批号为100703);RPMI-1640培养基(Gibco,批号为1120708);胎牛血清(Gibco,批号为980412);Annexin V-FITC/PI试剂盒(BD,批号为18354);MTT(碧云天生物技术有限公司,批号为080721);兔抗人caspase-3Ⅰ抗(Cell Signaling,批号为 Lot 13),其它试剂均为国产分析纯。
2 方法
2.1 细胞培养 人肝癌细胞MHCC97和正常人肝细胞L-02由上海中科院提供。所有细胞在含10%胎牛血清的RPMI-1640培养基中培养,其中含青霉素(1×105U/L)和链霉素(100 mg/L),培养条件是37 ℃、5%CO2。
2.2 细胞增殖曲线及IC50值检测 MTT比色法检测CA单独或联合cisplatin作用24 h和48 h时对细胞增殖的抑制作用。对数生长期的细胞(5×103cells/well)种植到96孔板上过夜,CA(2 400、1 200、600、300、150、75 和 37.5 mg/L)、cisplatin(64、32、16、8、4、2 和 1 mg/L)和 CA+cisplatin 联合组分别作用肝癌和正常肝细胞24 h、48 h。加入20 μL MTT,4 h 孵育后,弃 MTT,并加入 150 μL DMSO 在37℃作用10 min直到结晶被溶解。用酶标仪(Bio-Rad 680)在波长490 nm时检测A值。按下列公式计算,抑制率(%)=(A正常组- A药物组)/(A正常组-A空白组)×100%。细胞被抑制50%时的浓度为IC50,计算CA和cisplatin单用时的IC50值。
2.3 凋亡的形态学检测 取CA和cisplatin单用时的IC50值作为联合用药浓度。对数生长期的细胞(1×108/well)种植于6孔培养板24 h孵育后,CA和cisplatin单独或联合作用MHCC97细胞共48 h。倒置显微镜下观察细胞的形态学改变。
2.4 凋亡细胞的定量分析 凋亡细胞采用annexin V和PI双染的方法检测。CA和cisplatin单独或联合作用MHCC97细胞共48 h时被检测。细胞(1×108/L)被种植到6孔板并孵育48 h,收集悬浮的和贴壁的细胞。1 500 r/min离心5 min,4℃条件下细胞样品被冰冷的PBS洗2次。弃上清,(5×108~5×109/L)细胞被重悬在冰冷的稀释了的结合液中。取 annexin V-FITC 溶液(5 μL)和 PI(2.5 μL)加到100 μL细胞悬液中,小心混匀并避光在冰上孵育10 min。加冰冷的结合液400 μL到细胞悬液中混匀后上机检测,并采用CellQuest流式软件分析。
2.5 Western blotting检测凋亡蛋白caspase-3的活化 CA和cisplatin单独或联合作用于MHCC97细胞(2×105cells/well)24 h和48 h。收集细胞,预冷PBS洗涤2次,分别加入适量含PMSF的RAPI裂解液,冰上裂解30 min,4℃下12 000 r/min离心15 min,取上清用BCA法测定蛋白浓度。取总蛋白上清液24 μL,加6 μL 5×上样缓冲液混匀。用 PCR 仪煮沸10 min,变性后取20 μg上样,进行 SDS-PAGE电泳分离蛋白(12%分离胶,5%浓缩胶),转移至PVDF膜上(300 mA,30 min),5%脱脂牛奶封闭非特异抗原2 h,按照蛋白质marker切割PVDF膜,并分别加入 caspase-3(1∶500)或者 β-actin(1∶500)过夜,PBS-T洗涤3次,每次 10 min。再分别加入1∶5 000稀释的羊抗兔 IgG-HRP,室温振摇1 h,PBST洗涤3次,每次15 min。ECL系统显色,凝胶成像仪检测,采用Quantity One分析软件进行条带灰度值分析。
3 统计学处理
采用SPSS 13.0统计软件进行分析。实验重复5次。数据用均数±标准差(mean±SD)表示。用单因素方差分析、直线相关与回归等方法进行数据统计分析。以P<0.05为差异有统计学意义。
结 果
1 CA的细胞生长抑制效率
MHCC97和L-02细胞经24 h无血清培养后,用不同浓度 CA(2 400、1 200、600、300、150、75 和37.5 mg/L)作用24 h和48 h后检测增殖抑制效应,见图1A。MHCC97细胞的生长以浓度及时间依赖的方式被抑制,CA作用于 MHCC97细胞的 IC50值是248.52 mg/L(24 h)和178.65 mg/L(48 h)。值得注意的是,CA对肝癌细胞MHCC97有增殖抑制作用的浓度和时间时却对L-02无明显影响。因此,CA在相同浓度及作用时间的条件下具有肿瘤选择性。
2 Cisplatin的细胞生长抑制效应
图1B显示不同浓度cisplatin作用MHCC97和L-02细胞24 h和48 h可以明显有效抑制细胞增殖。当cisplatin作用相同浓度时,细胞生长抑制率随着时间逐渐增加;当cisplatin作用相同时间时,细胞生长抑制率随着浓度增加而增加。结果表明,cisplatin作用肝癌细胞MHCC97的生长抑制率均呈浓度及时间依赖性。Cisplatin作用 MHCC97细胞的 IC50值是16.49 mg/L(24 h)和13.00 mg/L(48 h)。此外,cisplatin对正常细胞的抑制作用明显。
3 CA联合cisplatin作用细胞的生长抑制率
不同浓度的CA联合不同浓度cisplatin作用于MHCC97细胞时,当两药以浓度固定比 37.5∶1(CA∶cisplatin)作用于肝癌细胞MHCC97和正常肝细胞L-02共24 h和48 h时,CA+cisplatin联合作用对MHCC97细胞的IC50值分别是(88.75±2.37)mg/L(24 h)和(46.32±1.24)mg/L(48 h)。图1C表明CA和cisplatin在低浓度联合作用MHCC97细胞时具有很好的增殖抑制作用,联用时可降低药物作用浓度。此外,联用组在相同作用浓度和时间时却对正常肝细胞L-02无明显影响,表明CA和cisplatin联合作用可增大CA的作用且减少cisplatin的毒性。
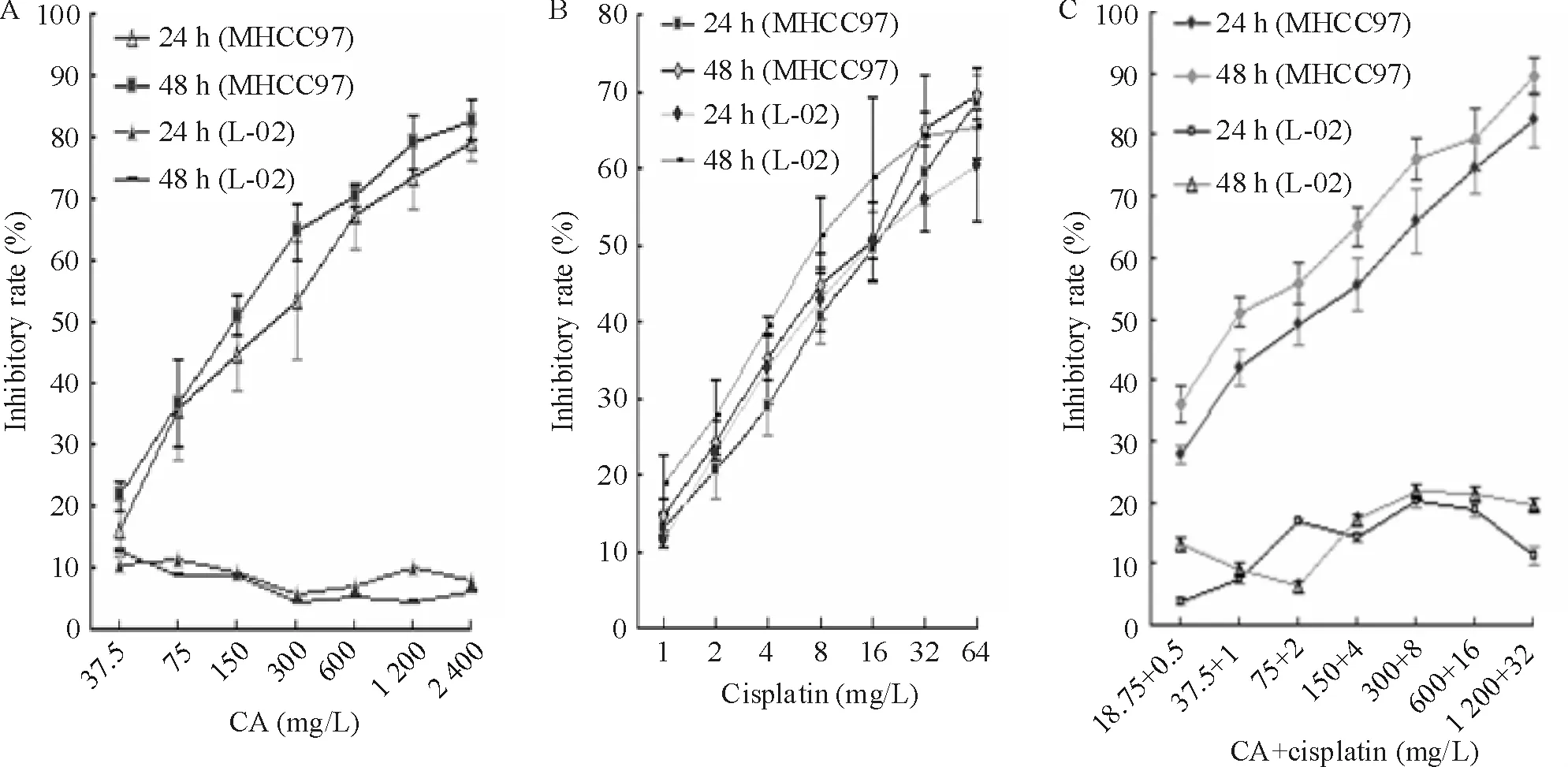
Figure 1.Curves of growth inhibitory rates of MHCC97 and L-02 cells after treated with CA,cisplatin and CA+cisplatin.Mean±SD.n=5.图1 CA、cisplatin和CA+cisplatin作用于MHCC97和L-02细胞24 h和48 h后的生长抑制率曲线
4 CA和cisplatin单用或联合作用时MHCC97细胞的凋亡形态学改变
如图2显示,当药物作用后细胞生长被抑制,可观察到显著的形态学改变如细胞分散,体积减少,核浆比例减少,细胞膜起泡,出现凋亡小体等。当细胞膜完整时,细胞边界皱缩且浓染。包浆产生透明空泡,细胞质产生放射状、钉状和叶状的突起。继续发展则细胞膜出泡和凋亡小体形成。与CA+cisplatin组比较,cisplatin组坏死细胞较多。当两药联合时凋亡更加明显,细胞体积减少,细胞间隙加宽,边界更清楚,凋亡形态更明显且较少坏死细胞。

Figure 2.Morphological changes of MHCC97 cells under inverted light microscope after treated with CA and cisplatin either in combination or alone for 48 h(×400).图2 CA和cisplatin单用或联合作用MHCC97细胞48 h细胞形态学改变
5 CA和cisplatin单用或联合作用的凋亡诱导作用
与正常对照组比较,CA或cisplatin单用和联合作用MHCC97细胞时,早期及总的凋亡率增加,联合组的凋亡诱导作用强于CA或cisplatin单用组。此外,cisplatin组中晚期凋亡或坏死细胞比CA或联用组高,而早期凋亡细胞刚好相反,见图3和表1。

Figure 3.The individual or combined effects of CA and cisplatin on apoptotic rate of MHCC97 cells detected by annexin V-FITC/PI double-staining.Mechanically injured cells are in the left upper quadrant(a zone,annexin V-/PI+);mid-and late apoptotic cells or necrotic cells are in the right upper quadrant(b zone,Annexin V+/PI+);early apoptotic cells are in the right lower quadrant(c zone,annexin V+/Pl-);normal cells are in the left lower quadrant(d zone,annexin V-/PI-).b+c:total apoptotic cells.图3 Annexin V-FITC/PI双染检测CA和cisplatin单用或联用对MHCC97细胞凋亡的影响

表1 流式细胞术检测CA和cisplatin单用或联用对MHCC97细胞凋亡的影响Table 1.The effects of CA or cisplatin alone or in combination on apoptotic rate of MHCC97 cells detected by annexin V-FITC/PI double-staining(%.Mean±SD.n=5)
6 Western blotting检测caspase-3蛋白的活化
如图4显示,CA和cisplatin单用或联用24 h和48 h时,cleaved caspase-3/β-actin的比值随着作用时间的增加而逐渐增大,表明caspase-3随着时间的延长被水解活化了。图4B显示CA单用时cleaved caspase-3/β-actin的比值均明显高于cisplatin组。在相同浓度CA或cisplatin单用或联用时cleaved caspase-3/β-actin的比值均具有时间依赖关系。此外,CA和cisplatin联用比各自单用时活化程度更高。
讨 论
肝癌是严重危害人民群众健康的疾病之一,目前尚缺乏理想的治疗药物。放化疗对肝癌虽有一定效果,但副作用较多,部分病人难以接受。目前,中草药治疗癌症日益受到人们的关注。桂皮酸是从肉桂树皮等植物中分离的单体化合物,是苯丙氨酸在植物组织内的脱氨基产物,是调节植物细胞生长和分化的激素样物质。国内外研究表明,桂皮酸具有广泛的抗实体瘤活性。细胞凋亡是机体生长发育、细胞分化和病理状态下细胞的程序性死亡过程,参与机体清除衰老或异常细胞的机制,与多种疾病如自身性免疫疾病、癌症等有关。因此很多癌症治疗都是通过诱导肿瘤细胞凋亡来实现的[9]。本研究初步探讨了桂皮酸联合顺铂对人肝癌细胞株MHCC97的增殖抑制及凋亡诱导作用,为临床治疗肿瘤提供新途径。

Figure 4.The expression of cleaved caspase-3 protein in MHCC97 cells detected by Western blotting after exposure to CA and cisplatin either alone or in combination for 24 or 48 h.1:control group;2:cisplatin group;3:CA group;4:CA+cisplatin group.Mean ± SD.n=5.**P < 0.01 vs 1;#P < 0.05,##P < 0.01 vs 2;△△P <0.01 vs 3;▲▲P <0.01 vs 24 h.图4 Western blotting法检测CA和cisplatin单独或联合作用于MHCC97细胞24和48 h caspase-3活化蛋白表达的水平
本实验首先观察了桂皮酸对MHCC97细胞的增殖抑制作用。结果表明,不同浓度桂皮酸和顺铂作用于MHCC97细胞后,抑制率与药物浓度存在剂量和时间依赖关系。然而,不同浓度桂皮酸在相同作用浓度和时间时却对正常肝细胞L-02无明显影响,当桂皮酸和顺铂联用时,IC50值均较单用时减小,表明联合应用时可增大桂皮酸和顺铂的抑制肝癌细胞增殖作用且减小化疗药物的毒性。其次,通过应用annexin-V/PI细胞凋亡检测法检测桂皮酸对MHCC97细胞凋亡的影响,证实桂皮酸和顺铂单独或联合应用时均可诱导MHCC97细胞凋亡。倒置显微镜下发现顺铂单用时可能由于细胞毒性作用,坏死细胞较多。当桂皮酸和顺铂联合作用时凋亡更加明显,细胞体积减少,细胞间隙加宽,边界更清楚,凋亡形态更明显且较少坏死细胞。细胞的凋亡一般分为caspase-3依赖和非依赖途径,我们还发现桂皮酸和顺铂主要通过caspase-3依赖途径诱导MHCC97细胞凋亡,并且桂皮酸和顺铂单独或联合作用24 h、48 h时,caspase-3活化片段的蛋白表达量随着时间的增加而加强。桂皮酸单独或联合顺铂作用肝癌细胞时caspase-3的活化比例明显高于顺铂单用组,可能由于caspase-3活化片段主要检查早期凋亡,而顺铂主要引起的中晚期凋亡和坏死细胞较多有关。这与顺铂流式细胞术检测结果非常吻合,更加证明了我们的结论。
本实验初步研究表明,桂皮酸有明显抑制MHCC97细胞生长的作用,并且该抑制作用可能与激活caspase-3有关,是通过诱导细胞凋亡实现的。
[1] McGlynn KA,London WT.The global epidemiology of hepatocellular carcinoma:present and future[J].Clin Liver Dis,2011,15(2):223-243.
[2] Liu L,Hudgins WR,Shack S,et al.Cinnamic acid:a natural product with potential use in cancer intervention[J].Int J Cancer,1995,62(3):345-350.
[3] 朱文渊,刘 昆.桂皮酸和全反式维甲酸及维生素C对HL-60细胞的分化研究[J].中华肿瘤防治杂志,2006,13(8):592-595.
[4] Noda S,Miyazaki T,Tanaka T,et al.Production of Streptoverticillium cinnamoneum transglutaminase and cinnamic acid by recombinant Streptomyces lividans cultured on biomass-derived carbon sources[J].Bioresour Technol,2012,104:648-651.
[5] Kong YH,Jo YO,Cho CW,et al.Inhibitory effects of cinnamic acid on melanin biosynthesis in skin[J].Biol Pharm Bull,2008,31(5):946-948.
[6] Hussain MI,Reigosa MJ.A chlorophyll fluorescence analysis of photosynthetic efficiency,quantum yield and photon energy dissipation in PSII antennae of Lactuca sativa L.leaves exposed to cinnamic acid[J].Plant Physiol Biochem,2011,49(11):1290-1298.
[7] 林德晨,史志周,薛丽燕,等.细胞周期相关蛋白cyclin D1、p53和p21WAF1/Cip1在食管鳞癌中的表达改变及其病理学意义[J].遗传,2010,32(5):455-460.
[8] 黄越燕,陈晓冬,肖 纯,等.流式细胞术检测肉桂酸锗诱导小鼠U14瘤细胞凋亡的研究[J].中国病理生理杂志,2003,19(11):1576.
[9] Vidya Priyadarsini R,Senthil Murugan R,Maitreyi S,et al.The flavonoid quercetin induces cell cycle arrest and mitochondria-mediated apoptosis in human cervical cancer(HeLa)cells through p53 induction and NF-κB inhibition[J].Eur J Pharmacol,2010,649(1-3):84-91.

