野生黄伞JZB2116005 菌株的鉴定及生物学特性研究
王守现,刘 宇,许 峰,赵 爽,耿小丽,王兰青,魏 民,王小华
(北京市农林科学院 植保环保研究所,北京100097)
黄伞,学名多脂鳞伞[Pholiota adipose (Fr.)Quél.],又名柳蘑、黄蘑。在分类上属于真菌门(Eumycota),担子菌门(Basidiomycota),伞菌亚门(Agaricomycotina),伞菌纲(Agaricomycetes),伞菌亚纲(Agaricomycetidae),伞菌目(Agaricales),球盖菇科(Strophariaceae)[1-2]。黄伞是一种中低温型食用菌,夏末至深秋在活的或死亡柳树等树干或根部广泛分布。黄伞子实体色泽鲜艳呈金黄色,富含蛋白质、碳水化合物、维生素及多种矿物质元素,食之黏滑爽口,味道鲜美,风味独特,是大有发展前途的食用菌新品种之一[3]。黄伞野生资源十分丰富,但不同来源的菌株间差异较大[4];近年来笔者从京郊采集的野生黄伞菌株中筛选出1 株产量高、出菇早、性状稳定的黄伞优良菌株,为其栽培和推广应用奠定理论依据。
1 材料和方法
1.1 供试培养基
1.1.1 综合PDA 培养基 马铃薯200 g、琼脂20 g、葡萄糖20 g、大豆蛋白胨5 g、KH2PO43 g、MgSO41.5 g、VB110 mg、水1 000 mL。
1.1.2 基础培养基 葡萄糖20 g、大豆蛋白胨2 g、KH2PO41 g、MgSO40.5 g、VB110 mg、琼脂16 g、水1 000 mL。
1.1.3 加富培养基 葡萄糖20 g、大豆蛋白胨2 g、马铃薯200 g、KH2PO41 g、MgSO40.5 g、VB110 mg、琼脂16 g、水1 000 mL。
1.2 野生菌株母种分离
2009 年9 月12 日在北京海淀区紫竹院公园柳树上发现1 种黄伞属真菌,组织分离获得该野生菌的母种,命名为JZB2116005。
1.3 野生菌株鉴定
1.3.1 形态学鉴定 肉眼观测野生子实体的外表形态以及周围生境。观察菌丝体在固体培养基上菌落的形状、大小、颜色、味道、生活力等。光学显微镜观测担孢子形态,并采用平板斜插盖玻片法,观测菌丝锁状联合结构、细胞大小、形态等。
1.3.2 分子鉴定 利用ITS1 和ITS4 通用引物对分离的野生菌株进行ITS-PCR 鉴定[5-7]。
1.4 野生菌株生物学特性研究
碳源、氮源、碳氮比、生长因子、温度、pH 等实验参照文献[8 -10]中的方法。
1.5 测定方法
1.5.1 菌丝平均生长速度测定 黄伞菌种接种于平板培养基表面的中央,培养8 d 后,测量菌落半径,以菌落平均半径除以天数即为菌丝的日平均生长速度。
1.5.2 菌丝干质量测定 测定完生长速度的平皿,放入高压锅内121 ℃加热至培养基融化(10 min),趁热将菌丝取出置于单层纱布,热水浴1 h,然后置于烘干箱内105 ℃烘干至恒质量,称量。
1.5.3 生长势测定 菌丝生长浓密,长势旺盛,用“+ + + +”表示;菌丝生长较密,长势较好,用“+ ++”表示;菌丝生长密,长势一般,用“+ +”表示;菌丝生长稀,长势较弱,用“+”表示;菌丝不生长,用“-”表示。
2 结果与分析
2.1 野生菌株的鉴定结果
2.1.1 形态学鉴定结果 采集的野生菌子实体由于受生境限制子实体未充分展开,畸形(图1A)。驯化栽培后子实体一般中等大(图1B)。菌盖直径2 ~10 cm,初扁半球形,边缘常内卷,后渐平展,谷黄色、污白色至黄褐色,很粘,有褐色近平伏的鳞片,中央较密。菌肉白色或淡黄色。菌褶黄色至锈褐色,直生或近弯生,稍密,不等长。菌柄长5 ~15 cm,粗0.5 ~3 cm,圆柱形,与盖同色,有褐色反卷的鳞片,粘或稍粘,下部常弯曲,纤维质,内实。菌环淡黄色,膜质,生菌柄之上部,易脱落。菌褶初乳白,采收时乳黄色,成熟时释放出大量锈褐色孢子,孢子椭圆形,光滑、直径(7.2 ~9.8)μm ×(5.2 ~6.5)μm(图1C)。在光学显微镜下,菌丝具有锁状联合。该菌子实体干后香味浓,食用时质地特脆。根据以上形态特征,参照文献[1]、[11]和[12]等工具书,并经中国科学院微生物研究所卯晓岚研究员鉴定,确定采集的野生菌为担子菌门、伞菌亚门、伞菌纲、伞菌目、球盖菇科的黄伞。
2.1.2 分子鉴定结果 利用ITS1 和ITS4 通用引物对野生菌株进行扩增、测序并提交Genbank,登陆号为:JQ283958。对测序结果进行BLAST 比对,发现目标序列与登录号为EU652950 的黄伞菌株同源性达到99.53%。因此结合形态学鉴定结果,可确定分离菌株为黄伞(P.adipose (Fr.)Quél.)。
2.2 生物学特性研究结果
2.2.1 碳源对黄伞菌丝生长的影响 试验结果表明(表1),黄伞JZB2116005 菌株对供试碳源都能利用,但不同碳源间黄伞菌丝生长速度、菌丝体干质量和长势有显著差异。其中,该菌株在以蔗糖、麦芽糖、甘露醇和山梨醇为碳源的培养基上日生长速度较快,且差异不显著;在以山梨醇为碳源的培养基上,菌丝生长势旺盛,干质量最高,达0.039 4 g,而且与其他3 种碳源差异显著。因此,综合以上分析,本实验选取的最佳碳源为山梨醇。

表2 氮源对黄伞菌丝生长的影响Tab.2 Effect of nitrogen sources on mycelial growth of Pholiota adipose
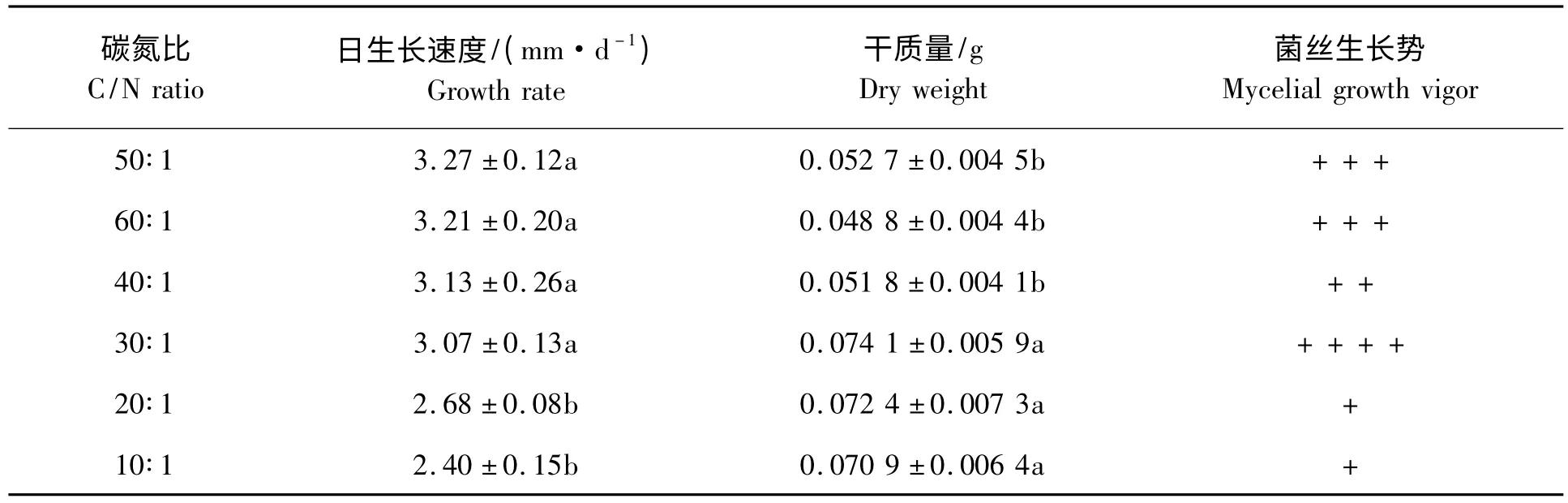
表3 碳氮比对黄伞菌丝生长的影响Tab.3 Effect of carbon-nitrogen ratio on mycelial growth of Pholiota adipose
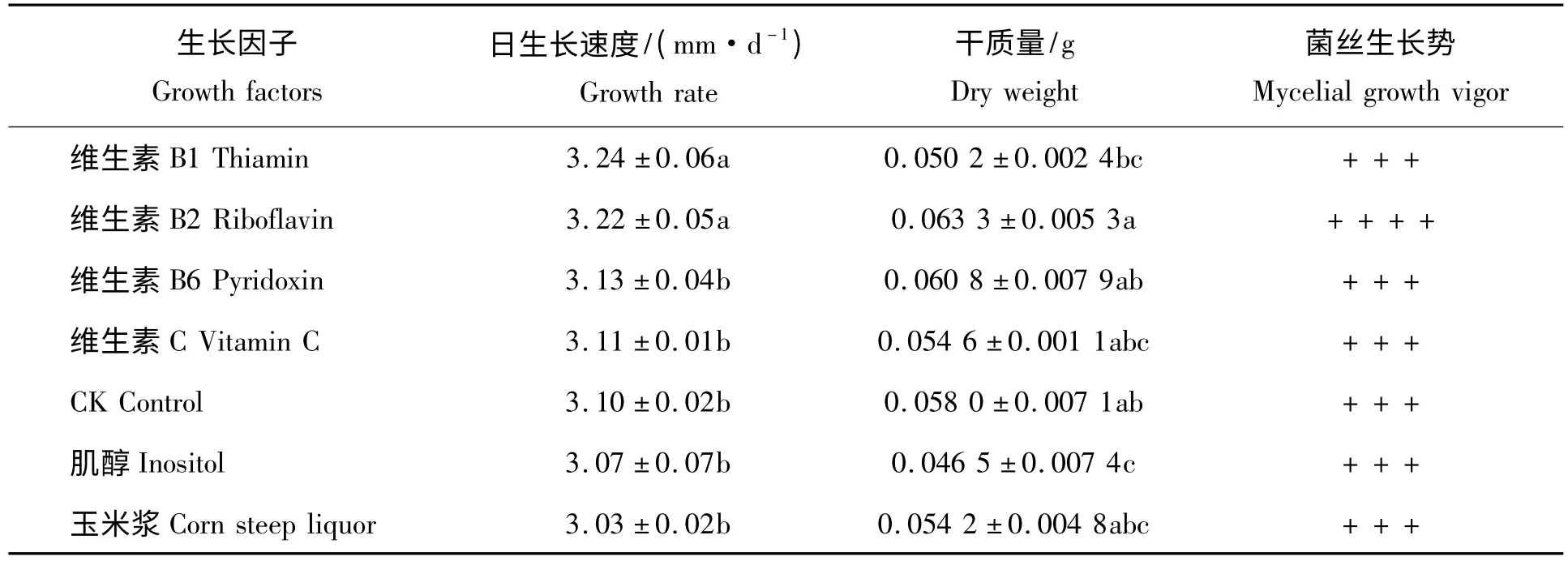
表4 生长因子对黄伞菌丝生长的影响Tab.4 Effect of growth factors on mycelial growth of Pholiota adipose
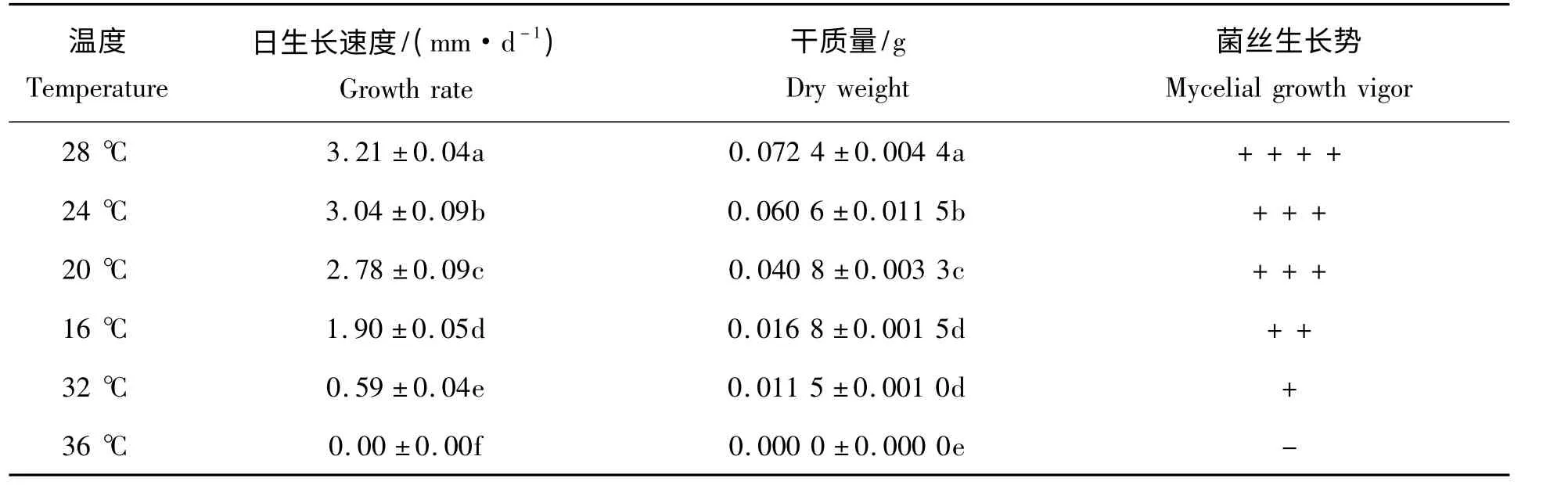
表5 温度对黄伞菌丝生长的影响Tab.5 Effect of temperature on mycelial growth of Pholiota adipose
2.2.2 氮源对黄伞菌丝生长的影响 试验结果表明(表2),黄伞JZB2116005 菌株在不同的氮源培养基上生长具有显著差异。菌丝生长速度以甘氨酸、硫酸铵和硝酸铵最快,3 者之间差异不显著;其次是牛肉浸膏和大豆蛋白胨;最慢的是对照。从菌丝干质量来看,大豆蛋白胨和酵母浸粉最高,其次为牛肉浸膏和尿素,对照最差。从菌丝长势来看,以牛肉浸膏为氮源的菌丝浓密,长势最佳;其次为甘氨酸、大豆蛋白胨、尿素和酵母浸粉;黄豆粉和对照最差。以菌丝干质量为主要衡量指标,结合菌丝生长速度和生长势,本实验选用大豆蛋白胨作为最佳氮源。
2.2.3 碳氮比对黄伞菌丝生长的影响 由表3 可以看出,不同碳氮比对菌丝生长有明显影响。黄伞JZB2116005 菌丝在碳氮比10∶1 ~60∶1 范围内均可生长,但以30∶1 ~60∶1 生长最为适宜,菌丝生长速度快,在此之间菌丝生长没有显著差异。碳氮比在10∶1 ~20∶1,菌丝生长缓慢。而且从菌丝干质量来看,菌丝在10∶1 ~30∶1,菌丝干质量较高,且差异不显著;其次为40∶1 ~60∶1。因此,综合以上分析,本实验选用碳氮比为30∶1。
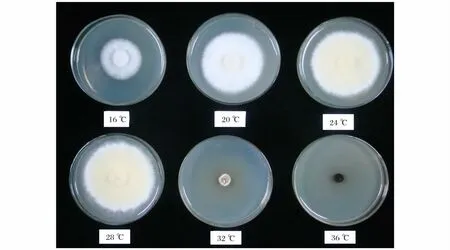
图2 不同温度对黄伞菌丝生长的影响Fig.2 Effect of different temperature on mycelial growth of Pholiota adipose
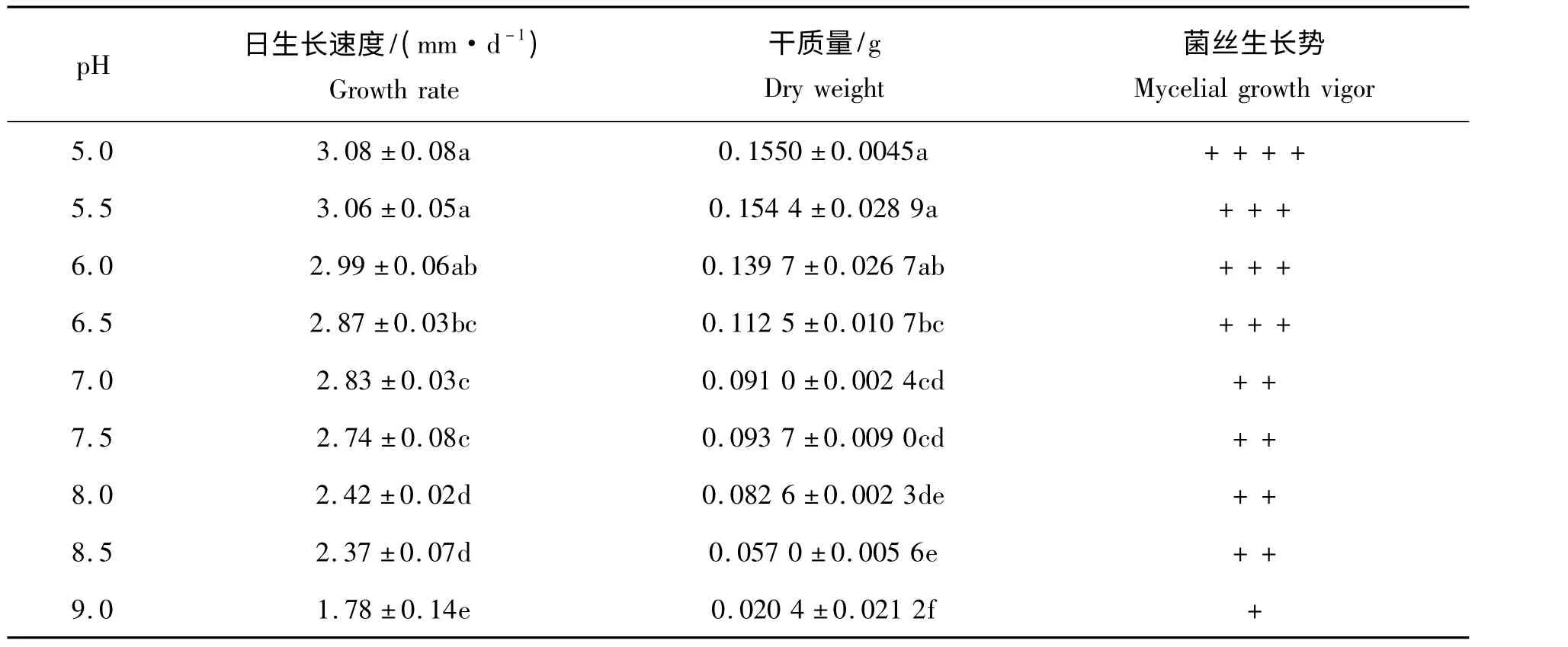
表6 pH 对黄伞菌丝生长的影响Tab.6 Effect of pH on mycelial growth of Pholiota adipose
2.2.4 生长因子对黄伞菌丝生长的影响 试验结果表明(表4),不同生长因子对黄伞JZB2116005 菌株生长速度存在一定的影响,其中维生素B1和维生素B2的菌丝生长速度最快,两者之间差异不显著,但与其他因子差异显著。从菌丝干质量来看,维生素B2的菌丝体干质量最高,达0.063 3 g,与维生素B1、肌醇差异显著。从菌丝长势来看,各因子之间长势差异不大。综合以上分析,本实验选用维生素B2作为最佳生长因子。
2.2.5 温度对黄伞菌丝生长的影响 试验结果表明(表5、图2),不同温度处理对黄伞JZB2116005 菌株生长速度具有显著的影响。在24 ~28 ℃菌丝生长迅速,其中在28 ℃时菌丝生长速度、菌丝体干质量、生长势均为最优;在温度低于24 ℃时,虽然菌丝仍然稠密洁白,但生长速度减慢;当温度达到36 ℃时,菌丝完全停止生长。因此,综合以上分析本实验选取的最适培养温度为28 ℃。
2.2.6 pH 对黄伞菌丝生长的影响 从表6 可以看出,黄伞JZB2116005 菌丝在pH 为5.0 ~9.0 都能生长,随着pH 的升高,生长速度逐渐变慢,生长势也逐渐变弱。在pH 为5.0 ~6.0,菌丝生长迅速,菌丝浓密,且菌丝干质量也较高,3 者之间差异不显著。因此,综合以上分析本实验选取的最适pH 为5.0。
3 结论与讨论
黄伞菇质脆嫩、清香可口,尤其是晒干后食用,效果更佳;是近年来开发的食用菌新品种。目前关于黄伞的生物学特性的研究报道较多[7,13-16],但多数以菌丝生长速度和生长势作为衡量指标,筛选其最适生长条件。菌丝干质量是指菌株利用碳源、氮源等营养成分,合成自身结构物质烘干后的质量;在一定程度上可反映菌株利用营养成分的强弱,可作为菌株的健壮程度的评价标准。本研究是在前人基础上,采用菌丝生长速度、菌丝干质量和生长势等指标对野生黄伞JZB2116005 菌株的生物学特性进行综合分析评价,筛选出最适生长条件:碳源为山梨醇、氮源为大豆蛋白胨、碳氮比为30∶1、生长因子为维生素B2、温度为28 ℃、pH 值为5.0;此研究结果可为黄伞生产栽培提供更科学的理论依据。
致谢:中国科学院微生物研究所卯晓岚研究员进行了实体形态学鉴定,谨致谢意!
[1]卯晓岚.中国大型真菌[M].郑州:河南科学出版社,2000:248 -248.
[2]Kirk P M,Cannon P F,David J C,et al.Dictionary of the fungi[M].9th ed.Wallingford:CAB International,2001:610 -614.
[3]沈亮,邢建新,曾强成,等.德州地区野生黄伞菌种分离及发酵条件的初步研究[J].云南农业大学学报,2011,26(3):303 -306.
[4]徐锦堂.中国药用真菌学[M].北京:北京医科大学,中国协和医科大学联合出版社,1997:49 -50.
[5]Palapala V,Aimi T,Inatomi S,et al.ITS -PCR -RFLP method for distinguishing commercial cultivars of the edible mushroom,Flammulina velutipes[J].J Food Sci,2002,67(7):2486 -2490.
[6]李永红.云南离褶伞菌株的ITS 鉴定及其生理研究[D].昆明:西南林学院,2009:1 -66.
[7]张薇,谢凤颖,王占斌.柳蘑生物学特性及ITS 序列分析[J].黑龙江农业科学,2011,33(3):18 -20.
[8]邹莉,王义,王轶,等.亚侧耳菌丝生物学特性研究[J].菌物学报,2008,27(6):915 -921.
[9]赵洪,邓功成.红汁乳菇菌丝体营养特性研究[J].食用菌,2008,19(6):9 -10.
[10]王守现,刘宇,许峰,等.荷叶离褶伞菌株的ITS 鉴定及生物学特性研究[J].中国农学通报,2012,28(28):148 -152.
[11]黄年来.中国大型真菌原色图鉴[M].北京:中国农业出版社,1998:176 -177.
[12]邓叔群.中国的真菌[M].北京:科学出版社,1963:267 -275.
[13]黄志强,张军,郑坤,等.丹东黄伞Dh-3 生物学特性及高产栽培技术[J].中国林副特产,2006,20(2):39 -40.
[14]刘靖宇,孟俊龙,常明昌.黄伞菌丝生物学特性的研究[J].中国食用菌,2006,25(2):24 -27.
[15]侯军,杜爱玲,石立三.黄伞园艺一号生物学特性研究[J].食用菌,2006,28(2):15 -17.
[16]王欢,图力古尔.三种鳞伞属真菌的菌丝生物学特性初步研究[J].菌物研究,2006,4(2):6 -10.

