大肠杆菌对兔血液生理生化指标和实质器官组织结构的影响
丁厚康,马卫明 ,刘莲莲,于小婷,万 圣
(山东农业大学 动物医学院,山东 泰安271018)
兔大肠杆菌病是由致病性大肠杆菌(E.coli)及其毒素引起的一种暴发性、死亡率很高的仔兔肠道性传染病,是严重危害养兔业发展的重大疾病之一[1]。本病无明显季节性,以20 日龄到4 月龄仔兔易感,其中20 日龄到断奶前后仔兔发病率最高。对于致病性大肠杆菌致病机理方面的研究现已达到了分子水平,但研究多集中在胃肠等消化器官,对于心脏、肝脏等实质器官还少见研究报道。有研究指出,致病性大肠杆菌感染对机体的损伤不仅局限于肠道[2],还可异位感染于肾脏[3]。为探讨大肠杆菌感染对兔各实质器官的病理损伤作用,本研究以人工感染大肠杆菌病的仔兔为研究对象,系统地测定了其血液生理生化指标和实质器官病理组织学变化,并且比较了常用抗生素和微生态制剂的治疗效果,从一个新的视角探讨致病性大肠杆菌对机体的病理损伤过程,为进一步防治大肠杆菌病提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验毒株 大肠埃希氏菌(CICC 编号:23657)由济南出入境检验检疫局提供,使用前接种于高压灭菌的肉汤中,恒温培养箱培养28 h,使活菌数达到2 ×109个/mL。
1.1.2 实验动物 新西兰兔,购自山东鲁抗医药股份有限公司(合格证号:0008991,许可证号:scxl 鲁20080002)。饲养环境安静,通风良好,自由采食饮水。
1.1.3 实验仪器和主要试剂 全自动血液细胞分析仪(深圳市普康电子有限公司生产);7020 型全自动生化分析仪(日本日立集团生产)。硫酸庆大霉素(4 万单位/mL,山东益康药业有限公司生产),乳酸菌素片(400 mg/片,哈药集团制药六厂生产)。
1.2 实验设计
40 只健康新西兰兔,30 ~40 日龄,预饲1 周后随机分为4 组,每组10 只,第1 组为正常对照组(G1),于试验当天腹腔注射无菌生理盐水2 mL;第2 组为大肠杆菌感染组(G2),第3 组为庆大霉素治疗组(G3),第4 组为乳酸菌素治疗组(G4),此3 组均于试验当天腹腔注射大肠杆菌培养液2 mL,待出现症状后(注射菌液后第2 天),G3 组每日肌注庆大霉素0.5 mL(2 U)/只,连续注射4 d,G4 组每日口服乳酸菌素片1 片(400 mg/片),连续4 d。每组分别单室、单人饲养,逐日观察体温、精神状态、采食和粪便等临床症状。
1.3 血生理生化指标检测
人工感染后分别于第1、3、5 天各组随机选取2 只,每只心脏采血5 mL,其中1 mL 注入肝素钠抗凝管中,用于测定血液生理指标。另外4 mL 先注入5 mL 无菌离心管中,室温静置0.5 h,3 000 r/min 离心5 min,分离血清,用于测定血液生化指标。将所有数据用SPSS 16.0 系统进行统计分析。
1.4 临床病理观察和实质器官组织切片
常规处死实验兔,剖检,观察并记录病理变化,之后取心脏、肝脏、脾脏、肺和肾脏固定于4%多聚甲醛中1 周,石蜡包埋,常规切片,HE 染色。
2 结果与分析
2.1 兔临床症状和剖检变化
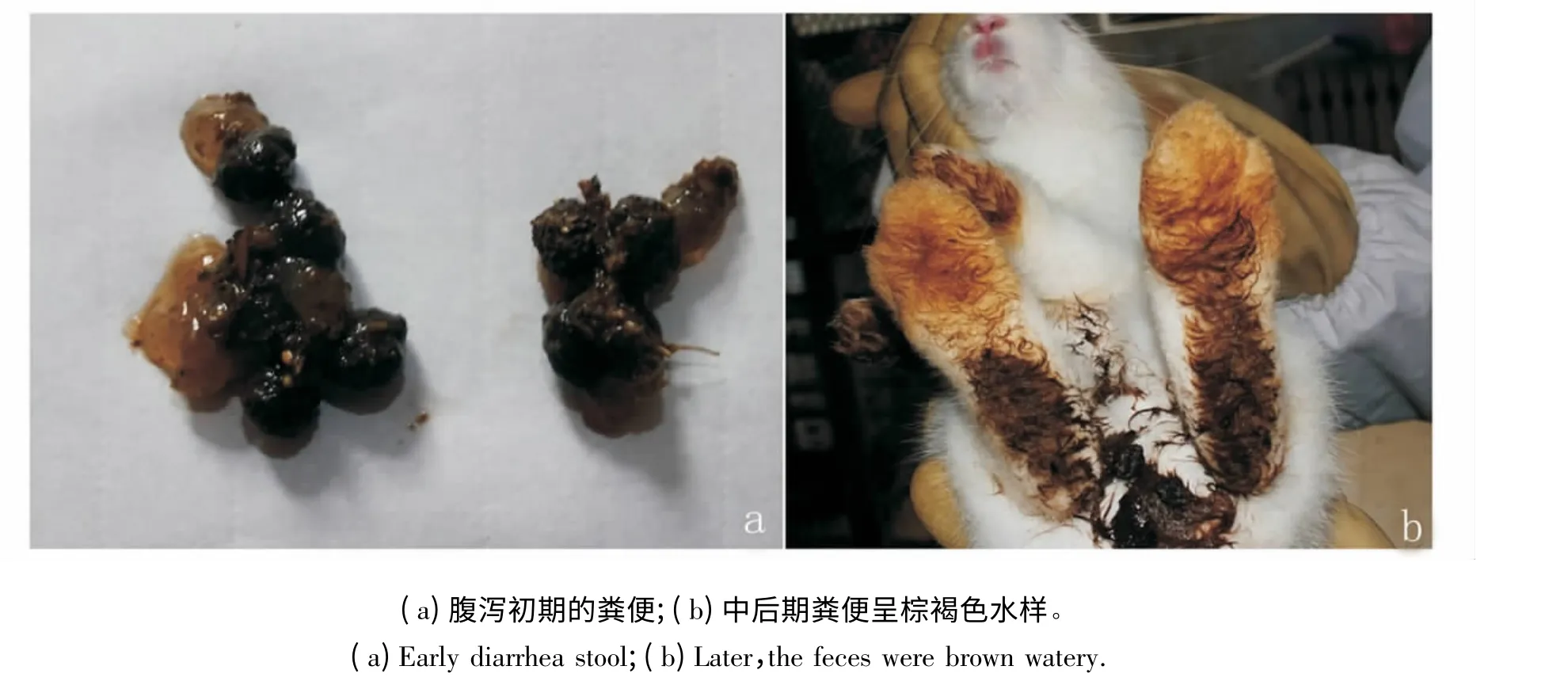
图1 G2 组兔腹泻初期和中后期粪便对照Fig.1 The early and the late diarrheic fecal contrast in G2
人工感染后第2 天,G2、G3、G4 组仔兔均开始出现腹泻症状,病兔精神沉郁,食欲减退或废绝,开始粪便粒细小、两头尖、成串、外有透明样黏液,中后期粪便呈棕褐色水样,肛门附近及后肢被毛沾满稀粪(图1);G2 组兔感染后第3 天和第4 天各有1 只死亡,第5 天精神有所好转。第7 天耐过兔基本恢复正常。G3 和G4 组兔未见病兔死亡,第6 天基本恢复正常。
病兔剖检可见有明显的肝周炎、心包炎和腹膜炎症状,表现为肝脏、脾脏有大量纤维蛋白附着(图2),心包和肠系膜外亦有大量纤维蛋白附着,肝脾表现明显的充血、淤血现象(图2),个别有出血。肺脏轻微充血,肾脏未见明显病理变化。G3、G4 组兔与G2 组兔相比,第3 天剖检病理变化相对较轻,肝脏和脾脏被膜外有少量纤维蛋白附着,肝脾充血未见出血;第5 天剖检病理变化明显减轻。正常对照组G1 剖检未见异常。

图2 G2 组兔肝脏和脾脏剖检观察Fig.2 The rabbit liver and spleen was observed pathological autopsy in G2
2.2 病理组织学变化
2.2.1 心脏 人工感染后第2 天,G2、G3、G4 组兔心脏组织均表现充血。感染后第3 天,G2 组兔可观察到肌纤维间出血,有红细胞和炎性细胞浸润(图3);第5 天可观察到心肌纤维萎缩变性,大量红细胞浸润。

图3 G2 组兔心脏组织切片Fig.3 The rabbit heart tissue sections in G2
2.2.2 肝脏 人工感染后第2 天,G2、G3、G4 组兔均可见充血,肝细胞索间有纤维状物质。感染后第3 天,G2 组兔肝组织内小静脉淤血,肝细胞因淤血而萎缩,肝细胞间有红细胞浸润,纤维状物质增多(图4)。

图4 兔肝脏组织切片Fig.4 The rabbit liver tissue sections
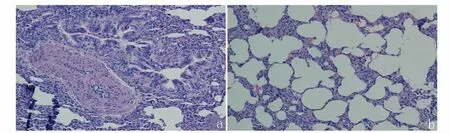
图5 G2 组兔肺脏组织切片Fig.5 The rabbit lung tissue sections in G2

图6 G2 组兔肾脏组织切片Fig.6 The rabbit kidney tissue sections in G2
2.2.3 肺 人工感染后第3 天,G2 组兔肺泡毛细血管充血,出血,肺泡隔增宽,大量红细胞浸润,细支气管黏膜呈皱褶状突向官腔,细支气管外密集大量炎性细胞(图5)。
2.2.4 肾 人工感染后第3 天,G2 组兔肾小管上皮细胞颗粒变性,胞浆溶解,皮质区肾小管官腔内充满大量渗出物,肾小管间有炎性细胞浸润。髓质区肾小管水肿,部分肾小管上皮细胞发生变性坏死,间质增生纤维化,散在有局灶性坏死,间质毛细血管充血(图6)。

图7 G2 组兔脾脏组织切片Fig.7 The rabbit spleen tissue sections in G2
2.2.5 脾 人工感染后第3 天,G2 组兔脾小体中央区的淋巴细胞发生变性坏死,红髓内积聚大量红细胞和少量淋巴细胞(图7)。
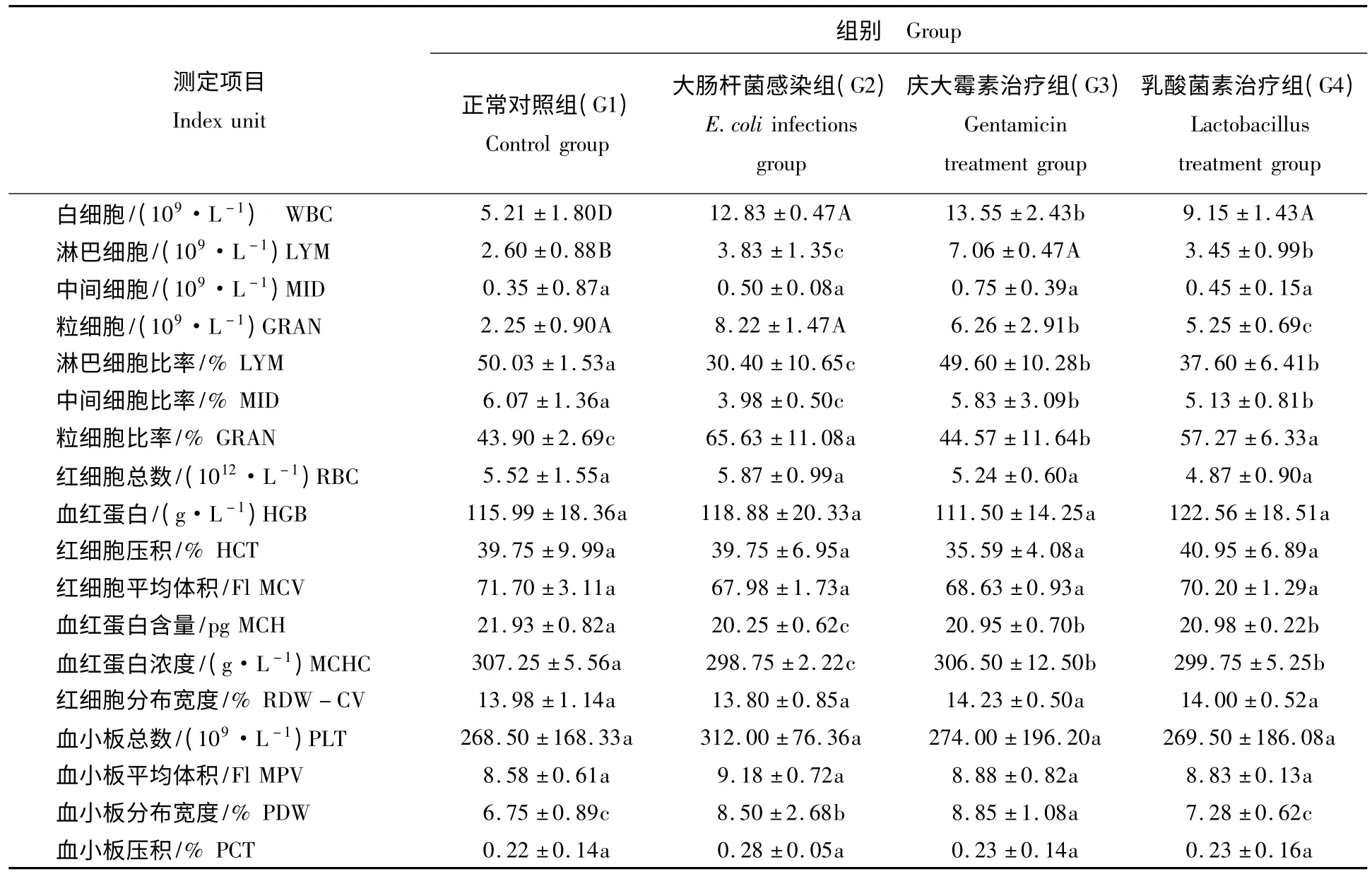
表1 兔血液生理指标测定Tab.1 Determination of blood physiological index of rabbit (X±S,n=6)
2.3 血液生理指标测定
SPSS 16.0 统计结果显示,G2 组兔白细胞总数极显著高于G1 组兔(P <0.01),G3 组兔白细胞总数显著高于G1 组兔(P <0.05),G4 组兔白细胞总数显著低于G2 组兔(P <0.05),但仍显著高于G1 组兔(P <0.05)。G3 组兔淋巴细胞极显著高于G1 组兔(P <0.05),显著高于G2 组兔(P <0.05)。G2 组兔粒细胞极显著高于G1 组兔(P <0.01);G4 组兔粒细胞显著高于G1 组兔(P <0.05),显著低于G2 组兔(P <0.05)。G2 组兔淋巴细胞比率和中间细胞比率显著低于G1 组兔(P <0.05)。G2、G4 组兔粒细胞比率显著高于G1 组兔(P <0.05)。G2 组兔血红蛋白含量和血红蛋白浓度显著低于G1 组兔(P <0.05),G3组兔血小板分布宽度显著高于G1 组兔(P <0.05)。各组间中间细胞、红细胞总数、血红蛋白、红细胞压积、红细胞分布宽度、血小板总数、血小板平均体积、血小板压积等指标均无显著性差异(P >0.05)。血液生理指标测定值见表1。
2.4 血液生化指标检测
SPSS 16.0 统计结果显示,G4 组兔总蛋白显著低于G1、G2 组兔(P <0.05)。G2 组兔白蛋白极显著低于G1 组兔(P <0.01),G3、G4 组兔白蛋白显著低于G1 组兔(P <0.05)。G3 组兔葡萄糖显著低于G1 组兔(P <0.05)。G2 组兔尿素氮和总胆固醇显著高于G1 组兔(P <0.05)。G3 组兔甘油三酯显著高于G1 组兔(P <0.05)。G2、G3、G4 组兔高密度胆固醇均显著低于G1 组兔(P <0.05),G3、G4 组兔与G2 组兔差异不显著(P >0.05)。各组间谷丙转氨酶、谷草转氨酶、低密度胆固醇、磷酸肌酸激酶、乳酸脱氢酶、钙、磷均无显著性差异(P >0.05)。G2 组兔血清镁极显著低于G1 组兔(P <0.01),G4 组兔显著低于G1 组兔(P <0.05),G3、G4 组兔与G2 组兔差异不显著(P >0.05)。血生化指标测定结果见表2。
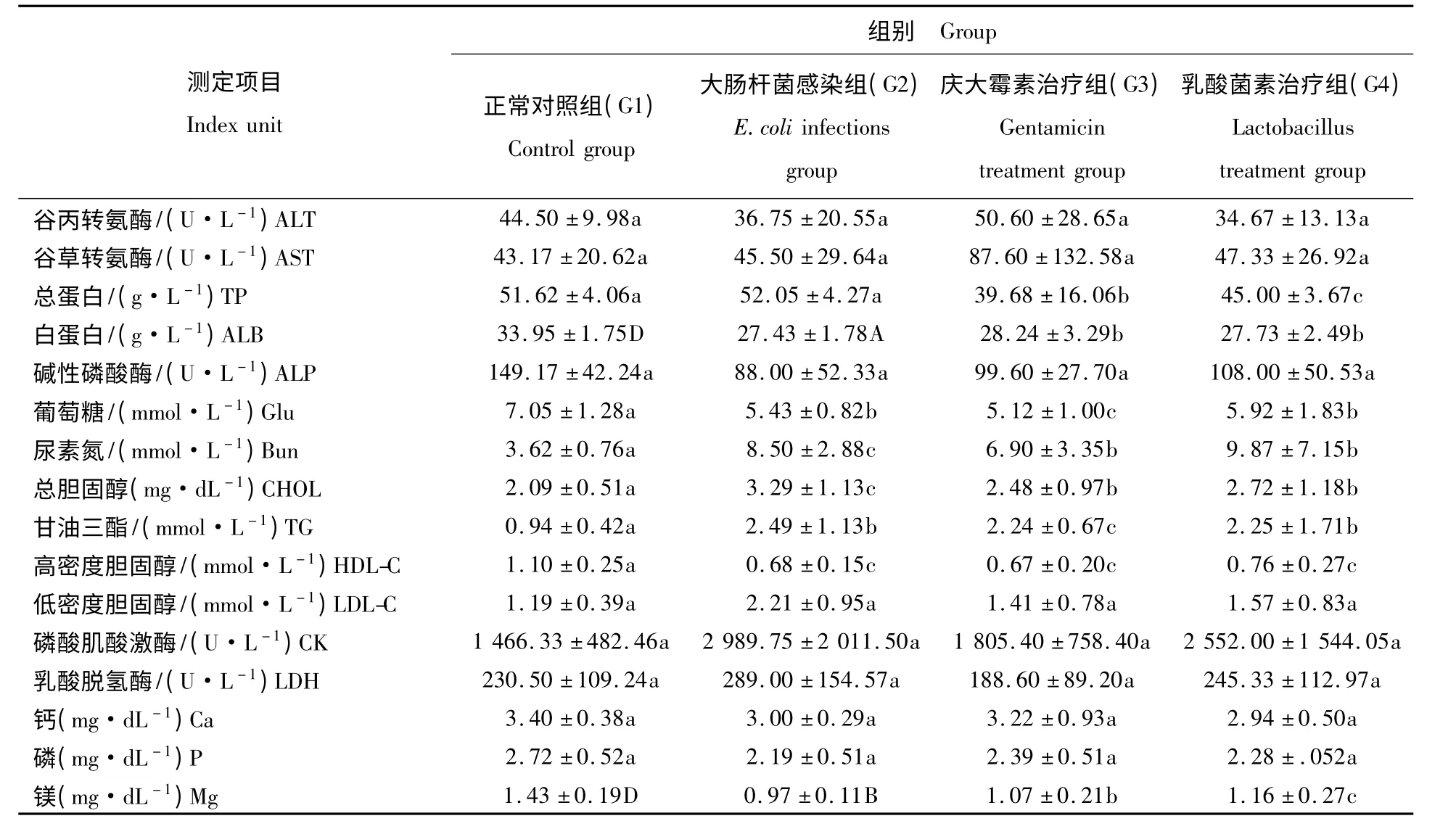
表2 兔血液生化指标测定Tab.2 Determination of blood biochemical indicator of rabbit(X±S,n=6)
3 结论与讨论
本实验结果表明,兔大肠杆菌病虽是一种肠道传染病,但对心脏、肝脏、肺脏、肾脏和脾脏等实质器官均有明显的病理损伤作用。对心脏的病理损伤主要表现在心肌充血,肌纤维出血,严重感染可致心肌变性。对肝脏的病理损伤主要表现在肝脏充血、淤血、部分有出血,肝细胞因淤血而萎缩,肝细胞间有大量纤维蛋白析出。肺脏肺泡内毛细血管充血,出血,肺泡隔增宽,肺细末支气管塌陷,有大量红细胞和炎性细胞浸润。肾脏肾小管上皮细胞颗粒变性,肾小管水肿,间质毛细血管充血。脾脏白髓内部分淋巴细胞变性坏死,红髓内积聚大量红细胞和少量炎性细胞。
兔大肠杆菌感染可引起白细胞总数明显升高,其中淋巴细胞和粒细胞数量明显升高,中间细胞变化不明显。但淋巴细胞比率和中间细胞比率降低,粒细胞比率显著升高。白细胞系统主要参与机体免疫反应,急性炎症期间,中性粒细胞通过趋化运动迅速到达炎症部位参与清除病原体的炎症反应。有研究表明,粒细胞比率可以反映体内炎症严重程度[4]。本实验大肠杆菌感染组粒细胞比率明显升高,庆大霉素治疗组粒细胞比率接近正常对照组水平,乳酸菌素治疗组粒细胞比率介于大肠杆菌感染组和正常对照组之间,表明庆大霉素和乳酸菌素片均具有一定的治疗效果,庆大霉素比乳酸菌素片治疗效果更好一些。
红细胞在动物体内主要功能是携带氧,测定结果显示感染后平均血红蛋白浓度和血红蛋白含量降低。大肠杆菌感染会引发严重腹泻,并且食欲废绝,饮水减少,使机体组织脱水,机体蛋白质合成减少,加之肾脏组织损伤,重吸收减少,导致平均血红蛋白浓度和血红蛋白含量降低。
白蛋白对维持血液渗透压有重要作用,血液中白蛋白浓度降低可能导致机体组织水肿[5-6]。白蛋白由肝实质细胞合成,合成后进入血液循环而分布到周身血液及体液中。病理切片显示,大肠杆菌对肝脏有明显的病理损伤作用,使白蛋白的合成减少,从而导致血清中白蛋白的值偏低;肾脏实质性病变会导致大量的白蛋白从尿液中排出,从而丢失大量的蛋白质,也会使血清中白蛋白含量降低。反过来,白蛋白浓度降低也可以反向表明大肠杆菌感染可对肝脏、肾脏造成病理损伤。
尿素氮水平升高多由肾实质性病变引起,病理切片显示,感染大肠杆菌,肾小管水肿,肾小球滤过率降低,使尿素氮水平升高,与血生化指标测定结果相符。
兔感染大肠杆菌后血清总甘油三脂水平明显升高,高密度胆固醇水平明显降低。甘油三酯升高致使血液中脂质含量过高,导致血液粘稠,部分析出沉积在血管内壁上,使血管内径变小,血液流速减慢,进而发展为动脉粥样硬化[7-8]。高密度胆固醇具有直接的抗动脉硬化作用,有动物实验显示,静脉内给予高密度胆固醇及其亚类可使兔的动脉粥样硬化斑块消退[9]。有研究表明,血清高密度胆固醇随血清甘油三脂浓度的升高而递减,甘油三酯与高密度脂蛋白胆固醇比值可以独立估计冠心病危险,两者比值越大,发病率越高[10-11]。兔感染大肠杆菌后血清总甘油三脂水平明显升高,高密度胆固醇水平明显降低,两者比值增大,患有动脉粥样硬化和冠心病的概率明显上升。
大肠杆菌对抗生素及磺胺类药物等极易产生耐药性。近几年因抗生素及广谱抗菌药物的大量使用,耐药菌株不断出现,使该病的发生和流行出现了新的特点,同时也给本病的防治提出了新的问题。为寻求新的有效治疗方法,微生态制剂对病原微生物性腹泻的辅助治疗效果日益成为研究的热点[12]。微生态制剂中的有益菌是良好的免疫激活剂,研究表明乳酸杆菌以免疫调节因子的形式起作用[13],刺激肠道局部型免疫反应,提高机体抗体水平或巨噬细胞的活性,增强机体免疫功能。陈天游[14-15]等研究表明,枯草芽孢杆菌BS23 株对大肠埃希氏菌等6 种肠道致病菌有拮抗作用,尤其对产毒性大肠埃希氏菌和致病性大肠埃希氏菌的抑菌作用更明显。本研究结果显示,乳酸菌素可以缩短病程,减少大肠杆菌感染对实质器官的损害和对血生理生化指标的影响,说明乳酸菌素片对治疗兔的大肠杆菌感染有一定效果,可以作为治疗兔大肠杆菌病的辅助用药。
综上所述,研究大肠杆菌对仔兔机体的影响,比较抗生素与生物活性物质作用效果,对该病的发病机制研究和畜牧业生产有较大的理论和现实意义。
[1]刘莲莲,马卫明,丁厚康,等.大肠杆菌对仔兔小肠形态学影响及其治疗方法的比较[J].江西农业大学学报,2012,34(1):124 -128.
[2]沈琴芳,何世成,张秀亮,等.兔大肠杆菌导位感染的诊断及病原鉴定[J].黑龙江畜牧兽医,2004,47(6):43.
[3]丁衍涛,丁叶,佘锐萍,等. 大肠杆菌感染对家兔肾脏组织结构及iNOS 表达的影响[J]. 中国动物检疫,2009,26(9):37 -39.
[4]白雪梅,杨平,王莹,等.外周血中性粒细胞百分率在小儿急性上呼吸道感染中的应用[J]. 临床儿科杂志,2005,23(9):664 -666.
[5]温靖,顾为望,杨海英,等.SPF 级新西兰兔血液生理生化指标的测定[J].动物医学进展,2005,26(1):81 -83.
[6]俞春英,谢金东,李秀红,等.福建黄兔血液生理生化指标的测定[J].经济动物学报,2009,13(2):83 -86.
[7]张代民,张莹,李霆,等.血清甘油三酯/高密度脂蛋白胆固醇比值对冠心病的诊断价值[J].现代诊断与治疗,2006,17(2):68 -69.
[8]林旻洁,赵水平.甘油三酯与冠心病发病关系及机制的研究进展[J].中国动脉硬化杂志,2011,19(12):1043 -1046.
[9]Lien W P,Lai L P,Shyu K G,et al. Low-serum,high-density lipoprotein cholesterol concentration is an important coronary risk factor in Chinese patients with low serum levels of total cholesterol and triglyceride[J]. American J Cardiol,1996,77(12):1112 -1115.
[10]Barter P J,Rye K A.High density lipoproteins and coronary heart disease[J].Atherosderosis,1996,121(1):1 -12.
[11]Reaven G.Metabolic syndrome,pathophy siology and implications for management of cardiovascular disease[J].Circulation,2002,106(3):286 -288.
[12]王君耀,赵锋.3 种微生态制剂与常用抗菌药物的相互作用[J].中国医院药学杂志,2003,23(7):419 -419.
[13]胡东兴,潘康成.微生态制剂及其作用机理[J].中国饲料,2001,1(3):14 -16.
[14]陈天游,董思国,田万红,等.枯草芽孢杆菌活菌体外拮抗6 种肠道致病菌的研究[J]. 微生物学杂志,2004,24(5):74 -76.
[15]尹清强,李小飞,常娟,等.微生态制剂对哺乳和断奶仔猪生产性能的影响及作用机理研究[J].动物营养学报,2011,23(4):622 -630.

