外源草酸对辣椒保鲜效果和抗氧化防御系统的影响
朱丽琴,张 伟,汪 伟,陈宇欢
(江西农业大学 食品科学与工程学院,江西 南昌330045)
辣椒(Capsicum annuum L.)原产于热带,有较高的食用价值,其Vc 含量为所有蔬菜之冠,每100 g 鲜辣椒果实中Vc 含量为73 ~342 mg。但是辣椒含水量高,采后易萎蔫失绿影响商品价值,而且容易受病原菌侵染,对低温敏感,易发生低温冷害。研究新型简便安全的处理方法对辣椒常温保鲜具有重要的意义。草酸是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中,并在不同的生命体中发挥不同的功能[1]。许多研究表明,草酸在诱导植物抗病性和影响植物抗氧化系统中发挥作用[2-3],作为一种天然的抗氧化剂应用于果品蔬菜的贮藏已受到关注[4],外源草酸可有效的延缓采后猕猴桃[5]、桃[6-7]、芒果[8-12]、冬枣[13]、李[14]、雷竹笋[15]等的衰老进程,从而延长果实的贮藏期和货架期。桃和芒果采后经草酸处理后,SOD、CAT 和POD 活性升高,活性氧水平包括O2-·产量和H2O2含量在贮藏期出现不同程度的降低,果实细胞膜透性增加趋势被缓解[6-10]。草酸对采后辣椒常温贮藏的保鲜作用效应研究在国内外还未见报道。本文研究草酸对辣椒果实常温贮藏下叶绿素、Vc、活性氧及相关酶活性的影响,为草酸应用于辣椒贮藏保鲜提供理论依据。
1 材料与方法
1.1 材料与处理
供试材料为“杭椒1 号”辣椒果实,购自江西南昌果蔬批发市场,挑选新采摘的大小均匀,无病虫害损伤,成熟度一致的果实进行试验处理。用蒸馏水配置5 mmol/L 和10 mmol/L 草酸溶液,浸果15 min,以浸泡蒸馏水为对照。将处理后的果实自然通风晾干,分装于厚度为0.04 mm 的聚乙烯薄膜袋内,在温度(20 ±0.5)℃,相对湿度85% ~90%的条件下贮藏,在贮藏12 d 内每3 天测定其生理生化指标。每个处理辣椒果实为1 000 g,重复3 次。
1.2 测定项目与方法
(1)叶绿素含量采用分光光度计法[16]进行测定。(2)Vc 含量利用2,6 -二氯靛酚法[17]进行测定。(3)O2-·含量的测定参考王爱国等[18]的方法。(4)过氧化氢(H2O2)含量的测定参考赵世杰等[19]的方法。(5)相对电导率利用电导率仪进行测定[20]。(6)SOD、CAT 和POD 酶液的提取和活性测定:称取1 g 果肉,加入50 mmol/L,pH 7.8 磷酸缓冲液5 mL 和少许石英砂,冰浴研磨至匀浆,10,000 g,4 ℃ 离心15 min,上清液为酶提取液。SOD 活性的测定利用氮蓝四唑(NBT)光还原法[21]。CAT 活性的测定参考赵世杰等[22]的方法,POD 活性的测定参考孙文全[23]的方法。蛋白质含量的测定采用考马斯亮蓝G-250 染色法[24]。
1.3 数据处理与分析
利用SPSS 18.0 统计软件进行数据整理与分析,显著性差异水平(P <0.05),利用Origin7.5 作图。
2 结果与分析
2.1 外源草酸对辣椒果实叶绿素和Vc含量的影响
辣椒在贮藏过程中容易失绿影响商品价值。如图1A 所示,对照果实在室温贮藏过程中叶绿素含量缓慢降低,5 mmol/L 和10 mmol/L 草酸处理果实叶绿素含量先升高然后下降,显著高于对照果实叶绿素含量(P <0.05)。5 mmol/L 和10 mmol/L 草酸处理之间差异不显著。辣椒在蔬菜中Vc含量最高,辣椒果实在常温贮藏过程中Vc含量迅速降低。5 mmol/L 和10 mmol/L草酸处理显著抑制了Vc 的降解(图1B)。10 mmol/L 草酸处理Vc 含量显著高于5 mmol/L 处理和对照的辣椒果实(P <0.05)。
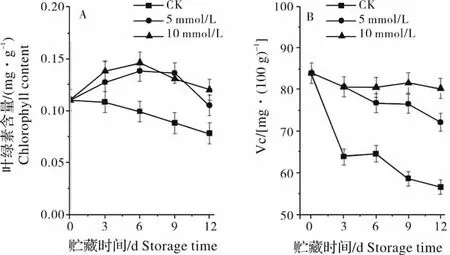
图1 外源草酸对辣椒果实叶绿素和Vc 含量的影响Fig.1 Effect of exogenous oxalic acid on chlorophyll and Vc content
2.2 草酸对辣椒果实·和H2O2 含量的影响
如图2A 所示,对照果实辣椒果实O2-·含量呈逐渐上升的趋势,5 mmol/L 和10 mmol/L 草酸处理显著低于对照辣椒果实,并且在贮藏过程中维持较稳定的水平,两处理间没有显著性差异。对照辣椒果实H2O2含量趋势与O2-·含量变化趋势一致,5 mmol/L 和10 mmol/L 草酸处理果实H2O2含量在贮藏期间缓慢上升,在第6 天后显著(P <0.05)低于对照辣椒果实(图2B)。
2.3 草酸对辣椒果实相对电导率、SOD、CAT 和POD 活性的影响
如图3A 所示,对照辣椒果实相对电导率迅速升高,说明辣椒果实在采后细胞膜结构被破坏导致膜透性增加所致。草酸处理果实的相对电导率变化趋势和对照果实一致,但显著低于对照(P <0.05),在贮藏第12 天,10 mmol/L 草酸处理果实的相对电导率是对照果实的27.7%,说明外源草酸处理能够保护细胞膜结构,延缓辣椒果实衰老。
辣椒果实SOD 活性在贮藏期间呈现先升高后降低的趋势,常温贮藏前6 天,对照果实SOD 活性显著高于草酸处理果实,但在贮藏后期显著低于草酸处理果实(P <0.05),说明草酸能够增强辣椒果实贮藏后期SOD 的活性,减少超氧自由基对细胞膜的伤害(图3B)。10 mmol/L草酸处理果实SOD 活性显著高于5 mmol/L草酸处理果实。草酸处理果实的CAT 活性显著高于对照果实,增强辣椒果实清除H2O2的能力,减少H2O2对细胞膜的伤害(图3C)。5 mmol/L和10 mmol/L草酸处理果实SOD 差异不显著。对照辣椒果实整个贮藏期间POD 活性不断下降,5 mmol/L和10 mmol/L草酸处理果实先下降后上升,在第6 天显著高于对照果实(P <0.05),两组处理之间的差异不显著。在贮藏9 d 后处理和对照之间差异不显著(图3D)。
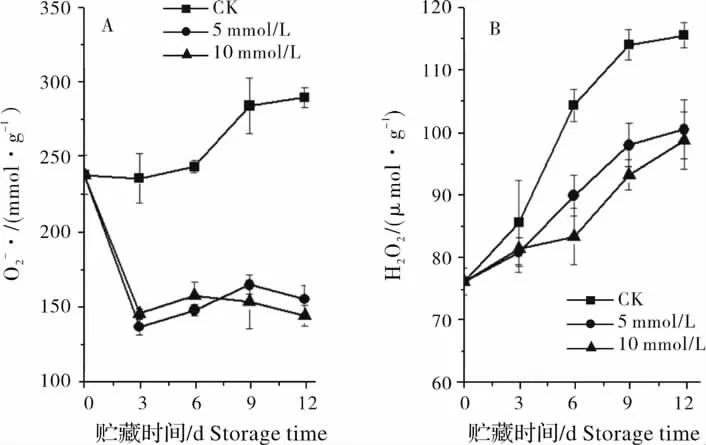
图2 外源草酸对辣椒·和H2O2 含量的影响Fig.2 Effect of exogenous oxalic acid on the O-·2 production and H2O2 content
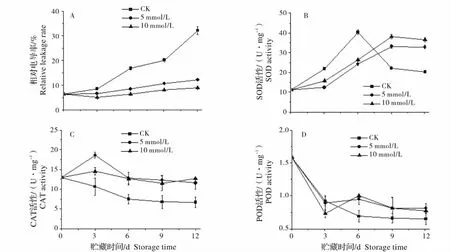
图3 外源草酸对辣椒相对电导率、SOD、CAT 和POD 活性的影响Fig.3 Effect of exogenous oxalic acid on relative leakage rate and the activities of SOD,CAT and POD
3 讨论与结论
辣椒在常温贮藏期间容易失绿、变红、发病严重,影响辣椒外观品质和商品价值。草酸处理可以抑制辣椒果实叶绿素的降解,使外观品质得到较好的保持。Vc 既是营养物质,又是温和的抗氧化剂,能有效地清除超氧自由基、羟基自由基和有机自由基等[25]。在本研究中草酸可以显著抑制辣椒果实Vc 的降解,在保持其营养价值的同时还提高辣椒果实内清除活性氧的能力,延缓辣椒衰老。
果实采后的衰老与细胞膜质的过氧化作用有关,而膜质过氧化作用是由羟基自由基和单线态氧等过氧化物启动的[26]。在植物衰老期间,SOD、CAT 活性下降,有利于形成更多的·、H2O2和·0H等活性氧,从而加强了细胞膜脂过氧化,细胞膜透性增加。因此活性氧是引起果蔬衰老的重要因子。在本研究中草酸处理果实的·和H2O2显著降低并且在整个贮藏过程中维持较低的水平,而且细胞膜透性显著低于对照,说明草酸处理能够保护细胞膜,降低活性氧对细胞膜的伤害。SOD、CAT 和POD是生物体内重要的活性氧清除酶,SOD 催化O2-·生成H2O2和氧,生成的过氧化氢在CAT 和POD 的作用下生成水和氧气[27]。在本研究中草酸处理显著提高了SOD 和CAT 的活性,减少超氧自由基和过氧化氢引起的膜功能和结构的破坏,使辣椒能更好地维持细胞膜结构的完整,从而延缓辣椒果实衰老。
本研究从抗氧化系统方面对草酸延缓辣椒果实衰老的影响进行分析。研究结果表明草酸处理能够抑制叶绿素和Vc 的降解,草酸处理提高了SOD 和CAT 活性从而减少活性氧对辣椒果实细胞膜结构的伤害来延缓辣椒果实的衰老。5 mmol/L 和10 mmol/L 草酸浸果处理可作为辣椒果实采后保鲜的方法。
[1]Libert B,Franceschi V R.Oxalate in crop plants[J].Journal of Agricultural and Food Chemistry,1987,35:926 -938.
[2]Guo Z,Tan H,Zhu Z,et al.Effect of intermediates on ascorbic acid and oxalate biosynthesis of rice and in relation to its stress resistance[J].Plant and Cell Physiology,2005,43:955 -962.
[3]Kim K S,Min J Y,Dickman M B.Oxalic acid is an elicitor of plant programmed cell death during Sclerotinia sclerotiorum disease development[J].Molecular Plant Microbe Interactions,2008,21:605 -612.
[4]郑小林.外源草酸对水果的保鲜效应及其机理研究进展[J].果树学报,2010,27:605 -610.
[5]张中海,饶景萍,王美丽,等.草酸对猕猴桃果锈清洗及耐贮性的影响[J].果树学报,2006,23(6):888 -891.
[6]郑小林,田世平,李博强,等.草酸对冷藏期间桃果实抗氧化系统和PPO 活性的影响[J].园艺学报,2005,32:788-792.
[7]Zhang X L,Tian S P,Meng X H,et al.Physiological and biochemical responses in peach fruit to oxalic acid treatment during storage at room temperature[J].Food Chemistry,2007,104:156 -162.
[8]郑小林,田世平,李博强,等.外源草酸延缓采后杧果成熟及其生理基础的研究[J].中国农业科学,2007,40(8):1767-1773.
[9]Zhou Z W,Tian S P,Gidley M J,et al.Slowing deterioration of mango fruit during cold storage by pre-storage application of oxalic acid[J].Journal of Horticultural Science and Biotechnology,2007,82(5):707 -714.
[10]Zheng X L,Tian S P,Gidley M J,et al.Effects of exogenous oxalic acid on ripening and decay incidence in mango fruit during storage at room temperature[J].Postharvest Biology and Technology,2007,45:281 -284.
[11]郑小林,陈 燕,敬国兴,等.草酸处理对杧果采后果实AsA-GSH 循环系统的影响[J].园艺学报,2011,38(9):1633-1640.
[12]薛锡佳,李佩艳,宋夏钦,等.草酸处理减轻杧果采后果实冷害的机理研究[J].园艺学报,2012,39(11):2251 -2257.
[13]Wu F W,Zhang D D,Zhang H Y,et al.Physiological and biochemical response of harvested plum fruit to oxalic acid during ripening or shelf-life[J].Food Research International,2011,44:1299 -1305.
[14]Wang Q,Lai T F,Qin G Z,et al.Response of jujube fruits to exogenous oxalic acid treatment based on proteomic analysis[J].Plant Cell Physiology,2009,50(2):230 -242.
[15]王琪,郑小林,励建荣,等.草酸处理对冷藏雷竹笋保鲜效果的影响[J].中国食品学报,2012,12(11):84 -89.
[16]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业技术出版社,2002:55 -57.
[17]张宪政,陈风玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994:66 -69.
[18]王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,6:55 -57.
[19]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业技术出版社,2002:138 -139.
[20]Zhu L Q,Zhou J,Zhu S H,et al.Inhibition of browning on the surface of peach slices by short-term exposure to nitric oxide and ascorbic acid[J].Food Chemistry,2009,114:174 -179.
[21]姚婷婷,朱丽琴,杨双,等.一氧化氮对采后李果实线粒体膜氧化损伤的影响[J].中国农业科学,2010,43(13):2767-2774.
[22]高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000:198 -199.
[23]孙文全.联苯胺比色法测定果树过氧化物酶活性的研究[J].果树科学,1988,5(3):105 -108.
[24]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248 -254.
[25]Podmore I D.Vitamin C exhibits pro-oxidant properties[J].Nature,1998,392:559.
[26]Parrish D J,Leopold A C.On the mechanism of aging in soybean seeds[J].Plant Physiology,1978,61(3):365 -368.
[27]Zhu Z,Wei G,Li J,et al.Silicon alleviates salt stress and increases antioxidant enzymes activity in leaves of salt-stressed cucumber(Cucumis sativus L.)[J].Plant Science,2004,167:527 -533.

