蕙兰GAPDH 基因的全长克隆及生物信息学分析
田云芳,蒋素华,袁秀云,崔 波
(郑州师范学院 生物研究所,河南 郑州450044)
30 多年来,三磷酸甘油醛脱氢酶(glyceraldehyde-3 -phosphate dehydrogenase,GAPDH)一直被作为糖酵解过程的重要角色研究[1]。GAPDH 催化的糖酵解反应为:3 -磷酸甘油醛+NAD++←→1,3 -二磷酸甘油酸+NADH+H+。近年来,越来越多的研究表明GAPDH 是一种多功能蛋白;在生物膜上,GAPDH 可促进膜融合、参与膜转运等;在细胞质中,GAPDH 有磷酸激酶活性、催化微管聚合的功能及参与细胞保护;在细胞核内,GAPDH 参与tRNA 出核、mRNA 稳定性调节、DNA 损伤修复、组蛋白转录调控、凋亡等[2-5]。作为一个含量丰富的胞内蛋白质,在不同个体及组织细胞中的表达相对稳定,具有组成型表达、易于扩增等许多优点,GAPDH 可以作为多种植物研究其他基因的表达调控的分子内标[6-7]。
蕙兰(Cymbidium faberi),兰科兰属,是我国珍稀物种,为国家二级重点保护野生物种,具有很高的观赏价值和经济价值。目前对兰科植物分子水平的研究多集中在洋兰上,如蝴蝶兰(Phalaenopsis ssp.)、文心兰(Oncidium ssp.)及石斛兰(Dendrobium ssp.)等[8-10],而对中国兰尤其是中国兰的地生兰的分子水平研究几乎处于空白[11-12]。
本研究在前人工作的基础上设计引物,克隆了蕙兰GAPDH 基因的cDNA 全长序列,并进行生物信息学分析该基因的特征,为半定量RT-PCR 以及Real -time RT -PCR 等技术体系在蕙兰植物功能基因研究中的应用提供基础。
1 材料与方法
1.1 材料
采自河南大别山的蕙兰,用清水洗净黏附的泥土,滤纸吸干水分,将花葶切成约2 cm 长,分装于冻存管,迅速冻存于液氮后-80 ℃保存备用。
1.2 主要试剂
Trizol 购于Invitrogen 公司,RNA 反转录试剂盒(TaKaRa Prime Script TM RT-PCR Kit)、DNA marker DL2000、大肠杆菌DH5α感受态细胞、克隆载体pMD19 -T Vector 试剂盒购于TaKaRa 生物公司,IPTG、X-gal 购于上海生工公司,DNA 凝胶回收试剂盒购于天根生物技术公司,其它试剂均为国产分析纯。
1.3 总RNA 的提取
在Trizol 试剂盒方法的基础上做进一步改进。(1)减少样品的起始量(使之与提取缓冲液的比例在1∶10 左右);(2)体积分数75%的乙醇冲洗两次;(3)-20 ℃异丙醇沉淀RNA 的时间减为5 ~10 min、离心速度减小到10 000 r/min,提取蕙兰花葶总RNA 后,使用DEPC 水稀释,用Q5000 核酸蛋白分析仪(美国Quawell 公司)测定其A260、A280值,测定RNA 浓度和纯度,并用8 g/L 琼脂糖凝胶电泳检测RNA的完整性。
1.4 蕙兰GAPDH 基因片段的克隆
1.4.1 总RNA 反转录反应 用M -MLV 反转录酶(TaKaRa 公司)合成cDNA 第一链,具体方法参照试剂盒说明书。反应产物保存于-20 ℃。

表1 扩增GAPDH 基因cDNA 序列所用的引物及引物之间在各扩增反应中的组合Tab.1 PCR primers for amplification of cDNA sequence of GAPDH gene and combination of primers
1.4.2 PCR 扩增 PCR 反应体系20 μL:10 ×PCR Buffer 2 μL,25 mmol/L MgCl21.5 μL,2.5 mmol/L dNTP1.6 μL,模板cDNA 为1 μL,10 μmol/L 上下游特异引物各1 μL,0. 5 uTaq 酶0. 2 μL,ddH2O 11.7 μL。
扩增程序为:94 ℃预变性5 min,然后以94 ℃,40 s,56 ℃,40 s;72 ℃,40 s 进行35 个循环,于72 ℃延伸10 min。取7 μL 扩增产物用10 g/L 琼脂糖凝胶电泳鉴定。
1.4.3 胶回收 60 μL 的PCR 产物经10 g/L 琼脂糖凝胶电泳后,EB 染色20 min,紫外光下迅速切下目的条带,按照DNA 凝胶回收试剂盒说明进行胶回收,最终得到30 μL 回收产物。取3 μL进行浓度检测。
1.4.4 构建重组质粒 取4 μL 回收产物克隆到pMD19 -T vector,构建重组质粒,操作方法按说明书进行。将重组质粒42 ℃热击转化大肠杆菌DH5α感受态细胞,涂布在含有Amp 抗性、IPTG 和X-gal 的平板上,置于37 ℃培养箱暗培养14 h 左右,蓝白斑筛选重组子。
1.4.5 重组质粒的鉴定和测序 挑白斑于含有Amp 抗性的LB 培养基中摇菌8 h,PCR 检测,将阳性菌液1/1 000 比例扩摇,再次PCR 检测扩摇菌液,最后将阳性菌液送英骏公司测序。
1.4.6 蕙兰GAPDH 基因全长的cDNA 克隆 根据确定的已知核苷酸序列的保守区段,设计合成上下游巢式引物各2 个,并与3'RACE、5'RACE 试剂盒中的引物相结合克隆该已知序列的5'和3'端(3'RACE和5'RACE 具体步骤按照说明书进行)。PCR 产物回收后经T 载体克隆、测序,使用DNAMAN 软件与已知序列进行拼接,获得该基因的cDNA 全长序列。
1.4.7 生物信息学分析 利用DNAMAN 软件进行核苷酸序列的拼接,氨基酸序列同源性分析,并构建GAPDH 系统进化树;联网NCBI 寻找开放阅读框(http://www. ncbi. nlm. nih. gov/gorf/gorf. html),进行BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi);并登录至GenBank;氨基酸的推断利用Primer5.0 软件;利用ProtParam (http://web.expasy.org/protparam/)预测其相对分子量和等电点;其蛋白质的疏水性分析通过ExPASy (http://www. expasy. org/cgi - bin/protscale. pl)进行;通过Scanprosite (http://www.expasy.org/tools/scanprosite/)进行蛋白质结构功能域的分析;输入SubLoc(http://www.bioinfo.tsinghua.edu.cn/SubLoc 和PSORT (http://ipsort.hgc. jp/predict. cgi)进行亚细胞定位分析;编码蛋白的二级结构应用http://www. ch. embnet. org/software/COILS_form. html 和http://www. predictprotein. org进行预测;通过SWISS -MODEL (http://swissmodel.expasy.org//SWISS -MODEL.html)在线进行三维结构建模。
1.4.8 表达稳定性检测 为了检测该基因是否适合作为蕙兰的内参基因,笔者将RNA 和cDNA 进行定量,并减少PCR 扩增循环数为20,进行检测该基因在不同器官的表达。
2 结果与分析
2.1 总RNA 质量分析

图1 RNA 提取Fig.1 RNA extraction

图2 扩增结果Fig.2 PCR prducts

图3 蕙兰CfGAPDH 与其他兰科植物GAPDH 基因所编码的氨基酸序列残基的比对Fig.3 Multiple sequence alignments of animo acids deduced by CfGAPDH and GAPDH of other plants in Orchidaceae family
2.2 蕙兰GAPDH 基因片段的克隆
用材料与方法中所设计的目的片段扩增特异引物,以蕙兰花蕾期花葶的cDNA 为模板,经PCR 扩增得到了900 bp 左右的片段(图2 A),这个片段与预期长度基本相同,并对此扩增产物进行纯化回收。对上述回收的产物连接到pMD19 -T,并转化到大肠杆菌DH5α大肠杆菌中进行菌落培养,挑白斑进行菌落PCR 扩增,并电泳检测检测,发现得到的片段与上述以cDNA 为模板得到的扩增产物长度相同,表明上述片段已经连接到pMD19 -T 上。
利用Gfo-327、Gfi-637 与3'RACE 试剂盒中的内外引物相结合做巢式PCR 克隆该序列的3'端,扩增获得了700 bp 左右的片段(图2B);利用Gro-279、Gri-114 与5'RACE 试剂盒中的内外引物相结合做巢式PCR 克隆该序列的5'端,扩增获得了350 bp 左右的片段(图2 C)。
2.3 GAPDH 基因cDNA 序列测定和同源性比较
测序结果表明所获得的5 个GAPDH cDNA 片段的长度均为875 bp,用DNAMAN 进行多序列比对,相似性为99.70%,经BLAST 同源性比较结果显示,该片段的核苷酸序列与春兰、墨兰、文心兰GAPDH核苷酸序列的同源性均在91%以上,表明已克隆出蕙兰GAPDH 基因的部分cDNA 序列。将其分别命名为CfGAPDH1、CfGAPDH2、CfGAPDH3、CfGAPDH4 和CfGAPDH5,GenBank 登 录 号 为JN177722、JN177723、JN177724、JN177725 和JN177726。将巢式PCR 扩增产物测序,3'端片段序列667 bp,5'端片段序列332 bp,均与已知序列有重叠,拼接成功。该序列cDNA 全长分别为1 496 bp,具有完整的开放阅读框(ORF,CfGAPDH:173 -1 195 bp),编码340 个氨基酸,登录号为JX560732。
由图1 中可见,所提取的总RNA 的28S、18S 和5S 3 条带完整清晰,且28S 的亮度大约是18S 两倍左右,表明所提取总RNA 完整性好,没有降解。紫外分光光度法测得OD260/OD280的比值为1.92,表明总RNA 的纯度较高。没有糖、蛋白质等污染。
2.4 CfGAPDH 蛋白的同源比较及系统进化分析
蕙兰CfGAPDH 所编码的氨基酸残基序列经BLAST,与其他植物的GAPDH 蛋白有较高的同源性(80%以上)。用DNAMAN 进行多重序列比对表明,与春兰GAPDH1(Cymbidium goeringii JQ978220.1)、朵丽蝶兰GAPDH1(Doritaenopsis JN185660.1)、朵丽蝶兰GAPDH2(Doritaenopsis JN185661.1);文心兰GAPDH1(Oncidium hybrid cultivar JN981141 )、文心兰GAPDH2(Oncidium hybrid cultivar JN981142)、墨兰GAPDH1(Cymbidium sinense JQ796074)、墨兰GAPDH2(Cymbidium sinense JQ796075)的氨基酸均有86.65%以上的同源性,与墨兰GAPDH2 仅有一个氨基酸之别(图3)。
通过对蕙兰与其他兰科植物GAPDH 基因核苷酸序列的聚类分析发现,蕙兰CfGAPDH 基因与墨兰GAPDH1、墨兰GAPDH2 和春兰GAPDH1 的同源性最高(99%),与朵丽蝶兰GAPDH1、朵丽蝶兰GAPDH2 同源性次之(92%),而与文心兰GAPDH1 和文心兰GAPDH2 的同源性最低(90%)(图4)。
而氨基酸序列聚类分析表明,蕙兰CfGAPDH 基因与墨兰GAPDH2 所编码的氨基酸残基序列同源性达100%,与墨兰GAPDH1 和春兰GAPDH1 同源性次之(99%),而与文心兰GAPDH1 和文心兰GAPDH2 的同源性最低(94%)(图5)。
2.5 蛋白质的一级结构分析
2.5.1 蛋白质序列理化参数 利用Protparam(http://web. expasy. org/protparam)开展的分析发现该蛋白包括340 个氨基酸,蛋白的分子式分别为C1652H2620N440O495S8,分子量分别为36 822.1;等电点pI 为6.27;氨基酸中含量较高的是丙氨酸(10.0%)和缬氨酸(10.6%),推算其不稳定参数分别为25.88,脂溶指数为92.32,GRAVY 值为 -0.056。

图4 兰科植物GAPDH 基因核苷酸序列的聚类分析Fig.4 Phylogenetic tree of C.faberi GAPDH nucleotide sequences with known GAPDH of other plants in Orchidaceae family
2.5.2 蛋白质亲疏水性分析 利用Protscale(http://web. expasy. org/protscale/)进 行 疏 水性分析,CfGAPDH 蛋白质存在2 个高分值(Score >1.5)峰(图6),分别分布在20、170 氨基酸位点附近,这些区域属于疏水性;而5 个低分值(Score <0)峰则位于55、140、200、270、330氨基酸位点附近,这些区域属于高亲水性,由此推断该蛋白亲水性较强,是蛋白质进化中氨基酸插入的主要位点。
2.6 二级结构预测与功能域分析
2.6.1 卷曲螺旋预测 利用COILS(http://www. ch. embnet. org/software/COILS_form. html)预测卷曲螺旋,该蛋白残基主要显示了两个卷曲螺旋区域,分别位于25 和260 氨基酸位点附近(图7)。在线预测分析(http://www. predictprotein.org)二级结构表明,该基因编码的氨基酸由27.1%的 α 螺旋、31.8%的 β 折叠和41.2%的 β 转角所组成。
2.6.2 蛋白功能域及定位分析 利用Scanprosite (http://www. expasy. org/tools/scanprosite/)服务器分析预测其编码蛋白的功能域,发现该基因编码的蛋白带有与光合作用密切相关的2 个位点硫解酶活性部位(thiolases active site)和2 个2Fe-2S 氧化还原蛋白型铁硫结合结构域(2Fe -2S ferredoxin - type iron - sulfur binding region)、TUBULIN(Tubulin subunits alpha,beta,and gamma signature)等功能域。
利用PROST (http://psort. ims. u - tokyo.ac.jp/form. html)定位分析发现该蛋白是一种细胞质或者微体蛋白。同时利用SubLoc(http://www. bioinfo. tsinghua. edu. cn/SubLoc)定位分析表明该蛋白属于胞质型蛋白。
2.7 3D 结构建模
利用SWISS MODEL 进行该基因的3D 建模结果表明其空间结构由α 螺旋、β 折叠和β转角所组成,β 转角所占比例较高,且与春兰、小麦GAPDH 基因的3D 结构非常相似(图9)。
2.8 蕙兰GAPDH 基因在检测其它基因表达时的效果
为了检测GAPDH 基因在其它基因表达的效果,跨内含子设计检测引物,研究了GAPDH 基因在植株不同部位(叶0、叶1、叶2、葶1、葶2、花萼、花瓣、唇瓣、蕊柱、子房)的表达(图10)。

图5 兰科植物GAPDH 基因氨基酸序列的聚类分析Fig.5 Phylogenetic tree of C.faberi GAPDH protein sequences with known GAPDH of other plants in Orchidaceae family

图6 CfGAPDH 蛋白的亲/疏水性分析Fig.6 Hydropathy analysis was performed using the Kyte and Doolittle algorithm

图7 CfGAPDH 蛋白的卷曲螺旋预测Fig.7 Coils of CfGAPDH
结果发现,在扩增中,发现GAPDH 非常易于扩增、条带清晰,且表达量较高,初步判定适合作其他功能基因表达的内参照基因。
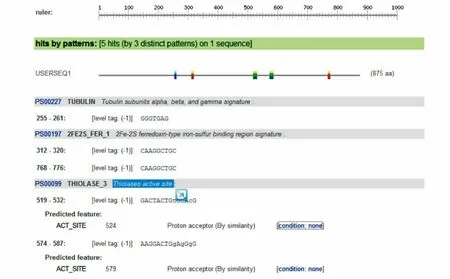
图8 CfGAPDH 蛋白的功能域Fig.8 Functional domain of CfGAPDH

图9 GAPDH 蛋白的三维结构比较Fig.9 The predicted three-dimensional structure comparisons of GAPDH

图10 蕙兰GAPDH 基因在各个器官中的时空表达Fig.10 The expression of GAPDH in different organs
3 讨论
本研究首次报道了来自于蕙兰的GAPDH 的cDNA 序列,该序列与其它植物来源的GAPDH 在氨基酸水平上的同源性介于69% ~100%。这一高度保守性与其在植物糖酵解途径中功能的高度保守密切相关,可用于生物之间的系统发育分析[13]。
高等植物中GAPDH 存在的方式有2 种[14]。一种依赖NAD+存在于胞液中,由4 个相同的亚基(C4)组成,每一个亚基均由GapC 基因(即依赖NAD+的胞质型GAPDH 基因)编码。另一种则存在叶绿体中,以NAPD(H)为辅酶,也可以NAD+为辅酶。有文献表明植物的GapC 基因序列和蛋白质结构具有高保守性,甚至可作为某种植物起源与进化的分子标准[15]。本次实验所克隆的蕙兰GAPDH 基因为胞质型依赖NAD+的GAPDH 基因即GapC 基因的可能性较大。进一步研究该基因在惠兰植物体内的表达规律,将有望揭示该基因作为内标基因的分子机制,相关的工作正在进行中。
[1]付国良,黄晓红.甘油醛 -3 -磷酸脱氢酶功能的研究进展[J].生物物理学报,2013,29(3):181 -191.
[2]尚海旭,井然,贾弘禔,等.GAPDH 功能多样性[J].生理科学进展,2011,42(5):371 -374.
[3]Pohlmeyer K,Paap B K,Soll J,et al.CP12:a small nuclear-encoded chloroplast protein provides novel insights into higherplant GAPDH evolution[J].Plant Molecular Biology,1996,32(5):969 -978.
[4]Steinhauser M C,Steinhauser D,Koehl K,et al.Enzyme activity profiles during fruit development in tomato cultivars and solanum pennellii[J].Plant Physiology,2010,153(1):80 -98.
[5]Brinkmann H,Martinez P,Quigley F,et al.Endosymbiotic origin and codon bias of the nuclear gene for chloroplast glyceraldehyde-3 -phosphate dehydrogenase from maize[J].Journal of Molecular Evolution,1987,26(4):320 -328.
[6]闫洪波,葛文雅,程玉豆,等.鸭梨GAPDH 基因家族的克隆及其表达特征[J].西北农林科技大学学报:自然科学版,2012,40(9):181 -186.
[7]Glare E M,Divjak M,Bailey M J,et al.β -Actin and GAPDH housekeeping gene expression in asthmatic airways is variable and not suitable for normalising mRNA levels[J].Thorax,2002,57(9):765 -770.
[8]Xu Y F,Teo L L,Zhou J,et al.Floral organ identity genes in the orchid Dendrobium crumenatum[J].Plant Journal,2006,46:54 -68.
[9]Chang Y Y,Chiu Y F,Wu J W,et al.Four orchid (Oncidium Gower Ramsey)AP1 /AGL9 -like MADS box genes show novel expression patterns and cause different effects on floral transition and formation in Arabidopsis thaliana[J]. Plant Cell Physiology,2009,50(8):1425 -1438.
[10]张国付,蒋素华,崔波,等.文心兰GAPDH 基因片段的克隆及序列分析[J].河南农业大学学报,2013 (1):68 -71.
[11]向林,李伯钧,秦德辉,等.兰花花发育的分子生物学研究进展[J].中国细胞生物学学报,2011,33(5):554 -563
[12]田敏,龚茂江,徐小雁,等.兰科植物花发育的基因调控研究进展[J].浙江农林大学学报,2011,28(3):494 -499
[13]刘志华,杨谦.球毛壳菌甘油醛3 -磷酸脱氢酶基因克隆及特性分析[J].微生物学报,2005,45(6):885 -889.
[14]Backhausen J E,Vetter S,Baalmann E,et al. NAD -dependent malate dehydrogenase and glyceraldehyde 3 -phosphate dehydrogenase isoenzymes play an important role in dark metabolism of various plastid types[J]. Planta,1998,205(3):359 -366.
[15]王幼宁,刘孟雨,李霞.植物3 -磷酸甘油醛脱氢酶的多维本质[J].西北植物学报,2005,25(3):607 -614.

