卵转铁蛋白磷酸化修饰工艺条件优化
黄 蓉,徐明生 ,吴磊燕,杜华英
(江西农业大学 江西省天然产物开发与利用高校重点实验室,江西 南昌330045)
蛋清卵转铁蛋白(ovotransferrin,OVT)约占蛋清蛋白质总量的12%,是一种易溶的非结晶蛋白,相对分子质量约为78 KDa。卵转铁蛋白具有广谱的抗菌功能,对大肠杆菌[1-2]、金黄色葡萄球菌、假单胞菌、异变链球菌等均具有抗菌活性[3]。Mendonca 等[4]研究显示,添加了卵转铁蛋白的火腿对李斯特氏菌有抑制作用,说明卵转铁蛋白可以作为抗菌剂加到肉制品中。可见将卵转铁蛋白开发为天然的防腐剂和抗菌剂应用于各类食品,或制成天然抗菌药物等,其应用和开发前景十分广阔。
卵转铁蛋白的抑菌作用主要在于它可以夺取微生物生长所必须的铁[5],而卵转铁蛋白对铁的结合和释放与它的结构有很重要的关系[6],故可以通过化学修饰改变卵转铁蛋白的结构,提高其结合铁的能力,从而提高卵转铁蛋白的抑菌作用。在各种修饰方法中,磷酸化已被证明是一种有效提高蛋白质功能性质的修饰方法,国内外的研究结果表明磷酸化后的蛋白质在结构和功能上都有很大的变化[7-9]。Yoko Hayashi 等[10]用焦磷酸盐干热磷酸化卵转铁蛋白,提高了卵转铁蛋白的电泳迁移率、热稳定性、乳化性等。本研究利用三聚磷酸钠(sodium tripolyphosphate,STP)对卵转铁蛋白进行修饰改性,以提高卵转铁蛋白的抑菌活性,以期为食品行业提供一种更好的抑菌剂。且三聚磷酸钠是我国GB 2760 -1996和FDA 允许使用的食品添加剂,早已用于食品工业中,因而利用STP 对卵转铁蛋白进行改性,是安全可行的[11-12]。
1 材料与方法
1.1 材料与试剂
卵转铁蛋白(实验室制备,纯度80%);菌种(大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌)江西农业大学食品科学与工程学院菌种保藏中心;固体培养基(琼脂肉汤培养基);液体培养基(营养肉汤培养基);磷标准储液(1 mg/mL);三聚磷酸钠;钼酸铵;无水亚硫酸钠;1,4 -对苯二酚;分析纯。
1.2 仪器与设备
PHS-3E 型pH 计,上海精密科学仪器有限公司;Scientz -系列N 型真空冷冻干燥机,宁波新芝生物科技股份有限公司;V-5600 型可见分光光度计,上海元析仪器有限公司;D -1 型自动蒸汽灭菌锅,北京发恩科贸易有限公司;Spx-250 -Ⅱ型生化培养箱,上海跃进医疗器械有限公司;超净工作台,苏净集团安泰公司。
1.3 试验方法
1.3.1 卵转铁蛋白的磷酸化 配制1%的卵转铁蛋白溶液,边搅拌边加入一定量STP,调pH,在30 ℃水浴中反应一段时间(正交试验各因素水平见表1)。反应结束后,冷却,调节反应液pH 到中性后,将无机磷酸盐透析完全(钼蓝比色法检验),冷冻干燥,制得磷酸化的卵转铁蛋白(PP -OVT)进行抑菌活性测定。

表1 正交试验因素水平表Tab.1 variables and levels of orthogonal experiment
1.3.2 PP-OVT 抑菌活性的测定 采用管碟法[13]无菌操作下,取液体培养的菌液0.1 mL 均匀涂布于平板培养基上,约干燥后,轻轻将牛津杯置于其上,分别在牛津杯中加入0.2 mL 20 mg/mL 的PP -OVT(0.45 μm 孔径微孔滤膜除菌),用无菌水及未磷酸化的卵转铁蛋白溶液做对照,然后小心将培养皿移入37 ℃恒温培养箱中,培养24 ~48 h 后测量抑菌圈直径。
1.3.3 磷酸化程度的测定 采用钼蓝比色法[14]分别吸取磷标准储备液0,1.0,2.0,3.0,4.0,5.0 mL 至50 mL 容量瓶中,依次加入5 mL 钼酸铵溶液,摇匀,静置几秒,加入2.5 mL 亚硫酸钠溶液及2.5 mL 对苯二酚溶液,加蒸馏水定容至50 mL,摇匀,静置30 min,在波长660 nm处测定其吸光度,根据测定值绘制标准曲线。将待测PP -OVT 溶于蒸馏水中,用上述方法测定试样的吸光度,根据标准曲线计算PP - OVT 的磷含量。以原蛋白作为空白,磷酸化程度以每100 g 蛋白质所含磷的克数表示。

图1 磷标准曲线Fig.1 The standard curve of the phosphorus
1.3.4 统计学分析 所有试验均重复3 次,所得数据采用DPS 数据处理系统(版本6.5.5.8)进行方差分析及多重比较。
2 结果与分析
2.1 磷标准曲线的绘制
由图1 可知回归方程为:y =0.052 1x +0.006 8,其中R2为0.997 2。式中:y 一吸光度;x 一磷含量(mg)。
2.2 卵转铁蛋白磷酸化正交试验结果进行分析
2.2.1 卵转铁蛋白磷酸化正交试验结果的直观分析 由表2 可以看出影响PP -OVT 抑菌活性的各因素主次依次是pH、STP 使用量、反应时间。
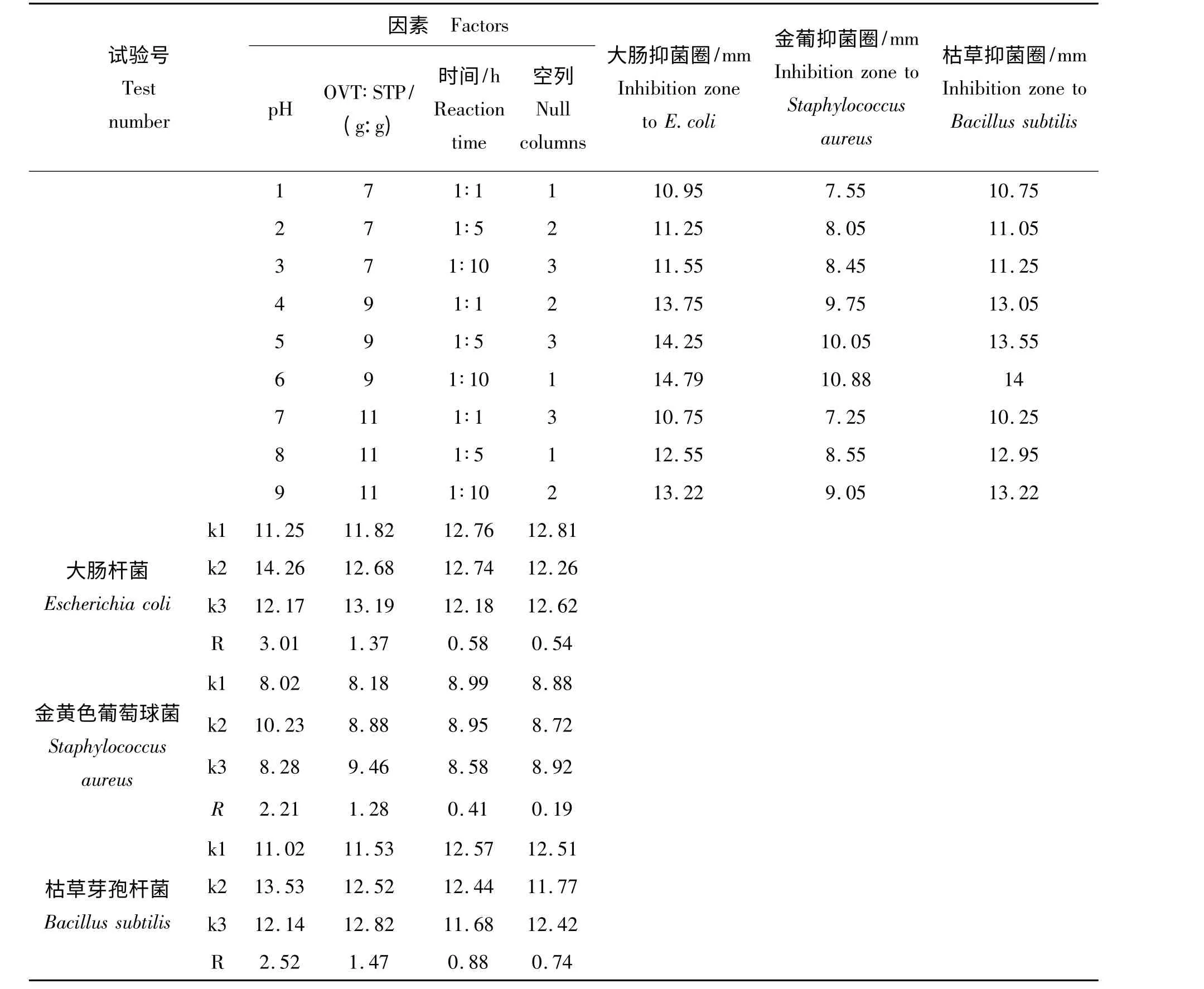
表2 正交试验结果的直观分析表Tab.2 Visual analysis of orthogonal experiment
2.2.2 卵转铁蛋白磷酸化正交试验结果的方差分析和多重比较分析 (1)PP -OVT 对大肠杆菌抑菌活性的方差分析和多重比较分析。从表3 方差分析的结果显示pH 对磷酸化有显著的影响,而STP 使用量和反应时间对磷酸化无显著差异。表4 多重比较分析可以看出A2 与A1 有显著差异。因而可选出最优方案:pH 值为9,OVT/STP 为1 g/1 g,时间为1 h。
(2)PP-OVT 对金黄色葡萄球菌抑菌活性的方差分析和多重比较分析。

表3 PP-OVT 对大肠杆菌抑菌活性的方差分析表Tab.3 Variance analysis of antibacterial effete on Escherichia coli by PP-OVT

表4 PP-OVT 对大肠杆菌抑菌活性的多重比较表(LSD 法)Tab.4 Multiple comparison of antibacterial effete on Escherichia coli by PP-OVT
从表5 和表6 可以看出:方差分析的结果显示pH 对磷酸化有极显著差异,STP 使用量对磷酸化有显著的影响,多重比较分析的结果显示A2 与A3 和A1 均有极显著差异,B3 与B1 有显著差异,因而可选出最优方案:pH 值为9,OVT/STP 为1 g/10 g,时间为1 h。
(3)PP-OVT 对枯草芽孢杆菌抑菌活性的方差分析和多重比较分析。

表5 PP-OVT 对金黄色葡萄球菌抑菌活性的方差分析表Tab.5 Variance analysis of antibacterial effete on Staphylococcus aureus by PP-OVT
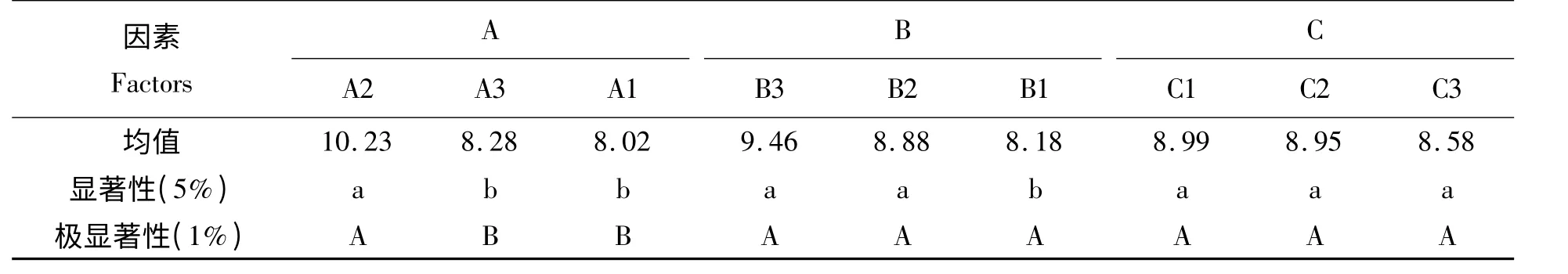
表6 PP-OVT 对金黄色葡萄球菌抑菌活性的多重比较表(LSD 法)Tab.6 Multiple comparison of antibacterial effete on Staphylococcus aureus by PP-OVT
从表7 和表8 可以看出:方差分析的结果显示pH、STP 使用量和反应时间均对磷酸化均无差异,多重比较分析的结果显示A2 与A1 有显著差异,因而可选出最优方案:pH 值为9,OVT/STP 为1 g/1 g,时间为1 h。
从以上结果看,如果单独考虑PP-OVT 对大肠杆菌或者枯草芽孢杆菌的抑制作用,可以选择磷酸化修饰的工艺条件为pH 值为9,OVT/STP 为1 g/1 g,时间为1 h。但是我们期望将PP-OVT 作为一种广谱抑菌剂应用在各类食品中,所以综合考虑PP-OVT 对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制作用,其最优的磷酸化修饰工艺条件应为:pH 值为9,OVT/STP 为1 g/10 g,时间为1 h,并测得其磷酸化程度为4.7%。
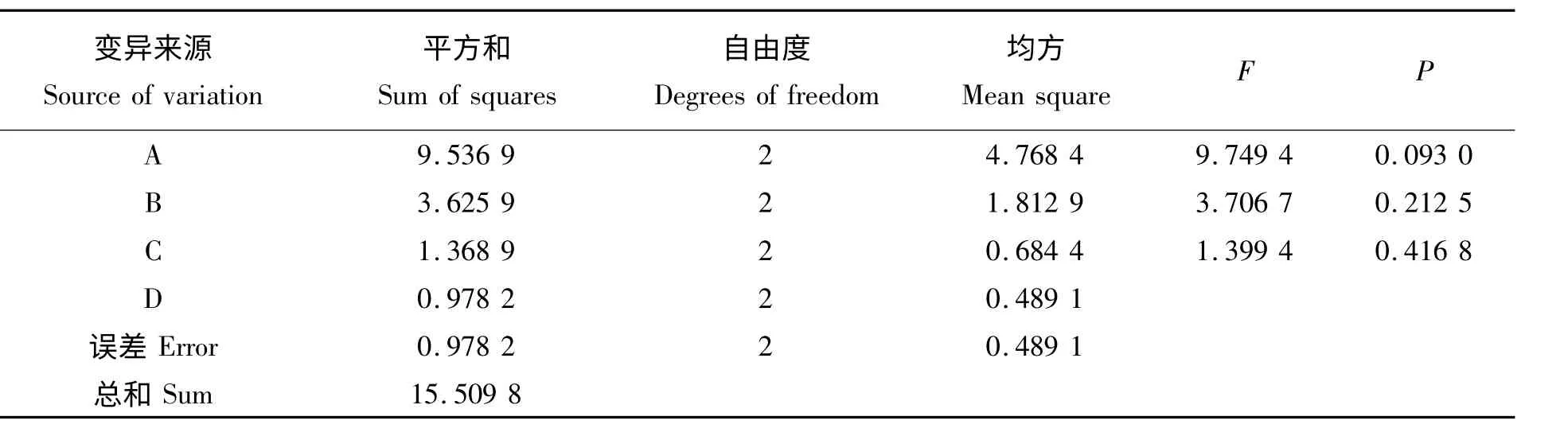
表7 PP-OVT 对枯草芽孢杆菌抑菌活性的方差分析表Tab.7 Variance analysis of antibacterial effete on Bacillus subtilis by PP-OVT
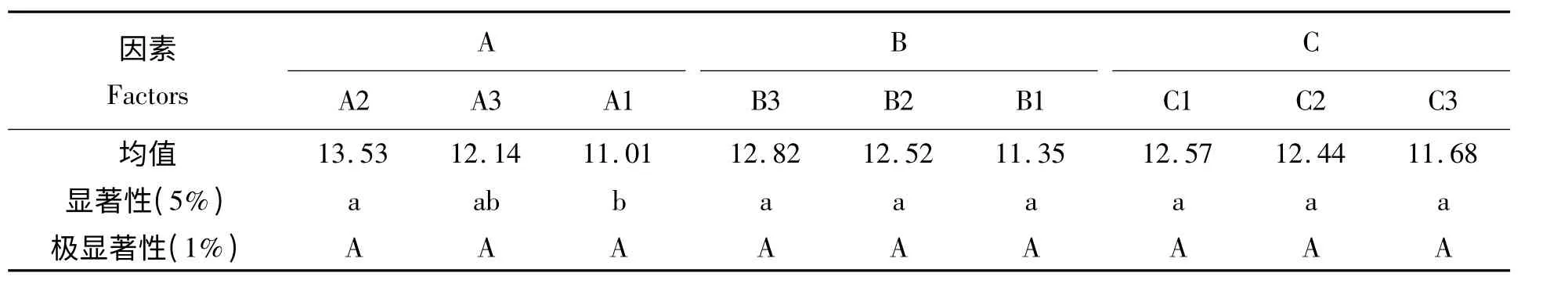
表8 PP-OVT 对枯草芽孢杆菌抑菌活性的多重比较表(LSD 法)Tab.8 Multiple comparison of antibacterial effete on Bacillus subtilis by PP-OVT
2.3 最优磷酸化改性工艺条件下制备的PP-OVT 抑菌性能分析
从表9 可以看出:经过磷酸化修饰,卵转铁蛋白对大肠杆菌的抑菌活性有极显著提高,对金黄色葡萄球菌和枯草芽孢杆菌的抑菌活性有显著提高。

表9 PP-OVT 与OVT 对3 种菌抑菌活性的比较Tab.9 comparison of antimicrobial activity between PP-OVT and OVT

图2 PP-OVT 对3 种菌抑菌活性Fig.2 The antimicrobial activity of PP-OVT
3 讨论
[1]Schade A L ,Caroline L.Raw hen egg white and the role of iron in growth inhibition of Shigella dysenteriae,Staphylococcus aureus,Escherichiacoli and Saccharomyces cerevisiae[J].Science,1944,100:14 -16.
[2]Schade A L,Caroline L.An iron-binding component in human blood plasma[J].Science,1946,104:340 -342.
[3]董天堂,田子罡,何涛.禽类抗菌蛋白及其结构、分布和活性[J].New Feed,2008(4):16 -21
[4]Ko K Y,Mendonca A F,Ahn D U.Effect of Ethylenediamie tetraacetate and lysozyme on the antimicrobial activity of ovotransferrin against Listeria monocytogenes[J].Poultry Science ,2008,87(8):1649 –1658.
[5]Bullen J J,Rogers H J,Griffiths E.Role of iron in bacterial infection[J].Curr Top Microbiol Immunol,1978,80:1 -35
[6]Muralidhara B K,Hirose M.Structural and functional consequences of removal of the interdomain disulfide bridge from the isolated C-lobe of ovotransferrin[J].Protein Science,2000,9(8):1567 -1575.
[7]Can-Peng Li,Hirofumi Enomoto,Yoko Hayashi ,et al. Recent advances in phosphorylation of food proteins:A review[J].LWT-Food Science and Technology,2010,43:1295 -1300
[8]李灿鹏,陈德义,赵逸云,等.食品蛋白质磷酸化改性的研究进展[J].食品科学,2009,30(11):252 -255.
[9]Hayashi Y,Nagano S,Enomoto H,et al.Improvement of foaming property of egg white protein by phosphorylation through Dry-Heating in the presence of pyrophosphate[J].Food Chemistry,2009,74:68 -72.
[10]Yoko Hayashi,Can-Peng Li,Hirofumi Enomoto,et al.Improvement of functional properties of ovotransferrin by phosphorylation hrough dry-heating in the presence of pyrophosphate[J].Asian-Aust.Journal of Animal Science,2008,21(4):596-602.
[11]朱永胜,王金水,渠琛玲,等.STP 磷酸化处理对小麦面筋蛋白酶解特性的影响[J].河南工业大学学报,2011,21(1):31 -35.
[12]熊柳,孙高飞,王建化,等.花生分离蛋白磷酸化改性研究[J].食品科学,2010,31(10):35 -41.
[13]宗绪岩,李丽,张静,等.啤酒糟蛋白水解物对大肠杆菌抑菌能力研究[J].食品工业科技,2012,33(15):83 -85,89.
[14]赵学.钼蓝法测定保健品中总磷的含量[J].甘肃科技,2008,24(1):50.
[15]任国栋,马美湖.卵转铁蛋白(ovotransferrin)转铁机制的研究进展[C].第九届中国蛋品科技大会论文集,长春:吉林大学,2010:461 -468.
[16]Hiroufmi Kurokwaa,Bunzo Mikami ,Masaaki Hiorse.Crystal structure of diefrrie Hen ovotransefrrin at 2.4A resolution[J].Journal of Molecular Biology,1995:254,196 -207.
[17]袁小军.卵转铁蛋白的分离纯化、结构表征及体外抗菌研究[D].武汉:华中农业大学,2011.

