不同抗生素对岭南黄肉鸡生产性能和肠道免疫影响的研究
倪 江,杨维仁 ,高权新,张崇玉,刘法孝,孙小沛
(1.山东农业大学 动物科技学院,山东 泰安271018;2.浙江大学 宁波理工学院,浙江 宁波315000;3.中国水产科学院 东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海200090)
抗生素作为饲料添加剂已有50 多年的历史,其促生长作用效果已无可非议[1],但在实际使用过程中产生的耐药性及残留问题得到人们关注,欧盟甚至已经禁止抗生素作为饲料添加剂的使用。肯德基麦当劳“毒鸡门”事件把中国养殖行业的抗生素滥用现象曝光,引发国人对食品甚至健康的思考,但当下中国特色的粗放式集约化养殖模式使得生产中对抗生素的依赖性很大,在封闭狭窄的环境中,肉鸡本身的免疫力的下降,抗生素等则起到免疫替代作用。尤其是在早期肉鸡自身免疫系统没有发育完全时,代替机体免疫力抑制病原微生物的冲击,从而提高肉鸡生产性能[2]。肉鸡肠道是体内最大的细菌和毒素的集散地,细菌和毒素若穿过肠壁,能够给机体带来极大伤害。正常的肠道之所以能够有效地将肠道内细菌、毒素等有害物质限制在肠道内是因为肠道免疫发挥重要作用[3],故畜禽肠道免疫的作用巨大。抗生素能够杀灭和抑制细菌生长,因此能够分担肠道免疫的重担。同时,过度抗生素添加能够影响肠道共生菌的生存,造成菌群失调。因此本文就对3 种常用剂量抗生素添加对肠道的TLR2、TLR4、IL -6、TNF-α、IL-10 等炎症因子mRNA 以及肠道sIgA 分泌量进行测定,研究不同种类抗生素对肠道免疫的影响。
1 材料与方法
1.1 试验材料
饲用抗生素含量均为10%的预混剂,由宁波舜大饲料股份有限公司提供。鸡分泌性免疫球蛋白A(sIgA)ELISA 试剂盒、鸡血清免疫球蛋白M(IgM)ELISA 试剂盒由上海晨易生物科技有限公司购买。
1.2 试验饲粮
日粮在试验前统一备齐,使各试验组营养成分水平一致。营养水平参考中华人民共和国农业行业标准—肉鸡饲养标准(NY/T 33 -2004)。试验日粮的组成见表1。
1.3 试验设计与饲养管理
本试验采用单因子设计,选用健康均匀的1 日龄岭南黄肉鸡240 只,随机分为Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组,每组3 个重复,每个重复20 只。Ⅰ组为空白对照组,饲喂基础日粮;Ⅱ组在基础日粮的基础上添加盐酸林可霉素4 mg/kg,Ⅲ组在基础日粮的基础上添加杆菌肽锌50 mg/kg;Ⅳ组在基础日粮的基础上添加硫酸粘杆菌素20 mg/kg。盐酸林可霉素是对革兰氏阳性菌作用较为强烈的一种抗生素添加剂,主要通过抑制蛋白质的合成起到抑菌和杀菌效果;杆菌肽锌属于多肽类抗生素,通过抑制合成对革兰氏阳性菌和部分革兰氏阴性菌起到作用;硫酸粘杆菌素则主要针对革兰氏阴性菌,也是通过抑制蛋白质的合成起作用。试验期为4 周,试验期间自由采食饮水,24 h 光照,各组鸡所处的环境的温度、湿度、光照等均大致保持一致。
1.4 生产性能的测定
试验至28 日龄的早晨空腹称质量。称质量前夜20:00 开始禁食12 h,只供饮水,于次日晨08:00以重复为单位,测定每组肉鸡的体质量、采食量,计算试验期的平均日采食量、平均日增重和料肉比。

表1 基础日粮组成及营养水平(风干基础)Tab.1 Composition and nutrient levels of the diets (air-dry basis)
1.5 免疫指标的测定
1.5.1 肠道分泌免疫球蛋白A( sIgA) 在28 日龄时,每组随机抽取2 只鸡,取肠道各段内容物0.5 g,用pH7.4 PBS 稀释一倍,6 000 r/min 离心15 min,取上清4 ℃保存。用ELISA 试剂盒测定sIgA 水平。
1.5.2 肠道组织中细胞因子mRNA 相对表达水平的测定 根据GenBank 公布的鸡基因序列设计引物(表2),引物由上海生工生物科技有限公司合成。用RNA 提取试剂盒(OMEGA,R6934 -01)提取回肠组织样本中的总RNA。对总RNA 质量进行检测后,以β-actin 为相对定量内参,以Takara 试剂盒进行反转录。RT-PCR 扩增条件为:96 ℃10 min,(95 ℃15 s,60 ℃60 s)×40 个循环。荧光定量PCR 数据根据2 -△△Ct 计算TLR2、TLR4、促炎症细胞因子白细胞介素-6(IL -6)、肿瘤坏死因子-α(TNF-α)及抑制炎症细胞因子白细胞介素-10(IL -10)的基因mRNA 相对表达量水平。数据用origin8.0进行作图呈现。

表2 实时荧光定量PCR 引物序列Tab.2 Primer sequence for fluorescence-based quantitative real-time PCR
1.6 数据处理
采用SAS9.0 软件对数据进行统计学处理,用One-way ANOVA 分析,并进行Duncan 氏多重比较,数据以平均数±标准差表示,P <0.05 为差异显著。数据使用origin8.0 进行作图。
2 结果分析
2.1 不同抗生素对早期岭南黄肉鸡生产性能的影响
由表3 可见,不同抗生素可以显著提高岭南黄肉鸡28 日龄的体质量,提高采食量和日增重(P <0.05),降低料肉比(P >0.05)。与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组28 日龄体质量分别提高5.86%、5.31%和3.73%(P <0. 05),采食量分别提高7. 14%、5. 54% 和3. 17% (P <0. 05),日增重则分别提高6.49%、6.33%和4.19%(P <0.05);同时试验各组有改善料肉比的趋势,但与试验组相比差异不显著(P >0.05)。说明饲喂3 种抗生素能够提高肉鸡生长速度,但对饲料转化效率改善不是很明显。
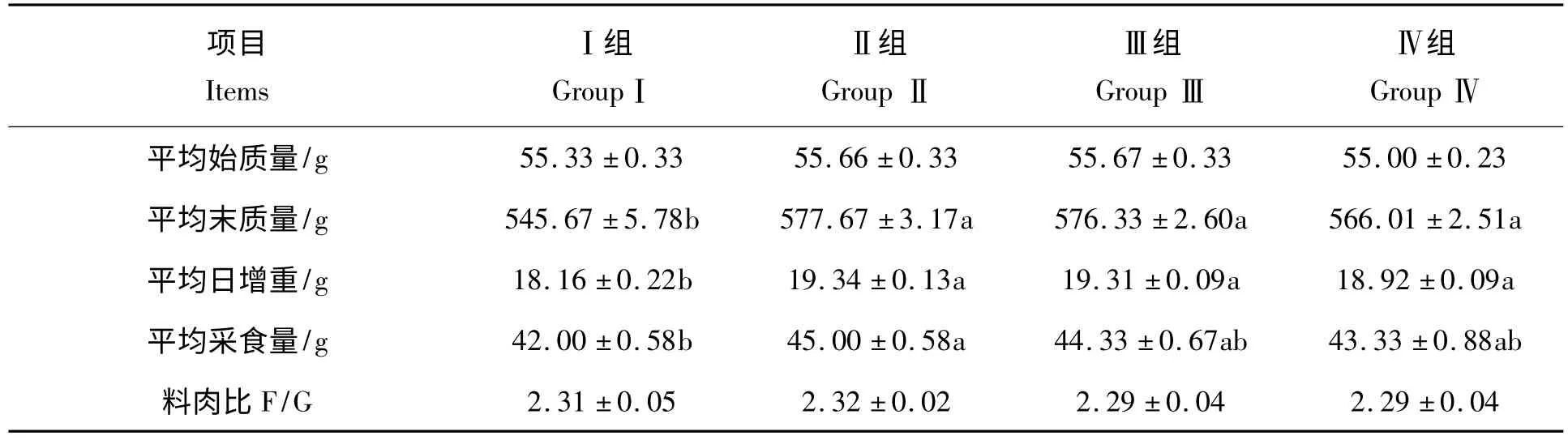
表3 不同抗生素对1 ~4 周龄岭南黄肉鸡生产性能的影响Tab.3 Effect of different antibiotics on growth performance of Lingnan yellow broilers
2.2 不同抗生素对肠道免疫的影响
2.2.1 不同抗生素对1 ~4 周龄岭南黄肉鸡肠道TLR2、TLR4 mRNA 水平的影响 由图1 可知,与对照组相比,在十二指肠和回肠中,实验组的TLR2 和TLR4 mRNA 的表达量出现下降趋势。在图1 -A 中十二指肠和回肠中,林可霉素组和杆菌肽锌组的TLR2 mRNA 的表达量出现显著降低(P <0.05),TLR4 mRNA 的表达量则差异不显著(P >0.05)。在图1 -B 中,回肠中硫酸粘杆菌素组的TLR4 mRNA 的表达量出现显著降低(P <0.05),空肠中TLR4 mRNA 变化均不显著(P >0.05)。

图1 不同抗生素对肉鸡肠道TLR2、TLR4mRNA 表达的影响Fig.1 Effects of different antibiotics on the mRNA relative expression of TLR2、TLR4 in lingnan broiler
2.2.2 不同抗生素对肉鸡肠道相关细胞炎症因子mRNA 表达的影响 炎症细胞因子作为机体免疫系统的重要组成部分,能够调节多种细胞的生理功能,在机体炎症反应和免疫应答的过程中起到十分重要的作用[6]。IL-6、TNF-α 为促进炎症细胞因子,而IL-10 为抑制炎症的细胞因子。由图2 可知,在十二指肠和回肠中,三种炎症因子mRNA 的表达量也是出现下降趋势。在图2 -A 中,杆菌肽锌组的肉鸡十二指肠中IL-6 mRNA 的表达量出现显著降低(P <0.05),而在回肠中林可霉素组和杆菌肽锌组中IL-6 mRNA 的表达量出现显著降低(P <0.05)。在图2 -B 中,林可霉素组在十二指肠和回肠中TNF-α mRNA 的表达量出现显著下降(P <0.05);在图2 -C 中,林可霉素组回肠中IL -10 mRNA 表达量出现显著下降(P <0.05),但硫酸粘杆菌素组中三种炎症因子虽出现下降但差异不显著(P >0.05)。

图2 不同抗生素对肉鸡肠道相关细胞因子基因mRNA 表达的影响Fig.2 Effects of different antibiotics on the mRNA relative expression of inflammatory cytokine genes in lingnan broiler
2.2.3 不同抗生素对肉鸡肠道sIgA 表达的影响 不同抗生素对早期岭南黄肉鸡肠道sIgA 的影响见表4。由表4 可知,与对照组相比,十二指肠中各实验组的sIgA 水平均出现显著下降,分别减少4.47%、14.41%和6.14%(P <0.05);在回肠中sIgA 水平则出现差异,林可霉素组和杆菌肽锌组中都出现显著降低,分别下降11.9%和4.03%(P <0.05),而硫酸粘杆菌组sIgA 提高6.67%(P <0.05)。

表4 不同抗生素对肠道sIgA 的影响(ng/g)Tab.4 Effect of different antibiotics on sIgA in Lingnan yellow broilers
3 讨论与结论
3.1 不同抗生素对早期岭南黄肉鸡生产性能的影响
饲用抗生素是常用的饲用添加剂,对畜禽生长都起到明显促进作用。Moore 等[1]最先报道了在家禽添加抗生素促生长添加剂提高动物生产效率。Hays 等[4]对多种抗生素进行饲喂试验,抗生素能显著促进动物生长,改善饲料报酬。在畜禽养殖过程中,抗生素促生长机理有以下几方面:1)抑制病原微生物生长,减轻对畜禽的抑制作用;2)使动物肠壁变薄,利于肠道养分的吸收;3)抑制肠道微生物产生的毒素,合成有益养分;4)直接参与调节畜禽的新陈代谢[5]。因此,抗生素的作用主要通过抑制微生物来发挥作用。在本试验中,实验组肉鸡的日增重都显著增加,且林可霉素组的效果最好。这可能因为鸡肠道优势菌群大都为革兰氏阳性菌,因而能够抑制革兰氏阳性菌的抗生素作用效果明显。
3.2 抗生素调整肠道肉鸡肠道免疫
肠道免疫包括肠道上皮细胞形成的天然免疫的第一道防线及肠道粘膜组织的淋巴组织,是机体抵御外界病原微生物侵袭的重要屏障。Toll 样受体(toll-like receptors,TLR)是一种能识别病原微生物保守分子序列的模式识别受体,能够实现对外来病原体早期识别,启动机体天然免疫,并引发获得性免疫,在肠道免疫的过程中发挥重要作用。肉鸡Toll 样受体(ChTLRs)不仅表达各种免疫细胞,还大量表达与各种上皮细胞等天然免疫的第一道防线。其中,肉鸡肠道组织和免疫器官的ChTLRs 的表达量明显高于其他组织,说明在其在肉鸡免疫过程中的重要作用[6]。ChTLR2 和ChTLR4 主要识别阳性菌的脂蛋白和阴性菌的脂多糖[7]。在本实验中,I 组和II 组的ChTLR2 mRNA 表达量显著降低,而IV 组回肠中ChTLR4 mRNA 表达量显著降低,肠道非特异性免疫降低。但Kazuaki 等研究发现,肉鸡饲粮中添加沙利霉素能够提高肉鸡肠道上段3 -8 日龄的ChTLR-2、ChTLR-4 mRNA 的表达量,但在后期却能降低肠道免疫因子的表达量[8]。这可能是在3 -8 日龄肉鸡肠道菌群的分解产物能够刺激肠道免疫,而后期当肠道菌群达到平衡状态,抗生素使用能够减少肠道细菌浓度,降低肠道免疫[9]。Gaskins 等证明肠道共生菌能够通过上皮细胞信号传导途径抑制免疫反应,因此,抗生素的过量使用能够降低共生菌的缓冲作用,从而增强了肠道被外界病原菌侵害的可能性[17]。因此,抗生素的用量要适度控制。
而炎症细胞因子也是免疫的重要组成部分,在家禽对抗体内各种致病菌时起到重要作用[10]。IL-6 是由`被激活的吞噬细胞、淋巴细胞及上皮细胞产分泌的一种糖蛋白,体内多种细胞能被IL-6 激活后同时产生IL-6,从而使炎症反应迅速放大,因此,IL-6 在免疫以及炎症中发挥十分重要作用[11]。TNF-α 也是一种有效的促炎症细胞因子,能够触发中性粒细胞和单核细胞的趋化作用。而IL-10 则主要由Th2 细胞产生,是具有多向性生物学活性的强免疫抑制因子,能改变机体的免疫应答和MHCⅡ类抗原的表达,并能介导Th1 和Th2 两类细胞之间的相互调节,从而抑制机体免疫炎症反应过于强烈。Chichlowski 等研究发现,饲粮中添加沙利霉素能够降低肉鸡回肠IL -1、IL -6 和IL -10 mRNA 表达量的趋势[12]。在本实验中,I 组和II 组肉鸡的促炎症因子IL-6 和TNF-α 和抑制炎症因子IL-10 的表达同时下调,而IV 组的炎症因子表达变化不显著。笔者推测这可能与抗生素杀菌谱不同有关,肠道粘膜紧密接触的多是梭菌属、双岐杆菌属等革兰氏阳性菌,它们通过特异性和非特异免疫途径刺激肠道免疫,使其维持一定水平(防止病原菌入侵),同时又刺激IL-10 的释放[13]。因此,II 组和III 组的广谱和杀灭阳性菌的抗生素可能作用更加明显一点。分泌性免疫球蛋白A(sIgA)则是粘膜免疫系统的主要效应因子,能够通过吞噬粘液中的微生物等抗原物质增强免疫排斥作用,阻止微生物穿过肠道粘膜屏障[14]。肠道内容物中sIgA 的分泌量直接取决于抗原(微生物等)的刺激,而肠道粘膜直接与大量微生物接触,故肠道中的正常菌群是肠道粘膜淋巴系统产生sIgA 的主要刺激来源[15]。谢全喜等报道肉鸡在饲喂抗生素能够降低肠道sIgA 的分泌量[16]。而本试验中,II 组和III 组的回肠内容物的sIgA 的分泌量较Ⅰ组都显著下降,但IV 组的sIgA 的分泌量出现上升。笔者推测这也可能与抗菌谱不同有关。综合上述结果,三种抗生素抗菌谱不同,造成肠道菌群数量和结构的变化,而影响肠道免疫。其中,抗革兰氏阳性和广谱抗生素对肠道微生物的影响可能会比较大,但是需要更加深入的研究结果来证明。
3 种抗生素能够提高肉鸡日增重,其中盐酸林可霉素组最显著;同时,三种抗生素的使用均能够降低肠道免疫水平。
[1]Moore P R,Evenson T D,Luckey E,et al.Use of sulphasuccidine,streptothricin and streptomycin in nutrition studies with the chick[J].Journal of Biological Inorganic Chemistry,1946,165;437 -441.
[2]Mccacken V J,Gaskins H R.Probiotics and the immune system[M].UK,Norfolk:Horizon Scientific Press,1999;85 -111.[3]童晓莉,周勤飞,王永才.动物肠道免疫研究进展[J].现代畜牧兽医,2005(9):48 -50.
[4]Hays V W.Biological basis for the use of antibiotics in livestock production[M]. National Research Council Publication,1969;11 -30.
[5]佟建明.饲用抗生素促生长机理研究进展[J].国外畜牧科技,1997,24(6);2 -5.
[6]周作勇,聂奎,宋振辉,等.雏鸡不同组织TLR1、TLR2、TLR4、TLR5 和TLR15 mRNA 转录水平相对定量研究[J].畜牧兽医学报,2010,41(11):1453 -1459.
[7]Leveque G,Forgetta V,Morrol S,et al.Allelic variation in TLR4 is linked to susceptibility to salmonella enterica serovar typh-imurium infection in chicken[J].Infect Immun,2003,71(3):1116 -1124.
[8]Kazuaki T,Yoshiko M,Takanori M.Antibiotics feeding accelerate functional maturation of intestinal immune-related cells of male broider chicken after hatch[J].Japan Poultry Science Association,2011,48:187 -192.
[9]Janardhana V,Broadway M M,Bruce M P,et al.Prebiotics modulate immune responses in the gut-associated lymphoid tissue of chickens[J].Journal of Nutrition,2009,139:1404 -1409.
[10]施君.肠道共生细菌和肠道上皮屏障间关系的研究进展[J].国际儿科科学杂志,2010,37(6);597 -600.
[11]Feldmann M,Maini R N.Anti-TNF alpha therapy of rheumatoid arthritis;what have we learned[J].Annual Review of Immunology,2011,19;163 -196.
[12]Chichlowski M,Croom J,McBride B W.Direct-fed microbial PrimaLac and Salinomycin modulate whole-body and intestinal oxygen consumption and intestinal mucosal cytokine production in the broiler chick[J].Poultry Science,2007(86):1100–1106
[13]Lu J R,Umelaalim L,Barry H,et al.Diversity and succession of the intestinal bacterial community of the maturing broiler chicken[J].Appl Environ Microbiol,2003,11:6816 -6824.
[14]Macpherson A J.IgA adaptation to the presence of commensal bacteria in the intestine[J].Curr Top Microbiol Immunol,2006,308;117 -136.
[15]Karin S,Camper A K,Ehrlich G D.Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm[J].Journal of Bacteriol,2002,184(4);1140 -1154.
[16]谢全喜,崔诗法,徐海燕,等.复合微生态制剂与饲用抗生素对肉鸡生长性能、免疫性能和抗氧化指标的影响[J].动物营养学报,2012,24(7);1336 -1343.
[17]Gaskins H R.Impact of the intestinal microbiota on the development of mucosal defense[J].Clinical Infectious Diseases,2008,46:80 -86.

