7.0T 磁敏感加权成像对脑铁含量测定的初步研究
罗晓捷,张媛媛,叶昌青,薛蓉,陈敏
磁敏感加权成像(susceptibility weighted imaging,SWI)又称血氧依赖水平(blood oxygenation level dependent,BOLD)静脉成像[1],它利用组织间磁敏感性差异成像,通过结合相位图和幅度图,SWI对于显示静脉血管、出血后各期代谢产物、钙化、铁沉积等非常敏感,已广泛应用于各种出血性病变、异常静脉血管性病变、肿瘤及变性类疾病的诊断及铁含量的定量分析。SWI已作为商业化序列配备于各大品牌的MR扫描仪上,在1.0T、1.5T、3.0T 甚至更高的场强下均可施行。目前,人用7.0T 磁共振成像系统的临床应用尚未普及,但其在神经影像中的应用研究已倍受关注。本研究对比受试者分别于7.0T 和3.0T 下SWI成像的差异,并积累超高场中枢神经系统成像的经验。
材料与方法
1.临床资料
招募2011年7月-2012年6月于我院就诊的50例非神经系统疾病的老年志愿者,其中男36例,女14例,年龄52~68岁。经常规MRI检查排除脑内畸形、占位及严重脑血管病变,且无帕金森病病史者纳入本组研究。本组所有研究对象还需符合下列要求:①无脑部外伤及精神疾病史;②脑部常规MR 扫描无明显异常,无明显钙化;③均签署知情同意书。
2.仪器与方法
MRI扫描采用荷兰飞利浦(Philips)公司Intera Achieva 3.0T MR 成像系统及德国西门子(Siemens)公司Magnetom 7.0T MR 成像系统,采用8通道头线圈。
扫描序列及参数:将受试者头部置于线圈内,并用海绵垫固定,以限制头部的不自主运动。扫描的中心层面统一定于前后联合线。首先行常规T1WI及T2WI扫描,然后行SWI序列扫描,SWI扫描范围覆盖基底节和中脑。扫描参数:3.0T,TR 45 ms,TE 25ms,翻转角20°,带宽100Hz;7.0T,TR 30ms,TE 15ms,翻转角15°,带宽120Hz,3.0T 与7.0T 其余扫描参数一致。
3.图像处理及数据测量
SWI数据通过32×32的高通过滤产生“高通滤过”的相位图。调节图像窗位至最佳对比度,并对所测核团的大小进行比较,同时对不同场强下的图像质量进行主观评价。利用SPIN 软件(SWI process in neuroradiology,SPIN,美国韦恩州立大学)在高通滤过相位图上分别选取双侧苍白球(globus pallidus,GP)、壳核(putamen,PUT)、尾状核头(head of caudate nucleus,HCN)、黑质(substantia nigra,SN)、红核(red nucleus,RN)以及丘脑(thalamus,THA)最佳显示层面,勾画核团边界,测量并比较选取的兴趣区大小和相位值。数据的处理分析由两位有经验的影像科医师进行。
4.统计学分析
应用SPSS 19.0软件进行统计学分析。采用配对t检验比较3.0T 及7.0T 高通相位图所测核团兴趣区面积及相位值转换的铁含量;采用配对卡方检验比较两位观察者对3.0T 及7.0TSWI幅度图图像质量的评价结果,计算Kappa值,评价两位观察者对影像质量评价结果的一致性程度。以P<0.05为差异有统计学意义。
结 果
1.3.0T 与7.0T 图像的主观评价
图像主观评级标准:①观察的内容包括是否能区分壳核与苍白球、是否能区分黑质网状带与致密带、是否能分辨红核包膜。②图像评级,上述三者皆能区分者为Ⅰ级,能区分两个者为Ⅱ级,能区分一个者为Ⅲ级,三个都不能清楚区分者为Ⅳ级。
7.0T 与3.0T 相 比,幅度图上7.0T 影像能提供更多细节(图1),并可区分核团亚分区(P<0.0001,表1)。两位观察者之间的评价结果差异无统计学意义(P=0.072),且一致性较好(kappa=0.865)。
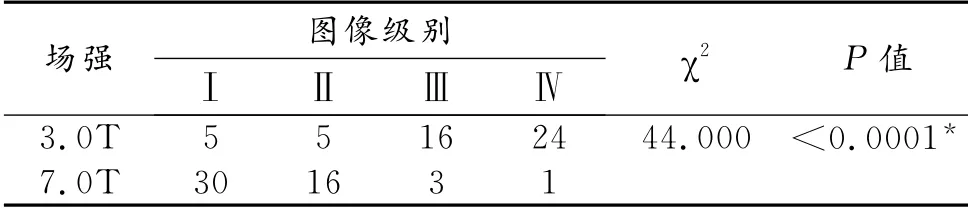
表1 50例受试者两种SWI幅度图分级比较 (例)
2.3.0T 与7.0T 下各核团边界大小的比较
由于3.0T 和7.0T 呈现核团范围的清晰度不同,为确认是否影响铁含量测量,笔者先比较了所测核团分别在不同场强下的同层最大面积(所有扫描的定位中心、层厚及层间距一致,可以进行比较,双侧取平均值,图2)。结果显示,7.0T 下可辨识的ROI范围较3.0T 下的略大,不同场强的各核团ROI范围差异有统计学意义(P<0.05,表2)。
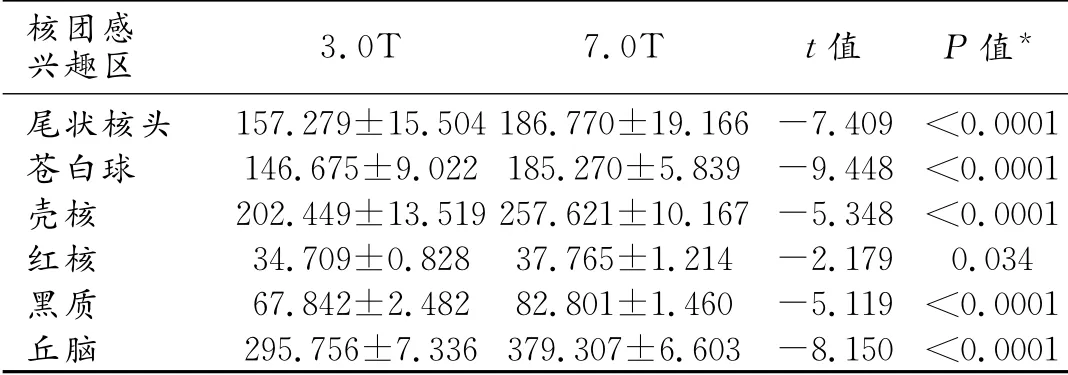
表2 50例受试者两种SWI幅度图核团兴趣区面积比较 (mm2)
3.3.0T 与7.0T 下受试者各核团铁含量比较

图1 3.0T 与7.0T 幅度图的比较,信噪比及对比噪声比方面,7.0T 图像明显优于3.0T。a)基底节层面3.0T 图像,苍白球和壳核的分界(红色箭头)可见,但不完全;b)基底节层面7.0T 图像,苍白球和壳核的分界较为清晰(红色箭头);c)红核黑质层面3.0T 图像,红色五星区可见信号较低的黑质致密带,红色三角区为网状带,红核与黑质间的中间区域显示欠清晰;d)红核黑质层面7.0T 图像,红色五星区可见信号较低的红核血管区,红色三角区为无血管区;红核黑质间的中间区域显示较3.0T 图像为佳,红色箭头指示为红核的包膜。

图2 3.0T 与7.0T 下SWI幅度图上各核团ROI的选取。a~f)分别为3.0T 下尾状核头、苍白球、壳核、红核、黑质及丘脑的ROI;g~l)则为对应核团7.0T 下ROI的选取。
分别在3.0T 和7.0T 相位图上选取ROI(图2),比较各核团铁含量,除苍白球外,其余核团3.0T 和7.0T比较,铁含量测量值差异均有统计学意义(P<0.05,表3)。
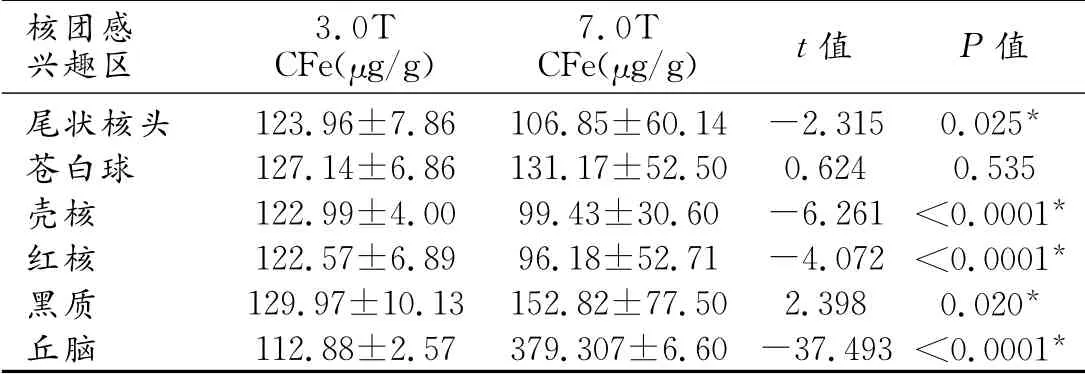
表3 50例受试者两种SWI相位图核团ROI铁含量比较
讨 论
1.脑铁的分布、代谢
脑内微量的铁是维持正常神经功能不可缺少的重要元素,但过量则有害。脑铁主要以血色素铁和非血色素铁两种方式存在,主要为铁蛋白和含铁血黄素。铁在脑内分布不均,以锥体外系最多,其次是灰质,白质最少。Harder等[2]观察到苍白球内的铁呈“波浪”状分布。铁质在众多神经病变的进展过程中起重要作用[3]。铁诱导的氧化应激是神经元死亡的常见途径,早期发现脑内铁的异常积聚可为临床的及时治疗提供信息。测定脑内非血色素铁的含量不仅可更好地理解疾病进程,而且可判断预后[4-5],这是当今神经退行性病变的研究热点,而且在很长一段时期内仍将是重点研究方向。
2.脑铁MR 测量
如何在活体内更准确测量核团铁含量,这一直是研究者关注的问题。以往的研究认为,脑深部灰质核团T2WI信号减低提示非血色素铁含量相对高,可以用测定横向弛豫率R2(1/T2)值或R2*(1/T2*)值来评价脑铁含量,R2值或R2*值均与脑铁浓度呈线性关系[6]。但横向弛豫率受诸多因素影响,如局部水含量,因此仅能对铁含量进行半定量分析。SWI的滤过相位图不但能敏感地显示铁沉积,更能提供定量信息。Hopp等[7]在1.5T 上应用SWI定量分析铁含量,并与X 线荧光染色的结果进行对比,发现两者具有很好的相关性。Haacke 等[8]研究发现,与R2 或R2*值相比,SWI相位值的变化对脑铁含量测定的敏感性和信噪比(signal noise ratio,SNR)均增加,并得出公式Δφ=-γgΔχB0TE,(Δφ 为相位值的变化,γ为磁旋比,g为几何因子,Δχ 为被测组织间的磁敏感差异,B0为主磁场强度,TE 为回波时间)。本研究在7.0T 及3.0T MR 上利用SWI对脑铁进行定量分析,所有病例均排除了脑实质钙化,特别是兴趣区存在钙化的病例。因为钙化本身会影响铁含量相位值的测定。本研究结果显示黑质含铁量较高,而丘脑在3.0T及7.0T 下所得结果相差较大,7.0T 所测丘脑含铁量较高,该结果与既往研究[2,6]结论差异较大。7.0T 下丘脑所测值明显高于3.0T,而其他核团的测量值相差不大,因相位值与铁含量转化过程中已考虑不同场强的磁化率因素,故此项非其主要因素;其次,丘脑的范围较其他核团大,在幅度图上显示边界不如其他核团清晰。若ROI选取范围偏小,则所测丘脑的铁含量应较低;若ROI选取范围偏大,其结果应更低,因为周围的白质区会使测量值减小,而本研究所得结果丘脑铁含量在7.0T 下增高,有待进一步探讨。
3.7.0T 的优势与不足
在高场中T2驰豫时间的缩短比低场更显著,因此局部的相位变化加大,SWI对铁的检出越灵敏[9],而这种效应仅与铁蛋白有关。利用这一优势,7.0T SWI便成为目前检测矿物质沉积的较为敏感的方法。Hommond 等[10]利 用7.0T研究发现多发性硬化(multiple sclerosis,MS)斑块内存在少量新鲜出血和含铁血黄素。7.0TSWI较3.0T 有更高的空间分辨力,达到微米级(μm)[11],不仅可以定量测量灰质核团内的铁,还可以定量测量皮层内少量的铁[10]。通过SWI技术对帕金森病等慢性神经系统病变患者的苍白球、红核、黑质、壳核等进行铁含量定量分析,有助于显示病变的发生和发展,指导临床治疗;脑铁含量在一定程度上还反映了脑组织的能量代谢,可以用于分析大脑老化的过程。磁敏感性增加是7.0T 的一个优势,但外磁场越大,磁化率伪影越明显,SWI所形成的对比也是场强依赖性的,磁敏感效应的增强必然伴随信号强度的丢失,特别是靠近颅底乳突气房处,常常导致该部位结构变形,成为影响图像质量的主要问题。
目前,7.0T 成像经验几乎只局限于头部和肢体。7.0T显著的优势有:SNR 增加、T1弛豫时间的有利延长、磁敏感性增加以及很高的组织分辨力。7.0T MRI还可作为脑功能的研发工具,将功能信息与形态学信息整合进入分子影像学的新领域。而SWI作为一种无创性的检测手段,可以在较长时间内监测脑内铁含量的变化,为临床诊疗提供依据。
[1] Boeckh-Behrens T,Lutz J,Lummel N,et al.Susceptibility-weighted angiography(SWAN)of cerebral veins and arteries compared to TOF-MRA[J].Eur J Radiol,2012,81(6):1238-1245.
[2] Harder SL,Hopp KM,Ward H,et al.Mineralization of the deep gray matter with age:a retrospective review with susceptibilityweighted MR imaging[J].AJNR,2008,29(1):176-183.
[3] Stankiewicz J,Panter SS,Neema M,et al.Iron in chronic brain disorders imaging and neurotherapeutic implications[J].Neurotherapeutics,2007,4(3):371-386.
[4] Ogg RJ,Langston JW,Haacke EM,et al.The correlateon between phase shifts in gradient-echo MR images and regional brain iron concentration[J].J Magn Reson Imaging,1999,17(8):1141-1148.
[5] Haacke EM,Cheng NY,House MJ,et al.Imaging iron stores in the brain using magnetic resonance imaging[J].J Magn Reson Imaging,2005,23(1):1-25.
[6] Schenck JF.Magnetic resonance imaging of brain iron[J].J Neurol Sci,2003,207(1):99-102.
[7] Hopp K,Popescu BF,McCrear P,et al.Brain iron detected by SWI high pass filtered phase calibrated with synchrotron X-ray fluorescence[J].J Magn Reson Imaging,2010,31(6):1346-1354.
[8] Haacke EM,Ayaz M,Khan A.Establishing a baseline phase behavior in magnetic imaging to determine normal vs abnormall iron content in the brain[J].J Magn Reson Imaging,2007,26(2):256-264.
[9] Pinker K,Stavrou I,Szomolanyi P,et al.Improved preoperative evaluateon of cerebral cavernomas by high-field,high-resolution susceptibility-weighted magnetic resonance imaging at 3Tesla:compareison with standard(1.5T)magnetic resonance imaging and correlateon with histopathologyical findings prelim results[J].Invest Radiology,2007,42(6):346-351.
[10] Hammond KE,Lupo JM,Xu D,et al.Develpment of a robust method for generating 7.0T multichannel phase images of thd brain with application to normal volunteers and patients with neurological diseases[J].Neuroimage,2008,39(4):1682-1692.
[11] Marques JP,Zwaag WV,Granziera C,et al.Cerebellar cortical layers:in vivo visualization with structural high-field-strength MR imaging[J].Radiology,2010,254(3):942-948.

