泰山白花丹参提取物体外对氧化应激损伤内皮祖细胞作用的研究
焦 鹏,杨娜娜,崔英杰,秦树存
(泰山医学院动脉粥样硬化研究所,山东泰安 271000)
内皮祖细胞参与的内皮系统损伤的修复是动脉粥样硬化的始动因素和重要环节[1-2]。氧化应激和炎症是动脉粥样硬化发展的两个关键成分,同时活性氧是动脉粥样硬化炎症发生的始动因素[3]。前期实验证实,泰山白花丹参提取物对H2O2损伤后内皮祖细胞有显著保护作用,但其具体机制尚不是很明确。本实验拟从氧化应激和炎症方面探讨泰山白花丹参提取物对内皮祖细胞的保护作用。
1 材料
1.1 细胞 内皮祖细胞的培养和鉴定本课题组已成功完成[4-5],在本院生命科学研究中心细胞培养间常规传代培养。
1.2 试剂与药品 白花丹参(产自泰山)由山东大学博士生导师夏作理教授鉴定,白花丹参提取物的制备参见参考文献[4-5];EBM—2培养基购自Lonza公司;人淋巴细胞分离液购自天津TBD公司;DiI-Ac-LDL,FITC-UEA-I购自BTI公司;人纤维连接蛋白,PE-VEGFR-2,PE-CyTM5-CD34购自美国BD公司;超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所;人用IL-6 ELISA试剂盒和人用TNF-α ELISA试剂盒均购自深圳市达科为生物技术有限公司;二氯荧光素二乙酯(DCFH-DA)购自Sigma。
1.3 仪器 BD FACScalibur流式细胞仪,美国 BD公司;LG 16—W高速微量离心机,北京医用离心机厂;BIO—RAD Model 550酶标仪,日本;MCO—15AC CO2培养箱,日本三洋株式会社。
2 方法
2.1 实验分组 内皮祖细胞原代培养7 d后,以0.25%胰酶将各孔细胞消化制成细胞悬液,以同等数量细胞接种随机分为正常对照组、H2O2损伤组(0.001%H2O2)、白花丹参+H2O2组(白花丹参质量浓度分别为0.2、0.4、0.8 g/L,每组同时加0.001%H2O2),培养24 h后,进行各项指标检测。
2.2 ELISA方法检测培养液中白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)的水平 分组处理细胞后收集培养液上清,离心15 min,取上清,按照试剂盒说明书中实验步骤操作,吸光度值于酶标仪450 nm波长处测定,根据预实验所作的标准曲线计算样本的浓度。
2.3 黄嘌呤氧化酶法测定总超氧化物歧化酶(SOD)活力收集各组细胞培养液上清,按试剂盒说明书加好各试剂后,混匀,室温放置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,测各组吸光度值,实验每组重复测一次。根据吸光度值计算总SOD活力。
2.4 细胞活性氧水平检测 将细胞以相同密度接种于6孔培养板,过夜,按不同分组处理完后,吸弃培养液加入1∶1000用无血清培养液稀释的 DCFH-DA(终浓度为10μmol/L),37℃培养箱内孵育30 min。PBS洗涤3次后,胰酶消化,收集细胞,流式细胞仪488 nm激发下检测FL1通道荧光。
3 结果
3.1 培养液中白细胞介素-6(IL-6)和肿瘤坏死因子α(TNF-α)的检测 与正常对照组相比,过氧化氢损伤后显著升高了内皮祖细胞上清液的IL-6和TNF-α质量浓度(P<0.01),白花丹参提取物干预后,与单纯损伤组相比降低了IL-6和TNF-α,各质量浓度白花丹参组与单纯损伤组相比有显著性差异(表1)。
表1 培养上清中IL-6和TNF-α的质量浓度变化()

表1 培养上清中IL-6和TNF-α的质量浓度变化()
注:与正常对照组比较,*P<0.01;与H2O2损伤组比较 ,#P<0.01(图1同)
组 别 IL-6/(ng·L-1) TNF-α/(ng·L-1)60.43±12.89 49.18±14.14 H2O2损伤组 189.56±13.59* 232.34±25.89*0.2g/L白花丹参+H2O2 70.65±9.18# 49.45±10.09#0.4 g/L白花丹参+H2O2 51.19±10.24# 33.2±8.48#0.8 g/L白花丹参+H2O2 40.14±10.67# 38.8±6.98正常对照组#
3.2 白花丹参对氧化损伤后细胞总超氧化物歧化酶(SOD)活力的影响 0.001%H2O2作用内皮祖细胞后,总超氧化物歧化酶(SOD)活力明显下降,而在0.2、0.4和0.8 g/L白花丹参共同作用下,SOD活性比损伤组有了显著的改善(图1)。
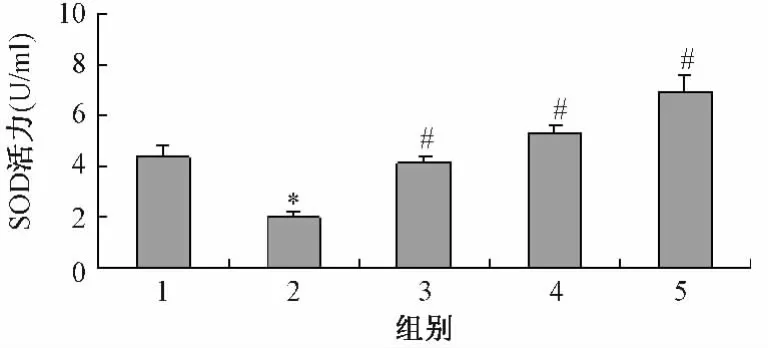
图1 各组别SOD活力测定
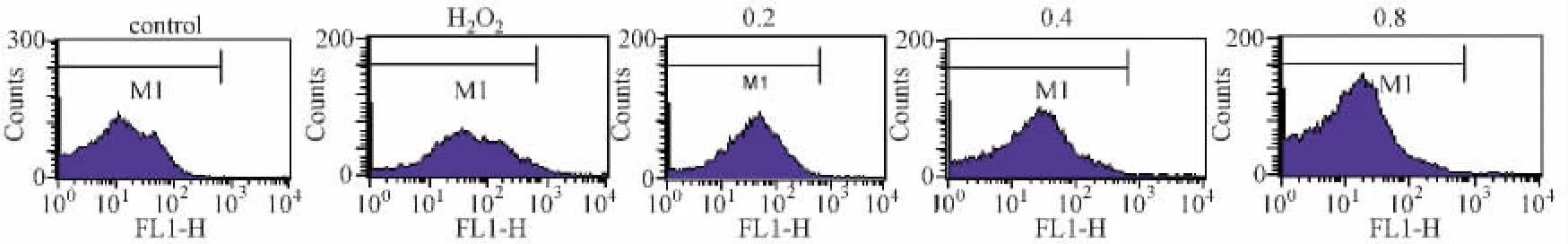
图2 各组别活性氧水平测定
3.3 各组细胞内活性氧水平变化 流式检测结果表明损伤组细胞内FL1平均荧光强度明显高于对照组,说明过氧化氢损伤后细胞内活性氧的产生明显升高,0.2 g/L白花丹参组与过氧化氢损伤组比较差别不大,而0.4 g/L和0.8 g/L白花丹参质量浓度组活性氧水平与过氧化氢损伤组比较明显降低(P<0.05),见图2。
4 讨论
目前,世界范围内心血管疾病的发病率和死亡率都在逐年上升,动脉粥样硬化(Atherosclerosis,AS)是主要的病理基础[6-7]。AS是多因素所致病变,主要有血管内皮功能障碍、炎症、氧化应激等[8]。众所周知,AS属慢性炎症增殖性疾病,炎症反应贯穿于动脉粥样硬化的全过程,细胞因子及氧化应激产物在炎症反应中起重要作用,内皮细胞的损伤及功能紊乱是AS发生的始动环节,并贯穿于AS进展的全过程,因此靶向修复血管内皮,纠正内皮细胞功能紊乱,可有效抑制AS的形成和发展[9-12]。由于成熟内皮细胞是终末分化细胞,修复受损内皮的能力有限。近年来诸多研究表明血管内皮细胞外的干细胞可修复血管大面积创伤,因而提出了内皮祖细胞(endothelial progenitor cells,EPCs)修复假说[13-14]。由于在一些疾病状态下,EPC的数量和功能都有所降低,那么是否可以人为地恢复和增强病理状态下内皮祖细胞的生物学活性和功能就成为目前研究的热点。
超氧化物歧化酶(SOD)是需氧生物体内的一种内生性氧自由基清除剂,对机体的氧化与抗氧化平衡起着至关重要的作用。SOD活力水平是公认的可间接反映机体内自由基水平的重要指标之一,它与自由基水平呈负相关。而MDA的量常常可反映脂质过氧化的程度,间接的反映出细胞损伤的程度。活性氧具有较强的氧化作用,在有机体中少量活性氧的存在并不会造成明显的氧化损伤,目前研究表明细胞内的活性氧参与了凋亡的过程。当细胞受到一些因素刺激时,通过细胞膜上NADPH氧化酶系统作用产生大量活性氧。过多的活性氧会引起DNA损伤、脂质过氧化而触发细胞发生凋亡[15]。目前普遍认为动脉粥样硬化是一种慢性炎症性疾病,IL-6、TNF-α两者在炎症反应急性相中联系紧密,IL-6是预测心血管事件的独立危险因子[16]。
本课题组前期实验证实,白花丹参能改善H2O2引起的内皮祖细胞增殖抑制和凋亡增加的现象。本实验主要对这一现象的机理进行了研究,发现过氧化氢刺激内皮祖细胞后,炎症因子IL-6和TNF-α的分泌有显著性升高,SOD活力明显下降而且细胞内活性氧明显增加,而白花丹参干预后,这些症状都有明显改善,说明白花丹参提取物对内皮祖细胞氧化损伤影响的机制可能是提高了该细胞的抗氧化酶活性、降低了炎症因子的释放并且清除了细胞内过多的活性氧。
[1]周晓峰,王 佐.内皮祖细胞在动脉粥样硬化进程中的作用[J].中国动脉硬化杂志,2007,15(12):940-942.
[2]张美华,张 伟,盖 凌,等.血管内皮祖细胞在治疗动脉粥样硬化中的作用[J].中国心血管杂志,2012,17(1):73-75.
[3]陈 瑗,周 玫.氧化应激-炎症在动脉粥样硬化发生发展中作用研究的新进展[J].中国动脉硬化杂志,2008,16(10):757-762.
[4]焦 鹏,常 起,陈 彬,等.泰山白花丹参提取物对H2O2诱导的人脐血内皮祖细胞损伤的保护作用及机制[J].中国中药杂志,2011,36(13):1830-1832.
[5]焦 鹏,常 起,陈 彬,等.泰山白花丹参提取物对人脐血内皮祖细胞增殖、黏附及分泌NO的影响[J].中华中医药杂志,2011,26(11):2687-2689.
[6]吴 雷,童志平,唐 康,等.动脉粥样硬化的药物治疗的研究进展[J].热带医学杂志,2008,8(9):987-989.
[7]陈 鹏.动脉粥样硬化药物治疗的研究进展[J].医学信息,2011,24(8):5040-5041.
[8]彭琪琦,罗兴林.氧化应激在动脉粥样硬化中的作用及研究现状[J].泸州医学院学报,2010,33(6):710-712.
[9]周凯章,林辉丽.血红素氧化酶-1对小鼠动脉粥样硬化斑块抑制作用的研究[J].福建医药杂志,2008,30(1):89-90.
[10]秦 瑾,刘正湘.炎症与动脉粥样硬化[J].实用心脑肺血管病杂志,2003,11(2):105-108.
[11]崔忠生,邸科前,马焕云.哈巴苷及哈巴俄苷对肾上腺素损伤血管内皮细胞的保护作用[J].山东医药,2009,49(25):60-61.
[12]张 宁,尹美娜,李 聪,等.炎症与动脉粥样硬化[J].临床荟萃,2010,25(10):918-921.
[13]O’Neill T J,Wamhoff B R,Owens G K,et al.Mobilization of bone marrow-derived cells enhances the angiogenic response to hypoxia without transdifferentiation into endothelial cells[J].Circ Res,2005,97(10):1027-1035.
[14]Zentilin L,Tafuro S,Zacchigna S,et al.Bone marrow mononuclear cells are recruited to the sites of VEGF-induced neovascularization but are not incorporated into the newly formed vessels[J].Blood,2006,107(9):3546-3554.
[15]任振义,白春学,金一尊,等.多烯紫杉醇诱导SPC-A1肺癌细胞凋亡与活性氧之间的关系[J].中国癌症杂志,2003,13(4):342-344.
[16]丛也彤,亓 波,金龙哲,等.64排螺旋 CT检测冠心病患者冠状动脉斑块分型的分布特点与其血清 IL-6、TNF-A含量的相关性[J].中国老年学杂志,2009,29(19):2446-2448.

