银屑病免疫生物学研究进展
侯淑萍
(天津医科大学总医院,天津 300052)
银屑病是一种慢性特发性皮肤疾病,全世界发病率约为2%[1-2]。这种疾病临床上分为几型,最常见的是斑块型银屑病,占所有银屑病患者中的80%。生理上的痛苦和心理上的压力使银屑病患者的生活质量受到了严重的影响[3]。近年来,人们一直致力于银屑病致病机制的研究,尽管尚未完全明确,但是有一个观点已经被大家普遍接受:银屑病是慢性炎症性疾病,细胞因子水平的改变导致免疫系统失调,在皮肤中形成一个持续的前炎症信号,导致银屑病皮损的形成。
细胞因子作为细胞内的信号蛋白,在免疫系统和炎症反应的调节中起到了重要的作用。细胞通过操纵细胞内的信号通路对外界的压力或刺激产生反应,引起激酶激活、蛋白磷酸化以及DNA结合蛋白激活等来影响基因的表达。细胞因子结合到细胞表面的受体后,触发转录水平的改变,平衡细胞生长、分化以及生存等的活动。RNA干扰和微小RNA(microRNA)调控是细胞因子参与炎症反应调节机制的新发现。非编码小RNA是基因转录后调控途径的重要因素,其中最典型的就是microRNA(miRNA)。miRNA通过影响mRNA的翻译或降解,在细胞因子调控异常疾病的发生发展中起到了重要的作用[4]。
1 细胞因子在银屑病发病机制中的作用
银屑病的发生是由浸润到皮肤中的免疫细胞和角质形成细胞相互作用的结果,见图1。银屑病皮损内的炎症细胞有树突状细胞、巨噬细胞、细胞毒性T淋巴细胞和辅助性T淋巴细胞。皮肤中的T淋巴细胞和抗原呈递细胞被外界的刺激因素激活,分泌包括TNF-α、IL-23等在内的多种细胞因子。在这些细胞因子的刺激下,幼稚CD4+T淋巴细胞分化成5种亚型的细胞包括Th1,Th2,Th 17,Th 22,和Treg。其中Th1作用于细胞内病原菌的清除;Th2激发产生针对细胞外病原菌的防御反应;Th17和Th22辅助Th1和Th2产生炎症反应;Treg细胞分泌具有免疫抑制功能的细胞因子来限制免疫反应的发展[5]。每一亚型T淋巴细胞及巨噬细胞又各自产生一套细胞因子,如图1中所示[4],这些细胞因子形成一个多层面的刺激,促使表皮中的角质形成细胞自身分泌多种细胞因子,这些细胞因子通过改变角质形成细胞的生长、分化以及血管的生成而引起银屑病的皮损。许多研究显示银屑病属于Th1/Th17一类的疾病,Th1和Th17分泌的细胞因子在疾病的发展过程中占主要地位。
Sabat[6]等人提出了关于银屑病发病过程的模型,该模型包括3期:敏感期,沉默干预期以及效应期。发病从抗原递呈、处理以及T细胞的活化开始,CD4+和CD8+T淋巴细胞以及其他的免疫细胞接收到信号后移行至病变处皮肤,被进一步激活分化,分泌多种细胞因子参与炎症反应。角质形成细胞一方面通过对细胞因子的反应,另一方面通过自身分泌的细胞因子也参与了炎症反应,引起角质形成细胞增殖功能增强,分化功能失调。另外,角质形成细胞受刺激后还可产生抗菌多肽,后者具有化学趋化及调节免疫细胞的功能[7],进一步加重炎症反应。
2 细胞因子药靶在银屑病中的发展
银屑病的治疗主要包括外用药物,光疗和全身疗法。外用药物适用于轻度的银屑病,包括皮质类固醇、角质剥脱剂、外用维甲酸以及维生素D的衍生物。光疗和系统用药主要适用于中至重度的银屑病。常见的系统用药包括环孢素A、甲氨蝶呤、口服维甲酸和补骨脂素,主要作用是调节角质形成细胞的增殖、抗T淋巴细胞的活性、或者抵抗与银屑病发病相关的一些细胞因子。生物治疗是银屑病治疗领域的一个新兴事物,目前主要有重组的受体或拮抗T淋巴细胞功能及细胞因子的抗体。
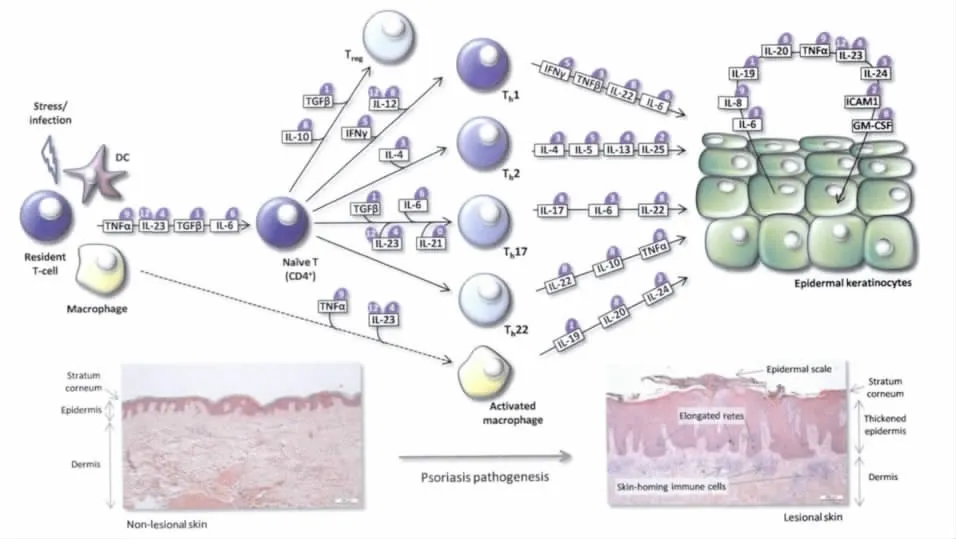
图1 银屑病皮损中的细胞因子
在细胞因子介导的细胞内信号网络中,不同的细胞因子在疾病的不同阶段发挥作用。TNF-α在激活原始T淋巴细胞中扮演了重要的角色,而IFN-γ、IL-12、IL-4、L-6、TGF-β 和 IL-23则是辅助性 T淋巴细胞分化的主要介导因子。来源于辅助性T淋巴细胞的 IFN-γ、IL-6、IL-17、IL-22 和 TNF-α 以及由树突状细胞和巨噬细胞来源的细胞因子又会刺激角质形成细胞产生IL-6、IL-8、IL-20和IL-23等细胞因子。理论上,所有参与致病的细胞因子都可成为治疗的药靶。TNF-α抑制物英夫利昔单抗,依那西普和阿达木单抗在动物实验以及病人身上已经获得了成功,经证实对类风湿关节炎,克隆氏病和溃疡性结肠炎有治疗价值[8]。最近,这些药物已被确立为治疗严重银屑病的候选药物了[9-10]。
在银屑病的皮损中,IL-12和IL-23表达都增高[11]。IL-12在抗原呈递细胞被激活后开始产生,它以旁分泌的形式刺激自然杀伤细胞产生IFN-γ并驱使原始T细胞分化成为Th1细胞。有学者认为,IL-12是促进Th1细胞因子产生的重要因素;IL-12还可增强抗原呈递细胞的功能,促进IFN-γ的产生。IL-23可能有助于Th17的生存和增殖。目前治疗银屑病的方法,包括窄谱UVB,依那西普以及阿发赛特(T细胞活化的拮抗剂)都可以降低IL-23的水平。针对IL-12和IL-23共有的p40亚单位制造的单克隆抗体Ustekinumab,可经皮下注射给药,已经获得批准。三期临床试验显示,它似乎比TNF-α抑制剂依那西普更加有效。最近,有研究表明系统使用抗IL-20的单克隆抗体可以阻断IL-20信号系统,清除SCID小鼠身上的银屑病皮损[12]。
尽管针对细胞因子的生物制剂取得了成功,但其安全性及长期的疗效仍有待于进一步炎症。病人对生物制剂的反应可能会不同,有些病人可能会出现反复。此外,这些细胞因子抑制剂的使用会抑制全身的免疫反应,从而导致条件致病菌的感染。因此,需要更多关于这些制剂长期安全的证据。
3 miRNA在银屑病发病中的作用
miRNA 是一群小的非编码的RNA,在RNA聚合酶的作用下由非编码区转录而来,长度约为300~1000个碱基,称为pri-miRNA。pri-miRNA在细胞核内被RnaseⅢ核酸酶Drosha加工成约70~90 nt的发夹状pre-miRNA。pre-miRNA经由RanGTP依赖的转运蛋白-5输出到胞浆中去。在胞浆中,它们被另一种核糖核酸内切酶Dicer所识别并加工,丢掉茎环结构,剩下一份成熟的长约21个核苷酸的双链miRNA。该双链miRNA分子被解链,单链的miRNA进入一个核糖蛋白复合体miRNP(RISC),通过与靶基因的3'UTP区互补配对,指导miRNP复合体对靶基因mRNA进行切割或者翻译抑制。目前在人类中已经发现了700多个miRNA。
Sonkoly等人[13]分析了银屑病皮损中的miRNA的表达谱。他们发现miR-203,miR-146a及miR-21在银屑病皮损中表达增高,miR-125b表达降低。通过对miR-146a基因3’UTR端荧光素酶表达活性测定,推测出miR-146a潜在靶基因可能是肿瘤坏死因子受体相关因子(tumor necrosis factor recptorassociated factor,TRAF)6和白介素1受体相关激酶(interleukin-1 receptor-associated kinase 1,IRAK1),这两个因子是TNF-α信号系统的调节因子。miR-146a可抑制TRAF6和IRAK1两者的表达,进而减弱下游信号传导,最终抑制IL-1、TNF-α等炎症介质的产生。因此miR-146a可能作为负反馈调节机制的效应而参与皮肤炎症反应中TNF-α信号传导通路的调控[14]。MiR-125b在银屑病中低表达。MiR-125b参与TNF-α通路的负反馈调节,它通过攻击TNF-α的mRNA来抑制TNF-α的产生[15]。根据这些机制,这两者似乎都不能作为治疗银屑病的靶目标,但是通过导入人工合成的miRNAs来增加它们的水平或许可以起到治疗的作用。MiR-203是一个皮肤特异性的miRNA,主要由角质形成细胞表达。它在银屑病皮损中表达上调。计算机分析显示miR-203通过一个保守的10个核苷酸序列攻击细胞因子信号3抑制剂(suppressor of cytokine signaling 3,SOCS-3)。SOCS-3作为信号传导及转录激活因子3(signal tranducer and activator and transcription,STAT3)通路的负性调控因子,其通过抑制STAT3的活化,参与炎症反应调控及角质形成细胞的增殖和分化。在银屑病皮损中,miR-203和SOCS-3表达是互补的,同正常皮肤相比,miR-203上调而SOCS-3则下调,而且STAT3在银屑病皮损中是被活化的。因此,银屑病中高表达的miR-203可能通过抑制SOCS-3的表达,从而活化STAT3通路,引发炎症细胞的浸润,导致银屑病样皮损的形成[16]。
新的一项研究表明miRNA-31在银屑病皮损中高表达,通过攻击丝氨酸/苏氨酸激酶40来调节角质形成细胞肿的细胞因子和趋化因子的产生,促进炎症反应[17]。
4 小RNA干扰在银屑病治疗中的的进展
我们已经看到细胞因子是治疗炎症性疾病的药靶,比如细胞因子的抑制剂可以改善类风湿性关节炎及银屑病。以小RNA为基础的药物会不会作为一种新的治疗手段来调节皮肤炎症反应中的细胞因子呢?
很多实验证实双链RNA(double strand RNA,dsRNA)可以作为一种治疗药物,部分药物已经进入了一期或二期临床试验[18]。小干扰RNA(small interfere RNA,siRNA)长约21个核苷酸序列,由前miRNA或外源的双链RNA在细胞浆内被Dicer识别降解而成。siRNA技术是一种新近发现的诱导细胞内特定基因沉默的技术。它通过向细胞内导入长度为21~23的核苷酸序列,高度特异性地降解同源mRNA序列,从而有效地阻止相应蛋白的表达。RNA干扰不仅可以作为治疗手段,还可用于基因功能的研究。
siRNA技术也被引入了银屑病的治疗理念中。TNF-α是银屑病发病机制中的重要细胞因子之一,它由抗原呈递细胞和角质形成细胞产生。考虑到TNF-α在银屑病中的重要性,研究者们尝试了针对TNF-α的局部RNA干扰对银屑病的治疗作用[4]。他们分离出了一个针对TNF-α的shRNA的变异体,shRNA可在胞浆内被加工成siRNA。体外细胞培养中,该shRNA变异体稳定性地诱导TNF-α的下调表达。利用假VSV-G慢病毒载体通过皮下注射的方式将这个shRNA导入到SCID小鼠的银屑病皮损中。皮损评估发现:皮损处TNF-α mRNA的水平明显下降,证明干扰有效;银屑病皮损的临床表现和病理学改变都得到了明显的改善,改善的程度相当于系统使用3周的环孢素A;不仅如此,抗TNF-α的shRNA治疗处的皮肤较未治疗处明显变薄。这些结果表明针对TNF-α mRNA的siRNA技术可用于银屑病的治疗。
5 结语和展望
银屑病是皮肤病领域的一种多发性疾病,针对银屑病的治疗药物很多,但这些药物的安全性和长期疗效却不令人满意。临床上需要更加安全有效的药物。越来越多的研究表明细胞因子在银屑病致病机制中扮演了重要的角色,根据这个发现,人们开始尝试新型治疗方法的研发,包括针对细胞因子的拮抗剂以及针对编码细胞因子的mRNA的治疗手段等,小干扰RNA技术就是其中之一。尽管取得了比较满意的效果,但是这些药物的长期安全性及疗效仍待于进一步观察。科研的不断发展给寻找新型治疗靶点提供了机会,miRNA在银屑病致病机制中的作用越来越受到肯定,如果最终证实miRNA在银屑病中的作用是至关重要的,那么拮抗miRNA功能的小干扰RNA可能会成为新一代的治疗银屑病的药物。
[1]Griffiths CE,Barker JN.Pathogenesis and clinical features of psoriasis[J].Lancet,2007,370:263-271.
[2]Kurd SK,Gelfand JM.The prevalence of previously diagnosed and undiagnosed psoriasis in US adults:results from NHANES 2003-2004[J].J Am Acad Dermatol,2009,60:218-224.
[3]Hong J,Koo B,Koo J.The psychosocial and occupational impact of chronic skin disease[J].Dermatol Ther,2008,21:54-59.
[4]Bak RO,Mikkelsen JG.Regulation of cytokines by small RNAs during skin inflammation[J].J Biomed Sci,2010,17:53.
[5]Paust S,Cantor H.Regulatory T cells and autoimmune disease[J].Immunol Rev,2005,204:195-207.
[6]Sabat R,Philipp S,Hoflich C,et al.Immunopathogenesis of psoriasis[J].Exp Dermatol,2007,16:779-798.
[7]Buchau AS,Gallo RL.Innate immunity and antimicrobial defense systems in psoriasis[J].Clin Dermatol,2007,25:616-624.
[8]Lecluse LL,Piskin G,Mekkes JR,et al.Review and expert opinion on prevention and treatment of infliximab-related infusion reactions[J].Br J Dermatol,2008,159:527-536.
[9]Mossner R,Reich K.Management of severe psoriasis with TNF antagonists.Adalimumab,etanercept and infliximab[J].Curr Probl Dermatol,2009,38:107-136.
[10]Sobell JM,Kalb RE,Weinberg JM.Management of moderate to severe plaque psoriasis (part I):clinical update on antitumor necrosis factor agents[J].J Drugs Dermatol,2009,8:147-154.
[11]Yawalkar N,Tscharner GG,Hunger RE,et al.Increased expression of IL-12p70 and IL-23 by multiple dendritic cell and macrophage subsets in plaque psoriasis[J].J Dermatol Sci,2009,54:99-105.
[12]Stenderup K,Rosada C,Worsaae A,et al.Interleukin-20 plays a critical role in maintenance and development of psoriasis in the human xenograft transplantation model[J].Br J Dermatol,2009,160:284-296.
[13]Sonkoly E,Stahle M,Pivarcsi A.MicroRNAs:novel regulators in skin inflammation[J].Clin Exp Dermatol,2008,33:312-315.
[14]Sheedy FJ,O’Neill LA.Adding fuel to fire:microRNAs as a new class of mediators of inflammation[J].Ann Rheum Dis,2008,67:50-55.
[15]Tili E,Michaille JJ,Cimino A,et al.Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock[J].J Immunol,2007,179:5082-5089.
[16]彭立新,李新宇.microRNA与炎症性皮肤病[J].中国麻风皮肤病杂志,2010,26(5):339-341.
[17]Xu N,Meisgen F,Butler LM,et al.MicroRNA-31 Is overexpressed in psoriasis and modulates inflammatory cytokine and chemokine production in keratinocytes via targeting serine/threonine kinase 40[J].J Immunol,2013,190:678-688.
[18]Tiemann K,Rossi JJ.RNAi-based therapeutics-current status,challenges and prospects[J].EMBO Mol Med,2009,1:142-151.

