跳跃训练对模拟失重大鼠骨密度和骨代谢指标的影响
韩相伟
Shandong Youth University of Political Science,Jinan 250103,Shandong,China
宇航员长时间处于太空微重力环境下可对机体的骨骼系统产生危害,来自俄罗斯和国际太空工作站的数据显示,长期处于太空微重力环境的宇航员脊椎骨骨密度的平均下降速度为每月1.06%,髋骨骨密度的平均下降速度为每月1.0% ~1.6%[1]。大鼠尾部悬吊使后肢模拟失重模型已被广泛应用于因长期废用而导致的骨疾病的研究中。如Ju等人的研究显示[2],大鼠尾部悬吊使后肢模拟失重可导致大鼠股骨松质骨的骨小梁产生退行性变化,而且这种退行性变化在大鼠尾部悬吊结束恢复自由活动后仍然存在,同时该研究也显示,大鼠在尾部悬吊结束恢复自由活动后进行跳跃训练可以恢复大鼠松质骨骨小梁结构的完整性。
目前,关于运动对于骨健康的促进作用得到了运动生理学界的一致肯定。在宇航员太空飞行期间以及在太空飞行任务结束回到正常环境后,运动均可作为减少宇航员骨质流失的一种有效干预措施,另外对于因疾病长期卧床而造成废用性骨质疏松的病人,运动也是一项效果显著的干预措施[3]。然而,到目前为止,还没有关于动物在尾部悬吊使后肢模拟失重期间进行跳跃练习的研究报道。以往的多项研究从不同角度揭示肢体废用期间机械负荷的成骨作用,如Rubin等人的研究显示[4],低强度高频率的机械负荷的成骨效应较强,他们的研究发现,每天10分钟的机械刺激对于保持干骺端的骨量和减缓胫骨近端的骨丢失是十分有效的。再如Swift等人最近的研究发现[5],在肢体废用期间,每两天一次高强度的模拟抗阻刺激可阻止松质骨骨量的丢失和保持骨组织的材料力学性能。
然而,这些研究均是借助机械应力器械对肢体进行力学刺激,这和真实的运动条件下机体所受的应力刺激有着较大的差别,对骨组织产生的成骨效应也不尽相同。到目前为止,只有1项关于真正的体力活动(抗阻训练)对于尾部悬吊模拟后肢失重期间肌肉萎缩和骨密度丢失影响的研究[6],然而其训练方式是和跳跃训练完全不同的抗阻训练,因其每次训练用时较长而减少了尾部悬吊的时间,可能降低了尾部悬吊模拟后肢失重的效果,故其研究存在一定的局限性。本研究通过大鼠尾部悬吊模拟后肢失重模型,研究在模拟失重期间进行短时间的跳跃训练对大鼠骨密度和骨代谢指标的影响,为预防长期处于太空失重环境下的宇航员和因疾病而长期卧床的病人废用性骨质疏松症的发生提供理论依据和数据支持。
1 材料与方法
1.1 实验动物与分组
7周龄雄性Wistar大鼠24只,在标准的实验室环境下分笼饲养,环境温度为(22±1)℃,环境湿度为(60±5)%,每日灯光照明时间为早8:00至晚20:00,以标准啮齿类动物饲料饲养(钙的含量为1.09%,磷的含量为0.86%),自由进水。动物购回适应本实验室环境和饮食一周后,被随机分为3组,每组8只:正常对照组(CON),模拟失重组(SUS)和模拟失重+跳跃训练组(JUM),每周称量各大鼠体重3次。其中SUS组大鼠在尾部悬吊期间死亡1只,故剔除该只大鼠数据,不作为统计结果。本实验于2012年8月在浙江省医学科学院完成。
1.2 尾部悬吊模拟后肢失重模型
对SUS和JUM组大鼠进行尾部悬吊模拟后肢失重干预。大鼠尾部悬吊模拟后肢失重模型是在Ju等人的设计方案[7]基础上稍加改进而成。用70%酒精清洗大鼠尾部,去除大鼠尾部皮肤的死细胞和污物,晾干。不必对大鼠进行麻醉,松紧适度地将牵引带螺旋缠绕在大鼠尾部,注意露出大鼠尾部远端以观察大鼠尾部血液循环状况,以防止大鼠尾部因缠绕过紧而缺血坏死。将牵引带通过可自用转动的金属连接环连接于饲养笼上,保证大鼠在360°方向自由活动。尾部悬吊后,大鼠后肢离开地面,其躯干和地面的夹角约30°左右,只能依靠前肢和悬吊的尾部支撑体重。悬吊期间,每天定时检查大鼠尾部悬吊装置以确定悬吊牵引带没有脱落,并且检查大鼠尾部血液循环和大鼠的进食、饮水、理毛行为,以确保悬吊干预没有影响到大鼠的正常活动。
1.3 跳跃训练方案
从大鼠尾部悬吊干预的当天开始,每天同一时间对JUM组大鼠进行跳跃训练。大鼠跳跃训练是在参照Ju等人的方案的基础上[7],结合本实验室条件在自制的大鼠跳箱中进行的,跳箱底板为通电铜丝制成,内部设置多个横杆,横杆距离底板高度为40 cm,开始训练时,通过通电底板的电刺激迫使大鼠起跳,大鼠起跳后通过其前肢的抓握而爬上横杆,之后再将大鼠放回底板,使大鼠再次跳跃而爬上横杆,如此循环使大鼠进行跳跃练习。一般经几次电刺激后,大鼠会主动跳跃爬上横杆而不再需要对其进行电刺激。大鼠每周训练5天,每天跳跃练习30次(约在1分钟内完成),共训练3周。大鼠跳跃训练时将大鼠尾部悬吊装置暂时解除,训练结束后恢复尾部悬吊装置。
1.4 取材与指标测试
于跳跃组大鼠最后一次跳跃训练结束24小时后,称量大鼠体重,腹腔注射戊巴比妥钠麻醉大鼠(0.1 ml/100 g BW),心脏取血处死,血液经3000 r/min 4℃离心20 min,分离血清,置-20℃冰箱冷藏待测血钙(Ca2+)、血清碱性磷酸酶(ALP)、骨钙素(BGP)和抗酒石酸酸性磷酸酶5b(TRACP5b)等血清骨代谢指标;取大鼠右侧腓肠肌和比目鱼肌,立即称重;取大鼠右侧股骨,清除骨组织表面的软组织后,游标卡尺测量股骨的长度,随后于-20℃冰箱保存待测骨密度。
1.5 指标测试
大鼠腓肠肌和比目鱼肌的称重于组织取出后立即进行。
大鼠股骨长度的测定于组织取出后,用游标卡尺立即测量。
血钙(Ca2+)的测定采用邻甲酚酞络合酮终点比色法(南京建成试剂盒),血清碱性磷酸酶(ALP)的策动采用MODULAR全自动生化分析仪(日本)(美国Roche公司试剂盒);骨钙素(BGP)和抗酒石酸酸性磷酸酶5b(TRACP5b)的测定采用酶免法(美国ADL公司试剂盒,美国MUL2TISCAN MK3酶标仪)。
股骨骨密度测定前,先从-20℃冰箱取出股骨,室温自然解冻12小时,解冻后用pDEXA型双能X线骨密度仪(美国Norland公司)扫描整个股骨骨密度。
1.6 数据处理
所有数据结果均用平均值±标准差(Mean±SD)表示,统计软件为SPSS11.0,组间比较采用单因素方差分析(One-way ANOVA),P<0.05代表具有显著性差异,P<0.01代表具有非常显著性差异。
2 实验结果
2.1 各组大鼠体重、比目鱼肌和腓肠肌重量和股骨长度
由表1可知,与正常对照组组CON大鼠相比,尾部悬吊组SUS和JUM大鼠最终体重均显著下降(P<0.01);与正常对照组组CON大鼠相比,尾部悬吊组SUS和JUM大鼠比目鱼肌和腓肠肌重量均显著下降(P<0.01),而且比目鱼肌下降幅度则显著大于腓肠肌的下降幅度,与CON组相比,SUS组和JUM组比目鱼肌重量分别下降50%和0.42%,而与CON组相比,SUS组和JUM组腓肠肌重量只分别下降26.87%和21.87%;各组大鼠的股骨长度没有显著性差异(P>0.05)。
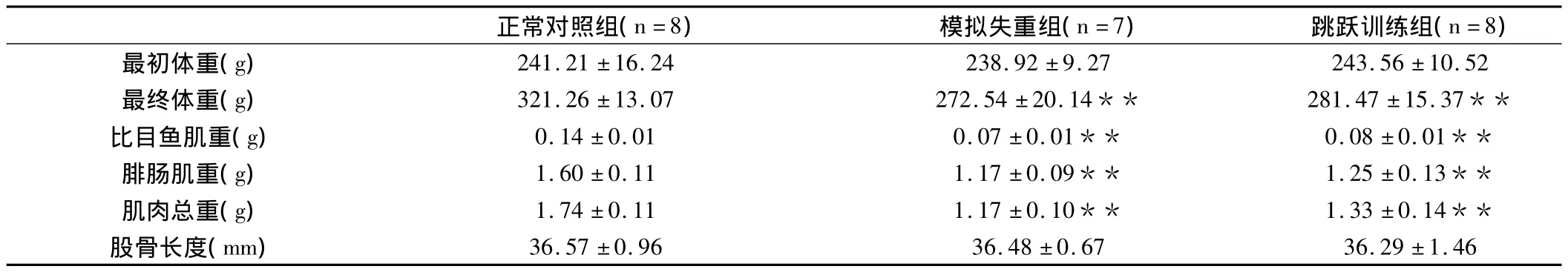
表1 大鼠体重、比目鱼肌和腓肠肌重量和股骨长度一览
2.2 各组大鼠血清骨代谢指标
由表2可知:与正常对照组CON大鼠相比,尾部悬吊组SUS大鼠骨吸收指标血钙(Ca2+)和抗酒石酸酸性磷酸酶5b(TRACP5b)水平均显著增加(P<0.01),而骨形成指标血清碱性磷酸酶(ALP)和骨钙素(BGP)水平则显著降低(P<0.05);与尾部悬吊组SUS大鼠相比,跳跃训练组JUM大鼠骨吸收指标血钙(Ca2+)和抗酒石酸酸性磷酸酶5b(TRACP5b)水平显著降低,但仍没有达到正常对照组CON水平,而骨形成指标血清碱性磷酸酶(ALP)和骨钙素(BGP)水平显著增加,同时也超过了正常对照组CON水平。
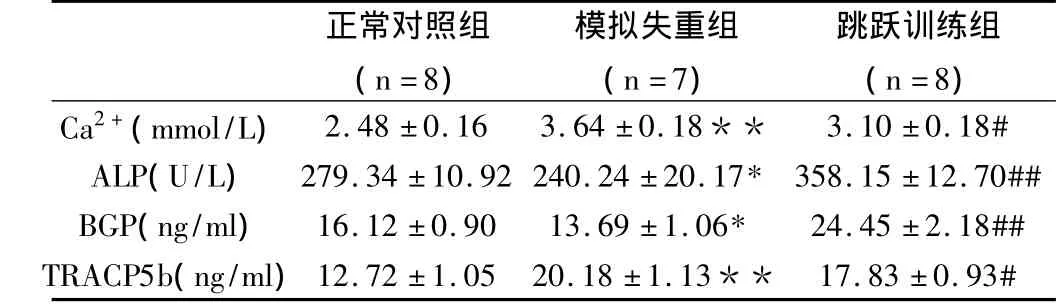
表2 各组大鼠血清骨代谢指标的比较
2.3 各组大鼠股骨骨密度
由图1可知:与正常对照组CON大鼠相比,尾部悬吊组SUS大鼠骨密度显著下降(P<0.01);与尾部悬吊组SUS大鼠相比,跳跃训练组JUM大鼠骨密度显著升高(P<0.01),而且跳跃训练组JUM大鼠骨密度与正常对照组CON大鼠相比也显著升高(P<0.05)。
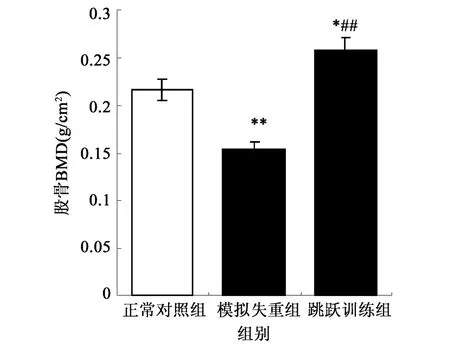
图1 各组大鼠股骨骨密度比较
3 分析与讨论
骨组织是一个代谢非常活跃的组织,其在有机体生命过程中不断的进行着骨重建以维持其对环境应力的需要,低于正常状态的应力环境可造成骨质的流失,使骨密度下降。如长期处于太空微重力环境下的宇航员,由于其骨组织长时间缺乏应有的应力刺激而导致骨质疏松症的发生[8]。另外一些研究分别报道了其他一些情况下,因骨组织在长期处于应力缺乏的情况下而出现的骨密度下降的情况,如Armbrecht等人关于长期卧床休息的病人骨密度下降的报道[9]和Modlesky等人关于脊髓损伤病人骨密度下降的报道[10]。而运动作为一种有效的防治骨质疏松症的干预措施,已经被广泛接受,如适度运动可以有效提高青少年的峰值骨量和减缓绝经后女性的骨质流失[11]。此外,其他一些干预措施也被广发应用于防治微重力环境下宇航员的骨质流失,如电刺激、负重服装、药物干预以及人工重力等手段[12]。
关于宇航员因长期处于太空微重力环境中而导致骨质流失的内在机制,已有多项活体内和活体外的相关研究。但是,真实的太空飞行研究条件的获得却是十分困难,故难以开展大样本的研究,因此陆地上模拟太空失重条件下骨代谢变化的研究就成为了一种非常重要的手段。大鼠尾部悬吊模拟后肢失重模型已经被证实为研究失重对骨代谢影响的较好地动物模型[13]。
本研究骨密度和骨代谢指标的结果显示,尾部悬吊导致大鼠破骨作用增强而成骨作用降低,从而导致骨密度降低。这和前人的研究相一致,如Basso等人的研究[14]表明,尾部悬吊导致了大鼠股骨骨质流失,表现为近端松质骨骨小梁宽度减小、骨小梁间距增大。在大鼠模拟失重期间骨密度的降低可能与其体重和肌肉质量的变化有关。本研究的结果显示,尾部悬吊组大鼠的体重、腓肠肌和比目鱼肌的重量均比正常对照组大鼠显著降低,与快肌纤维腓肠肌的下降幅度(26.87%)相比,慢肌纤维比目鱼肌的下降幅度(50%)则更显著,这一结果和Hurst等人的研究结果[15]相一致。这是由于比目鱼肌属于慢肌纤维,其主要作用是维持机体的平衡和对抗重力作用,其肌纤维蛋白的表达与重力作用的大小密切相关,而腓肠肌属于快肌纤维,与慢肌纤维的作用不同,其主要作用是在体力活动中快速收缩,其肌纤维蛋白的表达与重力作用关系则不如比目鱼肌显著。
从美国太空实验室建立以来,有氧训练一直作为防治宇航员骨质流失的一种重要措施,然而其效果并不理想[1]。而以往多项人体和动物实验结果显示,跳跃练习促进骨形成的作用明显优于跑步等有氧运动[16]。Rubin 等人的研究表明[17],运动维持骨密度的作用主要取决于运动时骨组织受到的最大载荷和载荷刺激频率,而在跑步等有氧运动中,其对骨组织刺激的最大载荷小于跳跃运动,且其过多的刺激重复次数和刺激时间并不能增加其维持骨密度的作用。因此,在对抗废用性骨质疏松症的效果方面,跳跃训练可能优于有氧训练。
本研究发现在大鼠尾部悬吊模拟后肢失重期间,跳跃运动可以有效地防止骨组织因失重废用而引起的骨质疏松。同时也发现,跳跃训练未能完全阻止大鼠尾部悬吊造成的后肢肌肉萎缩,但跳跃训练对大鼠尾部悬吊造成的骨质流失的预防作用却非常明显,跳跃训练甚至使尾部悬吊大鼠股骨骨密度高于正常对照组,这和Notomi等人研究相一致,在Notomi等人的研究中,8周的攀爬实验显著提高了尾部悬吊大鼠的骨密度和骨强度,但却未能使大鼠的后肢肌肉量增加[18]。究其原因,在本研究中的跳跃训练中,大鼠向上跳跃的过程中,大鼠的骨组织受到了骨骼肌收缩产生的机械刺激较强,而在大鼠被放回到跳箱底部时,其骨组织又可受到来自地面的较强的反作用力刺激,故跳跃训练对大鼠骨组织的应力刺激较强,能够有效防止因尾部悬吊而引起的骨质疏松。而至于跳跃训练未能有效防止大鼠因尾部悬吊而导致的肌肉萎缩的原因,则需要进一步的研究,这可能与在跳跃训练中,肌肉组织受地面冲击力的刺激不如骨组织强烈有关。
以往的多项研究证明不同类型的运动方式对于骨质疏松预防的有效性,包括跑台训练[19]、跳跃训练[20]、全身振动刺激[21]、游泳训练[22]以及抗阻训练[23]等。但是跑台训练、游泳训练、抗阻训练以及全身振动刺激等方式,要达到较好地预防骨质疏松的效果,每天需要的训练时间较长(一般需要60分钟以上),而跳跃训练只需要每天训练1分钟(跳跃练习30次)的时间即可达到同样的效果。如果运动训练所需时间较长,那么尾部悬吊对于骨组织代谢的影响作用可能会在后肢恢复负荷训练的过程中发生逆转,所以对于运动对大鼠尾部悬吊期间骨代谢影响的研究而言,每天较长时间的训练方式显然不合理,而跳跃练习每天只需较短时间(约1分钟)的训练,训练后迅速恢复大鼠尾部悬吊的状态,较好地模拟了宇航员所处的太空微重力环境,所以是一种较好的研究运动对大鼠尾部悬吊期间骨代谢影响的运动方式。
本研究也存在着一些不足之处,主要表现在:本研究通过大鼠尾部悬吊模拟后肢失重模型来研究长期处于失重状态的骨组织代谢的变化,以及跳跃运动对于废用性骨质疏松的预防作用,其结果和真实的宇航员在太空微重力环境下的骨代谢变化可能存在一定差异;而且本研究所采取的跳跃训练强度和频率也不宜直接应用于宇航员,因为人类和大鼠的骨重建方式以及对运动的反应仍存在一定的差异;另外,本研究所采取的跳跃干预方式是在大鼠暂时解除尾部悬吊恢复重力环境下进行的,而处在太空微重力环境下的宇航员则不可能做到暂时恢复重力环境进行训练。但是,本研究的结果至少能够证实在失重期间进行适当的跳跃训练,能够有效防止废用性骨质疏松,这给长期处于微重力环境下的宇航员预防骨质疏松提供了方法借鉴。实际上宇航员在太空工作过程中,虽然由于处于微重力的环境下而难以实现运动对骨组织的机械刺激,但宇航员可以借助专门设计的器械进行运动训练,如通过弹力带的作用而施加外力,Cavanagh的研究表明在太空中宇航员在跑台上跑步训练时,可在弹力带的帮助下使负重骨受到应力刺激[24],同样在太空中宇航员也可以通过弹力带的作用以增加跳跃训练时骨组织的应力刺激和肌肉收缩受到的阻力。
4 结论
尾部悬吊模拟后肢失重可导致大鼠骨吸收作用增强,骨形成作用降低,从而使骨密度下降。而在模拟失重期间进行跳跃训练可有效抑制大鼠骨吸收和增强其骨形成,从而有效抑制尾部悬吊大鼠骨密度的下降。
[1]LeBlanc A,Schneider V,Shackelford L,et al.Bone mineral and lean tissue loss after long duration space flight[J].J Musculoskelet Neuronal Interact,2000,1(3):157-160.
[2]Ju YI,Sone T,Okamoto T,et al.Jump exercise during remobilization restores integrity of the trabecular architecture after tail suspension in young rats[J].J Apple Physiol,2008,104(2):1594-1600.
[3]Rittweger J,Frost HM,Schiessl H,et al.Muscle atrophy and bone loss after 90 days’bed rest and the effects of flywheel resistive exercise and pamidronate:results from the LTBR study[J].Bone,2005,36(6):1019-1029.
[4]Rubin C,Xu G,Judex S.The anabolic activity of bone tissue,suppressed by disuse,is normalized by brief exposure to extremely low-magnitude mechanical stimuli[J].FASEB J,2001,15(8):2225-2229.
[5]Swift JM,Swift SN,Nilsson MI,et al.Cancellous bone formation response to simulated resistance training during disuse is blunted by concurrent alendronate treatment[J].J Bone Miner Res,2011,26(6):2140-2150.
[6]Fluckey JD,Dupont-Versteegden EE,Montague DC,et al.A rat resistance exercise regimen attenuates losses of musculoskeletal mass during hindlimb suspension[J].Acta Physiol Scand,2002,176(9):293-300.
[7]Ju YI,Sone T,Ohnaru K,et al.Differential effects of jump versus running exercise on trabecular architecture during remobilization after suspension-induced osteopenia in growing rats[J].J Appl Physiol,2012,112(5):766-772.
[8]Wang J,Liu C,Li T,Wang Y,et al.Proteomic analysis of pulmonary tissue in tail-suspended rats under simulated weightlessness[J].J Proteomics,2012,75(17):5244-5253.
[9]Armbrecht G,Belav DL,Backström M,et al.Trabecular and cortical bone density and architecture in women after 60 days of bed rest using high-resolution pQCT[J].J Bone Miner Res,2011,26(8):2399-3410.
[10]Modlesky CM,Majumdar S,Narasimhan A,et al.Trabecular bone microarchitecture is deteriorated in men with spinal cord injury[J].J Bone Miner Res,2004,19(11):48-55.
[11]Sulkowski CM,Gilkey KM,Lewandowski BE,et al.An extravehicular suit impact load attenuation study to improve astronaut bone fracture prediction[J].Aviat Space Environ Med,2011,82(4):455-462.
[12]Rubin C,Turner AS,Mallinckrodt C,et al.Mechanical strain,induced noninvasively in the high-frequency domain,is anabolic to cancellous bone,but not cortical bone[J].Bone,2002,30(1):445-452.
[13]Martin RB.Effects of simulated weightlessness on bone properties in rats[J].J Biomech,1990,23(5):1021-1029.
[14]Basso N,Jia Y,Bellows CG,et al.The effect of reloading on bone volume,osteoblast number,and osteoprogenitor characteristics:studies in hindlimb unloaded rats[J].Bone,2005,37(1):370-378.
[15]Hurst JE,Fitts RH.Hindlimb unloading-induced muscle atrophy and loss of function:protective effect of isometric exercise[J].J Appl Physiol,2003,95(6):1405-1417.
[16]Judex S,Zernicke RF.High-impact exercise and growing bone:relation between high strain rates and enhanced bone formation[J].J Appl Physiol,2000,88(4):2183-2191.
[17]Rubin CT,Lanyon LE.Regulation of bone mass by mechanical strain magnitude[J].Calcif Tissue Int,1985,37(7):411-417.
[18]Notomi T,Okimoto N,Okazaki Y,et al.Tower climbing exercise started 3 months after ovariectomy recovers bone strength of femur and lumbar vertebrae in aged osteopenic rats[J].J Bone Miner Res,2003,18(2):140-149.
[19]Iwamoto J,Yeh JK,Aloia JF.Differential effect of treadmill exercise on three cancellous bone sites in the young growing rat[J].Bone,1999,24(9):163-169.
[20]Umemura Y,Ishiko T,Yamauchi T,et al.Five jumps per day increase bone mass and breaking force in rats[J].J Bone Miner Res,1997,12(3):1480-1485.
[21]Tezval M,Biblis M,Sehmisch S,et al.Improvement of femoral bone quality after lowmagnitude,high-frequency mechanical stimulation in the ovariectomized rat as an osteopenia model[J].Calcif Tissue Int,2011,88(10):33-40.
[22]Hart KJ,Shaw JM,Vajda E,et al.Swim-trained rats have greater bone mass,density,strength,and dynamics [J].J Appl Physiol,2001,91(4):1663-1668.
[23]Notomi T,Lee SJ,Okimoto N,et al.Effects of resistance exercise training on mass,strength,and turnover of bone in growing rats[J].Eur J Appl Physiol,2000,82(9):268-274.
[24]Cavanagh PR,Licata AA,Rice AJ.Exercise and pharmacological countermeasures for bone loss during long-duration space flight[J].Gravit Space Biol Bull,2005,18(2):39-58.

