HPLC-UV-MS/MS法对金线莲中黄酮类组分的鉴定和测定
郑成凤,潘裕添,蔡文燕,苑小宁,高 飞*
1闽南师范大学化学与环境科学系;2闽南师范大学菌物产业工程技术中心,漳州 363000
金线莲[Anoectochilus roxburghii(Wall.)Lindl]为兰科开唇兰属植物,为多年生珍稀中草药,主要分布于我国福建、台湾、云南等省,民间多用于治疗支气管炎、糖尿病、风湿性关节炎、小儿急惊风及小儿破伤风等疾病。金线莲只能生于阔叶林下且常被树叶遮盖的阴湿地,对于生长的湿度、温度、光度等因素极为苛求,并且自然繁殖成活率极低,野生金线莲的资源蕴藏量很稀少。因此,近年来,国内很多学者开始通过组织培养育苗技术对金线莲进行人工栽培[1],及对组培和野生金线莲中化学成分进行对比分析研究。金线莲的主要活性成分为多糖和黄酮类化合物,并含有少量有机酸、生物碱和甾体等[2-4]。其中黄酮类物质水仙苷具有抗氧化、抗肿瘤、抗病毒等多种生物活性[5]。虽然,研究结果证实金线莲中含有水仙苷成分[6],但对其含量测定的研究鲜有报道。因此,本文运用高效液相色谱-紫外-质谱联用法(HPLC-UV-MS)对金线莲的醇提液中黄酮类化合物进行分离分析及含量测定,并对组织培养金线莲和野生金线莲中的水仙苷等黄酮类物质的含量进行比较分析,以期为组培金线莲的质量控制提供依据。
1 仪器与材料
Agilent HPLC1200(含在线脱气、四元泵、自动进样器、柱温箱和DAD检测器)(美国安捷伦公司);Agilent 6320 Ion Trap LC/MSD(ESI离子源,美国安捷伦公司)。
福建金线莲I、福建金线莲II、台湾金线莲I和台湾金线莲II(均由潘裕添教授课题组培养提供);野生金线莲(云南);水仙苷(异鼠李素-3-O-β-D-芸香糖苷)、山奈酚和异鼠李素(纯度≥98%,购自上海源叶生物科技有限公司);芦丁(槲皮素-3-O-β-D-芸香糖苷)和槲皮素(纯度≥98%,购自国药集团化学试剂有限公司);甲醇、乙醇和甲酸(分析纯,西陇化工股份有限公司,均经实验室重蒸提纯);乙腈(色谱纯,德国默克试剂);超纯水(Milli-Q Gradient)。
2 实验方法
2.1 检测条件
质谱条件:离子源:ESI;检测模式:负模式;雾化气压力(Nebulizer):35.0 psi;干燥气流速(Dry Gas):12.0 L/min;干燥气温度(Dry Temp):325℃;扫描范围为:50~1500 amu;毛细管出口电压(Capillary Exit Voltage):-136.7 V;高压毛细管(HV Capillary):3500 V;碎裂电压(Fragmentation Amplitude):1.0 V;碎裂宽度(Fragmentation Width):4.00 m/z;碎裂时间(Fragmentation Time):40000 μs;碎裂延迟(Fragmentation Delay):0 μs。
液相色谱条件:保护柱:Eclipse XDB-C18Analytical Guard Column(4.6 × 12.5 mm,5 μm);色谱柱:ZORBAX Eclipse XDB-C18(4.6 × 150 mm,5 μm);流速:0.5 mL/min;柱温:35℃;检测波长:368 nm;进样体积:10 μL;流动相:0.03%甲酸水溶液(A),乙腈(B);梯度洗脱程序如下:0~10 min,20%(B);10~12 min,20% ~24%(B);12 ~20min,24%(B);20~25min,24% ~30%(B);25 ~48min,30%(B)。
2.2 金线莲中黄酮类化合物的提取
将金线莲全草冷冻干燥,粉碎,备用。准确称取金线莲样品1.0000 g置于具塞三角烧瓶中,加入20.0 mL 80%乙醇溶液浸泡过夜(约24 h);次日,超声15 min,静置片刻,移取上清液,在残渣中再加入20 mL 80%乙醇溶液超声15 min,重复3次,合并4次上清液。过滤,减压浓缩,以80%乙醇溶液定容至10 mL,得供试品溶液。经0.45 μm微孔滤膜过滤,备用。
2.3 对照品溶液的配制
准确称取芦丁、槲皮素、水仙苷、山奈酚和异鼠李素,分别以甲醇溶解配制成含芦丁1.04 mg/mL、槲皮素1.10 mg/mL、水仙苷1.01 mg/mL、山奈酚1.02 mg/mL和异鼠李素1.02 mg/mL的单一对照品溶液。
精密称取芦丁0.00316 g、水仙苷0.00605 g、槲皮素0.00095 g、山奈酚0.00100 g和异鼠李素0.00105 g,以甲醇溶解定容至25 mL,得到对照品混合储备液。分别精密移取对照品混合储备液0.20、0.50、1.00、2.00、4.00、6.00 和 8.00 mL 置于10 mL容量瓶中,加甲醇稀释定容至10 mL,配制成不同浓度的对照品混合液。
3 结果与讨论
3.1 金线莲的黄酮类组分的确定
精密吸取各单一对照品溶液、对照品混合溶液和福建金线莲I供试品溶液10 μL,按照2.1液相色谱和质谱检测条件分别进行检测分析。对单一对照品溶液和对照品混合溶液的色谱图及其质谱图进行比较,确定色谱峰2、5、8、9 和10(图1-A)分别为芦丁、水仙苷、槲皮素、山奈酚和异鼠李素。根据对照品混合溶液和福建金线莲I供试品溶液中对应色谱峰的保留时间(见图1),以及相应峰的一级及其二级质谱碎片离子(见表1),可确定该供试品溶液含有芦丁、水仙苷、槲皮素、山奈酚和异鼠李素,进一步分析该供试品溶液的色谱图和各色谱峰的一、二级质谱图,可初步推测该供试品溶液还含有其他5种黄酮类物质,其对应色谱峰为1、3、4、6和7(见图1-B)。
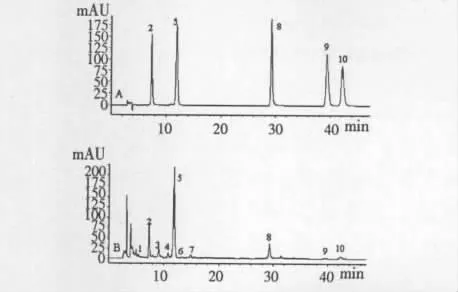
图1 对照品溶液(A)和福建金线莲I供试品(B)的HPLC色谱图(368 nm)Fig.1 HPLC-UV(at 368 nm)chromatograms of mixed reference substances(A)and Fujian ARL-I sample(B)

表1 福建金线莲I供试品的一级和二级质谱数据Table 1 MS and MS/MS data of Fujian ARL-I sample
图2A~E分别为福建金线莲I供试品溶液中1、3、4、6和7号色谱峰的一级和二级质谱图。由图2-A可知,1号峰的一级质谱图中,基峰为[M-H]-离子峰,其质荷比m/z=639.2,可推测为异鼠李素-3,7-O-β-D-二葡萄糖苷的准分子离子峰;以639为目标离子,所得的两个碎裂离子的质荷比分别为477.0 和 315.0,可推测为异鼠李素-3,7-O-β-D-二葡萄糖苷分别脱去一个和两个葡萄糖基团的碎片离子[M-C6H10O5-H]-和[M-2C6H10O5-H]-,其结果与文献[7]基本一致。由图2-B可知,3号峰的一级质谱图中,基峰为[M-H]-离子峰,其质荷比 m/z=463.2,可推测为槲皮素-7-O-β-D-葡萄糖苷的准分子离子峰;以463为目标离子,所得碎片离子的m/z=300.9,为槲皮素-7-O-β-D-葡萄糖苷脱去1个葡萄糖基团的[M-C6H10O5-H]-离子峰,实验结果与文献[4,8]相符合。由图2-C可知,4号峰的一级质谱图中,基峰m/z=593.2,可推测为山奈酚-3-O-β-D-芸香糖苷的准分子离子峰[M-H]-;以593为目标离子,得到m/z=284.9的碎片离子,是山奈酚-3-O-β-D-芸香糖苷裂解脱去芸香糖基团后的[M-C12H20O9-H]-离子峰,实验数据同文献相一致[4,9]。由图2-D 可知,6号峰的一级质谱中,基峰为m/z=447.3,可推测是山奈酚-3-O-β-D-葡萄糖苷的准分子离子峰[M-H]-;以447为目标离子,所获得碎片离子m/z=284.9,为山奈酚-3-O-β-D-葡萄糖苷脱去1个葡萄糖基团的[M-C6H10O5-H]-离子,同时在低质量区出现了山奈酚-3-O-β-D-葡萄糖苷特有的碎片离子峰 m/z=255.1和m/z=151,实验结果与文献相一致[8]。由图2-E可知,7号峰的一级质谱图中,基峰为[M-H]-离子峰,其质荷比m/z=477.1,推测为异鼠李素-3-O-β-D-葡萄糖苷,以477为目标离子,其二级质谱所获得的碎片离子的质荷比为314.1,为异鼠李素-3-O-β-D-葡萄糖苷脱去一个葡萄糖自由基而产生的[M-C6H11O5-H]-离子,并且产生 m/z=357.0、285.1、271.0和151.0离子碎片,所得实验数据与文献相符合[7,10]。
通过分析不同来源的金线莲供试品溶液的HPLC色谱和质谱图,发现所含黄酮类化合物不尽相同(见表2),其中以福建金线莲I、福建金线莲II和台湾金线莲II含黄酮类化合物成分最丰富。
3.2 HPLC-UV方法学考察
3.2.1 标准曲线
分别精密吸取不同浓度的对照品混合液10 μL,按照2.1的液相色谱条件进行测定。以对照品的浓度(C,μg/mL)为横坐标(X),液相色谱峰的平均峰面积(A,mAU)为纵坐标(Y),绘制标准曲线,其回归方程、相关系数、线性范围及检测限见表3。结果表明这些化合物在对应的浓度范围内,其峰面积值和浓度呈现出良好的线性关系。

图2 福建金线莲I供试品中未知组分的一级、二级质谱图Fig.2 MS and MS/MS spectra of unknown components of Fujian ARL-I sample

表2 金线莲样品中黄酮类化合物的组分Table 2 Components of flavonoids of ARL samples
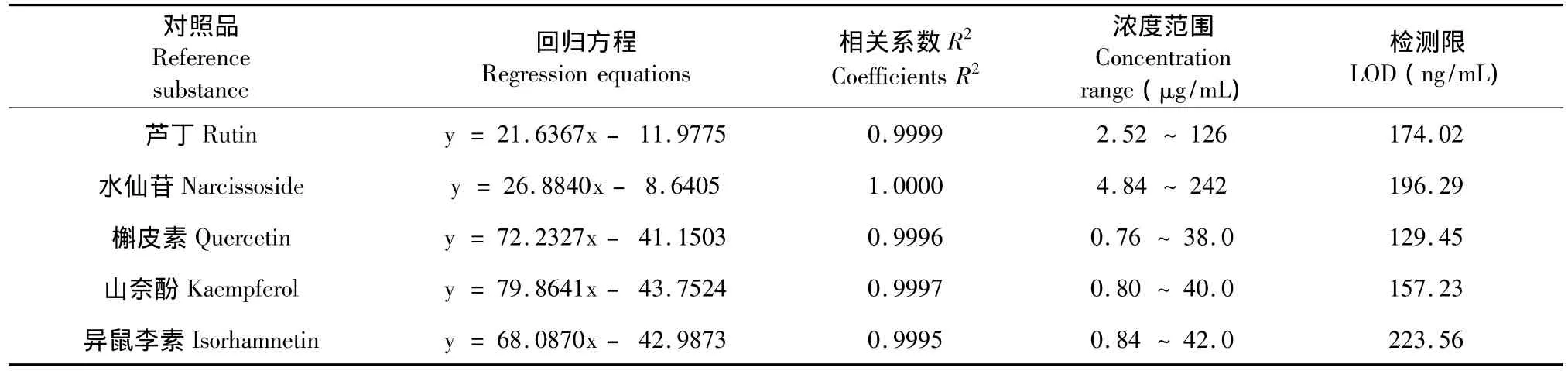
表3 对照品的线性回归方程和检测限(n=8)Table 3 The regression equations and LOD for five reference substances(n=8)
3.2.2 精密度
取对照品混合液10 μL,连续进样6次,按照2.1的色谱条件进行测定。芦丁、槲皮素、水仙苷、山奈酚和异鼠李素的色谱峰面积的RSD(相对标准偏差)和保留时间的RSD均小于0.50%,表明仪器的精密度良好。
3.2.3 稳定性
取福建金线莲I供试品,室温环境下分别在0 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h、36 h、48 h 时进样10 μL进行测定,各黄酮类组分的色谱峰面积的RSD均小于1.87%,表明供试品溶液在48 h之内稳定性良好。
3.2.4 回收率
取福建金线莲I样品6份,分别加入3个不同浓度的对照品混合液(每个浓度2份),按照2.1的色谱条件测定,计算平均回收率,结果见表4,芦丁、槲皮素、水仙苷、山奈酚和异鼠李素回收率均在98~106%范围内,符合国家药典要求。

表4 福建金线莲I的回收率(n=3)Table 4 Recoveries of the five flavonoids in Fujian ARL-I(n=3)
3.3 样品的测定
将福建金线莲I、福建金线莲II、台湾金线莲I、台湾金线莲II和野生金线莲样品分别按照2.2方法制成供试品溶液,在2.1的色谱条件进行测定,以外标法计算芦丁、水仙苷、槲皮素、山奈酚和异鼠李素的含量(见表5)。结果表明福建金线莲I、II包含了野生金线莲的黄酮类成分,且含量较高,故以福建组培金线莲代替野生金线莲是可行的。而台湾组培金线莲所含黄酮类组分和含量同野生金线莲相差较大,说明该组培方法有待进一步优化和改善。

表5 金线莲样品中5种化合物的含量(n=2)Table 5 Content of five compounds detected in five samples of ARL(n=2)
4 结论
根据高效液相色谱-质谱联用法、二级质谱碎片离子提供的信息和相关文献报道,确定出金线莲中含有10种黄酮类组分;异鼠李素-3,7-O-β-D-二葡萄糖苷、芦丁、槲皮素-7-O-β-D-葡萄糖苷、山奈酚-3-O-β-D-芸香糖苷、水仙苷、异鼠李素-3-O-β-D-葡萄糖苷和异鼠李素为共有组分,其中水仙苷的含量最为丰富。实验结果还表明,组培福建金线莲比野生金线莲含有的黄酮类组分多且含量大,有替代野生金线莲潜力。本研究所建立的方法简便快捷,选择性好,可为金线莲组织培养质量控制提供依据。
1 Liu RD(刘润东),Guo WJ(郭文杰),Lin ZN(林忠宁),et al.Tissue culture and nutrient contents analysis of Anoectochilus roxburghii.Guangxi Agric Sci(广西农业科学),2006,37:506-509.
2 He CN(何春年),Wang CL(王春兰),Guo SX(郭顺星),et al.Study on chemical constituents of Anoectochilus roxburghii(III).Nat Prod Res Dev(天然产物研究与开发),2005,17:259-262.
3 Cai JY(蔡金艳),Gong LM(宫立孟),Zhang YH(张勇慧),et al.Studies on chemical constituents from Anoectochilus roxburghii.J Chni Med Mater(中药材),2008,31:370-372.
4 Wang XX(王晓雪).Study on rapid mass spectrometric analytical method and correlation spectroscopy of NMR/RRLCMS of constituents in the crude extract of Anoectochilus roxburghii.Beijing:Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College(中国医学科学院,北京协和医学院),PhD.2011.
5 Ribonnet L,Callebaut A,Nobels I,et al.Modulation of CYP1A1 activity by a Ginkgo biloba extract in the human intestinal Caco-2 cells.Toxicol Lett,2011,202:193-202.
6 Wang XX,He JM,Wang CL,et al.Simultaneous structural identification of natural products in fractions of crude extract of the rare endangered plant Anoectochilus roxburghii using1H NMR/RRLC-MS parallel dynamic spectroscopy.Int J Mol Sci,2011,12:2556-2571.
7 Auger B,Marnet N,Gautier V,et al.A detailed survey of seed coat flavonoids in developing seeds of Brassica napus L.J Agric Food Chem,2010,58:6246-6256.
8 Chang Q,Wong YS.Identification of flavonoids in hakmeitau beans(Vigna sinensis)by high-performance liquid chromatography-electrospray mass spectrometry(LC-ESI/MS).J Agric Food Chem,2004,52:6694-6699.
9 Seyer A,Einhorn J,Brunelle A,et al.Localization of flavonoids in seeds by cluster time-of-flight secondary ion mass spectrometry imaging.Anal Chem,2010,82:2326-2333.
10 Sriseadka T,Wongpornchai S,Rayanakorn M.Quantification of flavonoids in black rice by liquid chromatography-negative electrospray ionization tandem mass spectrometry.J Agric Food Chem,2012,60:11723-11732.

