海洋来源邻苯二甲酸酯类化学成分和构效关系研究
高程海,易湘茜,林 琳,3,谢文佩,3,龙 彬,3,王一兵*
1广西科学院广西近海海洋环境科学重点实验,南宁 530007;2广西中医药大学药学院,南宁 530001;3广西大学轻工与食品工程学院,南宁 530004
在开发和利用海洋的历史进程中,人类一直面临着防除海洋污损生物附着问题,采用防污剂制成防污涂料是经济和技术上最可行有效的手段。有机锡和氧化亚铜涂料曾经是最有效的防污涂料,但是都由于不良生态环境影响已经或准备被禁止使用。针对这种现状,寻找一种环境友好型的高效抗海洋生物污损物质具有特殊的重要性和迫切性。海洋天然产物防污剂以其易降解、无毒、高效的特点而倍受关注。目前,已从多种海洋动植物中获得了一系列如甾类、萜类、肽类、生物碱类等具有抗海洋生物污损附着活性的海洋天然产物[1]。
邻苯二甲酸酯类(PAEs)化合物又称增塑剂或塑化剂,自2011年中国台湾地区爆出在饮料中非法添加以来,在多种食品、药品、保健品、化妆品中均被检出。今年11月以来,国内高浓度白酒也被报道塑化剂超标,造成消费者闻之色变。然而,常用作增塑剂的PAEs一直存在着天然来源[2],近些年也经常从各种海洋生物中分离获得[3-6]。研究表明,PAEs作为海洋生物的次生代谢产物,有抗海洋污损生物附着的功能[6]。本文报道了三种海洋生物中的邻苯二甲酸酯类化合物分离、纯化和结构鉴定过程,并测试其抗海洋污损生物附着能力以及构效关系。
1 材料与方法
1.1 仪器与试剂
Brucker Avance 600型核磁共振波谱仪,TMS为内标;waters 2695(PDA检测器,10 mm×250 mm,5 um,Phenomenex);无菌操作台SYD001(苏州亿达净化设备有限公司);生化培养箱LRH-250A(广东省医疗器械厂);双层恒温培养震荡器ZHWY-2112C(上海智城分析仪器有限公司);高压灭菌锅HVE-50(日本 HIRAYAMA公司);超声波细胞破碎仪VCX-500(美国SONICS公司);薄层色谱硅胶与柱层析硅胶(青岛海洋化工厂);Sephadex LH-20(Pharmacia Biotech.Sweden);高效液相色谱用试剂为色谱纯,所用试剂均为分析纯。
1.2 生物材料
细菌菌株从广西涠洲岛海域采集的柳珊瑚Anthogorgia caerulea中分离,采用16S rRNA鉴定为枯草芽孢杆菌(Bacillus subtilis)。
柳珊瑚样品于2010年8月采自广西涠洲岛海域,由中国科学院南海海洋研究所李秀宝博士鉴定为Anthogorgia caerulea。
真菌菌株从香港西贡红树林附近海水中分离得到,通过分析菌落形态,采用形态学检验确定Cladosporium sp.。
1.3 发酵、提取和分离
枯草芽孢杆菌经扩大培养(培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L;培养条件:30℃,150 rpm),获得60 L发酵液。用乙酸乙酯萃取发酵液,萃取液经真空浓缩后得到萃取部位4.6 g。采用硅胶柱层析萃取部位,以石油醚-丙酮系统(100∶0~0∶100)梯度洗脱,得到E1~E35共35个流份。E8~E10流份经硅胶柱层析,以石油醚-乙酸乙酯系统(50∶50)等梯度梯度洗脱得到化合物1(4.8 mg)。E17流份经过半制备HPLC进行分离后,得到化合物2(3.9 mg)和3(4.2 mg)。
柳珊瑚Anthogorgia caerulea(湿重约5.0 kg)切碎,用乙醇-二氯甲烷(V∶V=1∶1)混合溶剂浸泡三次,每次一周,将所得粗提物加水混悬,依次用石油醚、乙酸乙酯和正丁醇各萃取三次,减压回收试剂,得乙酸乙酯萃取物24.82 g。将乙酸乙酯萃取物装入硅胶柱层析,以CHCl3-Me2CO系统(100∶0~50∶50)和CHCl3-MeOH系统(90∶10~0∶100)依次梯度洗脱,根据薄层色谱检测后,合并近似流份,共得到10个分离部位(A-J)。组分E经凝胶柱层析后,再用制备薄层色谱制备分离得到化合物4(2.6 mg)。组分J经硅胶柱层析后,再用半制备高效液相色谱进行分离,得化合物5(10.0 mg)。
Cladosporium sp.F14经发酵罐培养(酵母浸粉0.4%,麦芽粉0.5%,葡萄糖0.4%,海盐1.8%)后,获得120 L发酵液。乙酸乙酯萃取发酵液,再经真空浓缩得萃取相8.7 g。采用硅胶柱(200~300目)层析萃取部位,合并近似流份,得到9个分离部位(gf1-gf 9)。gf 6经硅胶柱层析,用氯仿和甲醇混合溶剂(V∶V=1∶0.05 ~1∶0.5)洗脱后,经薄层色谱检测后,合并为5个流份。流份gf 6-2经过半制备HPLC进行分离后,得到化合物6(5.0mg)。部位gf 6-4经过半制备HPLC进行分离后,得到化合物7(6.8 mg)和8(5.3 mg)。
1.4 抗污损生物幼虫附着活性筛选
1.4.1 幼虫的培养
藤壶幼虫的培养根据 Thiyagarajan等[7]方法,在附着测试之前,处于介虫状态的藤壶幼虫在8℃黑暗环境中放置4 d。
1.4.2 抗幼虫附着活性筛选
化合物1~8分别溶解于DMSO溶液中,用无菌海水配制成 100、50、25 μg/mL、12.5、6.25、3.13、1.57 μg/mL共7个浓度梯度。在24孔板的每个孔中加入1 mL配制好的测试样品(采用DMSO溶解)和20个游动藤壶幼虫,每个样品做4个平行,加含有1 mL DMSO的无菌海水作为阴性对照。配有测试样品的24孔板放于培养箱中,培养温度为28℃,避光放置24 h后,观察实验结果。通过显微镜观察逐个记录已附着在板壁上的幼虫个数和没有附着在板壁上的幼虫个数以及已死亡的幼虫个数。统计已附着在板壁上的幼虫个数占实验用总幼虫个数的百分比,通过EPA PROBIT ANALYSIS PROGRAM Version 1.5软件计算受测化合物的EC50和LC50。
2 结构鉴定
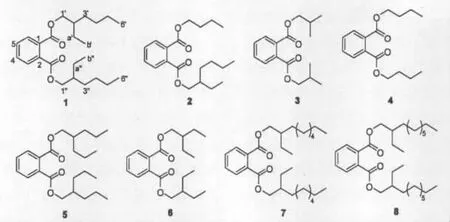
图1 化合物1~8的结构Fig.1 Structures of compounds of 1-8
化合物1 无色油状;分子式C24H38O4;TLC检验,紫外254 nm处有吸收,5%磷钼酸乙醇溶液加热不显色;ESI-MS m/z:390.9[M+H]+;1H NMR(600 MHz,CD3OD)δH:7.72(2H,dd,J=5.7,3.3 Hz,H-3,6),7.63(2H,dd,J=5.7,3.3 Hz,H-4,5),4.00(4H,s,H-1',1''),1.68(2H,m,H-2',2'),1.43(4H,m,H-a',a''),1.37(4H,m,H-3',3''),1.32(8H,m,H-4',4'',5',5''),0.90(12H,m,H-6',6'',b',b'');13C NMR(150 MHz,CD3OD)δC:169.8(CO),133.6(C-4,5),132.5(C-1,2),129.9(C-3,6),69.1(C-1',1''),40.2(C-2',2''),31.6(C-3',3''),30.0(C-4',4''),23.8(C-5',5''),14.5(C-6',6''),24.7(C-a',a''),11.8(C-b',b'')。上述氢谱和碳谱数据与文献[3]一致,故鉴定化合物1为邻苯二甲酸二(2-乙基)己酯。
化合物2 无色油状;分子式C20H30O4;ESI-MS m/z:334.2 [M ]+,267.5,228.1,205.4,106.5,149.8,76.7;1H NMR(600 MHz,CD3OD)δH:7.71(2H,dd,J=6.0,3.6 Hz,H-3,6),7.53(2H,dd,J=6.0,3.6 Hz,H-4,5),4.29(4H,t,J=6.6 Hz,H-1'),4.23(2H,m,H-1''),1.68(3H,m,H-2',2''),1.43(4H,m,H-3',a''),1.32(6H,m,H-3'',4'',5''),0.93(9H,m,3 × CH3,H3-4',6'',b'');13C NMR(150 MHz,CD3OD)δC:168.6(CO),132.6(C-4),132.5(C-5),131.0(C-1,2),130.0(C-3,6),68.3(C-1''),65.7(C-1'),38.9(C-2''),30.7(C-2'),30.5(C-3''),29.9(C-4''),23.9(C-a''),23.1(C-5''),19.3(C-3'),13.8(C-4',6''),11.1(C-b'')。上述氢谱和碳谱数据与文献[8]一致,故鉴定化合物2为2-O-butyl-1-O-(2'-ethylhexyl)benzene-1,8-dicarboxylate。
化合物3 无色油状物;分子式 C16H22O4;熔点:327℃,ESI-MS m/z:278.3[M]+;1H NMR(600 MHz,CDC13)δH:7.72(2 H,dd,J=6.0,3.3 Hz,H-3,6),7.53(2H,dd,J=6.0,3.3 Hz,H-4,5),4.17(4H,d,J=6.5 Hz,H-1',1''),2.01(2H,m,H-2',2''),0.95(12H,d,J=6.5 Hz,H-3',3'',a',a'')。13C NMR(150 MHz,CDCl3) δC:167.1(CO),132.0(C-4,5),128.9(C-1,2),129.0(C-3,6),71.4(C-1',1''),27.6(C-2',2''),19.0(C-3',3'',a',a'')。上述氢谱和碳谱数据与文献[9]一致,故鉴定化合物3为邻苯二甲酸二异丁酯。
化合物4 无色油状;分子式C16H22O4;ESI-MS m/z:301.2[M+Na]+,579.3[2M+Na]+;1H NMR(600 MHz,CDCl3)δH:7.71(2H,dd,J=5.7,3.3 Hz,H-3,6),7.52(2H,dd,J=5.7,3.3 Hz,H-4,5),4.30(4H,t,J=6.7 Hz,H-1',1''),1.71(4H,m,H-2',2''),1.44(4H,m,H-3',3''),0.96(6H,t,J=7.4 Hz,H-4',4'');13C NMR(150 MHz,CDCl3)δC:167.9(CO),132.4(C-4,5),131.1(C-1,2),129.0(C-3,6),65.7(C-1',1''),30.7(C-2',2''),19.3(C-3',3''),13.9(C-4',4'')。上述氢谱和碳谱数据与文献[5]一致,故鉴定化合物4为邻苯二甲酸二丁酯。
化合物5 无色油状;分子式C24H38O4;ESI-MS m/z:335.4[M+H]+;1H NMR(600 MHz,CD3OD)δH:7.72(2H,dd,J=5.7,3.3 Hz,H-3,6),7.63(2H,dd,J=5.7,3.3 Hz,H-4,5),4.19(4H,m,H-1',1''),1.87(2H,m,H-2',2''),1.43(8H,m,H-4',4'',b',b''),1.32(8H,m,H-3',3'',a',a''),0.94(12H,m,H-5',5'',c',c'');13C NMR(150 MHz,CD3OD)δC:169.4(CO),133.6(C-4,5),132.5(C-1,2),129.9(C-3,6),69.1(C-1',1''),38.7(C-2',2''),32.6(C-3',3'',a',a''),24.0(C-4',4'',b',b''),14.8(C-5',5'',c',c'')。上述氢谱和碳谱数据与文献[4]一致,故鉴定化合物5为邻苯二甲酸二(2-丙基)戊酯。
化合物6 无色油状物;分子式C20H30O4;EIMS m/z 334.2 [M]+。IR(KBr)νmax:3441,2954,2922,2867,1722,1597,1570,1 470,1130 cm-1。1H NNR(600 MHz,CDCl3)δ:7.81(2H,dd,J=6.0,3.5 Hz,H-3,6),7.78(2H,dd,J=6.0,3.5 Hz,H-4,5),4.32(4H,m,H-1',l''),1.65(2H,m,H-2',2''),1.52(8H,m,H-3',3'',a',a''),0.91(6H,t,J=4.5 Hz,H-4',4''),0.96(6H,t,J=4.5 Hz,H-b',b'')。13C NMR(150 MHz,CDCl3)δ:168.1(C=O),132.0(C-1,2),131.2(C-3,6),128.2(C-4,5),68.4(C-1',l'),38.0(C-2',2''),30.7(C-3',3''),14.0(C-4',4''),23.7(C-a',a''),12.1(C-b',b'')。上述氢谱和碳谱数据与文献[10-11]一致,故鉴定化合物6为邻苯二甲酸二(2-乙基)丁酯。
化合物7 无色油状物;分子式C30H50O4;EIMS m/z 474.3 [M]+。1H NNR(600 MHz,CDCl3)δ:7.69(2H,dd,J=6.0,3.5 Hz,H-3,6),7.61(2H,dd,J=6.0,3.5 Hz,H-4,5),4.21(4H,m,H-1',l''),1.70(2H,m,H-2',2''),1.42(24H,m,H-3',3'',4',4'',5',5'',6',6'',8',8'',a',a''),0.85(6H,t,J=4.5 Hz,H-9',9''),0.90(6H,t,J=4.5 Hz,H-b',b'')。13C NMR(150 MHz,CDCl3)δ:168.1(C=O),132.1(C-1,2),131.1(C-3,6),128.5(C-4,5),68.0(C-1',l''),38.2(C-2',2''),30.2(C-3',3''),27.8(C-4',4''),29.8(C-5',5''),29.3(C-6',6''),31.8(C-7',7''),22.7(C-8',8''),14.0(C-9',9''),23.7(C-a',a''),11.9(C-b',b'')。上述氢谱和碳谱数据与文献[12]一致,故鉴定化合物7为邻苯二甲酸二(2-乙基)壬酯。
化合物8 无色油状物,分子式C32H54O4;EIMS m/z 502.4 [M]+。1H NNR(600 MHz,CDCl3)δ:7.64(2H,dd,J=6.0,3.5 Hz,H-3,6),7.67(2H,dd,J=6.0,3.5 Hz,H-4,5),4.20(4H,m,H-1',l''),1.70(2H,m,H-2',2''),1.42(28H,m,H-3',3'',4',4'',5',5'',6',6'',8',8'',9',9'',a',a''),0.85(6H,t,J=4.5 Hz,H-10',10''),0.90(6H,t,J=4.5 Hz,H-b',b'');13C NMR(150 MHz,CDCl3)δ:132.1(C-1,2),131.1(C-3,6),128.5(C-4,5),168.1(C=O),68.0(C-1',l''),38.2(C-2',2''),30.2(C-3',3''),27.8(C-4',4''),29.8(C-5',5''),29.3(C-6',6''),31.8(C-7',7''),22.7(C-8',8''),23.0(C-9',9''),14.7(C-10',10''),23.1(C-a',a''),12.3(C-b',b'')。上述氢谱和碳谱数据与文献[13]一致,故鉴定化合物8为邻苯二甲酸二(2-乙基)癸酯。
3 抗污损生物附着活性及构效关系研究
藤壶(Balanus)属于甲壳纲藤壶科动物。藤壶幼虫从母体脱离开后,随后洋流漂浮,遇到人类建筑物如码头、船底、核电站排水口后就会附着其上,很难被清除,严重影响人类生产生活安全和造成经济损失,是一种典型的海洋污损生物。通过测试邻苯二甲酸酯类化合物1~8抗藤壶幼虫附着活性发现,化合物1~8都显示出具有抗海洋污损生物藤壶幼虫附着活性,EC50(半最大效应浓度)值均低于美国海军研究中心认定能做海洋抗污损剂最低要求(25 μg/mL),且LC50(半致死浓度)也均高于100(μg/mL)。

表1 邻苯二甲酸酯类化合物抗藤壶幼虫附着活性Table 1 Anti-larval settlement activity of PAEs using the barnacle Balanus amphitrite
对照测试化合物1~8的结构共同点,再与之前测试已报道化合物活性[6,14,15]对比,可知酯结构单元与抗海洋污损生物附着活性密切相关,其他类型活性测试也存在该结论[16,17]。原因为当含有酯结构单元时,化合物通过扩散效应比较容易穿透细胞壁,进入细胞内部,因此也更容易显示出活性[16]。化合物1~8中脂肪链长短,对其抗海洋污损生物附着活性有显著影响。表1中表明,邻苯二甲酸酯类化合物脂肪链越长,抗海洋污损生物附着能力越强,如化合物8的脂肪链有10个碳,而化合物5只有3个碳,前者抗藤壶幼虫附着活性是后者10倍。有文献[14]报道说长脂肪链可使酯类化合物更加容易接触到作用部位。脂肪侧链中支链对化合物1~8也有一定的影响,从其抗藤壶幼虫附着活性结果可知,存在脂肪支链比没有支链活性强,脂肪支链长比短活性强。推测原因是脂肪侧链中存在支链可以增加邻苯二甲酸酯类化合物的脂溶性,从而增加其扩散效应,达到与存在酯结构单元相同的目的。
4 结论
通过各种分离技术和结构鉴定方法,从柳珊瑚Anthogorgia caerulea、枯草芽孢杆菌和真菌Cladosporium sp.发酵液中共分离鉴定了8个邻苯二甲酸酯类化合物。采用典型海洋污损生物藤壶的幼虫,测试了获得8个化合物抗海洋污损生物附着能力,发现化合物1~8均显示出具有开发成海洋抗污剂的潜力(EC50<25 μg/mL)。研究邻苯二甲酸酯类化合物的构效关系发现,该类化合物含有的脂类结构、脂肪侧链和脂肪侧链中支链均影响该类化合物的抗海洋污损生物附着能力。
1 Qian PY,Xu Y,Fusetani N.Natural products as antifouling compounds:recent progress and future perspectives.Biofouling,2010,26:223-234.
2 Sun BG(孙宝国),Sun JY(孙金沅).Discussion about the natural existence and safety of phthalic acid esters.J Chin Insti Food Sci Tech(中国食品学报),2011,11(8):1-8.
3 Su LL(苏丽丽),Tang XL(唐旭利),Zhan Q(张婧),et al.Studies on chemical constituents of Gorgonian Melithaea sp.from the South China Sea.Chin J Mar Drugs(中国海洋药物杂志),2011,30(5):18-22.
4 Li LY(李莉娅),Deng ZW(邓志威),Li J(李军),et al.Chemical constituents from chinese marine sponge Cinachyrella australiensis.J Peking Univ Health Sci(北京大学学报),2004,36:12-17.
5 Shi Y(石瑛),Tian L(田黎),Wang J(王婧),et al.Studies on the chemical constituents of the fermentation liquid from marine actinomyces Micromonospora sp.and bacteria Oceano spirillum sp.Chin J Mar Drugs(中国海洋药物),2006,25:6-10.
6 Qi SH,Xu Y,Xiong HR,et al.Antifouling and antibacterial compounds from a marine fungus Cladosporium sp.F14.World J Microb Biot,2009,25:399-406.
7 Thiyagarajan V,Harder T,Qian PY.Relationship between cyprid energy reserves and metamorphosis in the barnacle Balanus amphitrite Darwin(Cirripedia;Thoracica).J Exp Mar Biol Ecol,2002,280(1-2):79-93.
8 Garba S,Salihu L.Antibacterial activities of 2-O-butyl-1-O-(2'-ethylhexyl)benzene-1,8-dicarboxylate and 1-phenyl-1,4-pentanedione isolated from Vitellaria paradoxa root bark.Asian J Sci Res,2011,4:149-157.
9 Wang D(王栋),Yang H(杨欢),Da YP(戴衍鹏),et al.Studies on chemical constituents of Oxytropis falcata(Ⅱ).Chin Pharm J(中国药学志),2008,43:1292-1294,
10 Wu FJ,Su JD.Isolation,purification and identification of antioxida-tive components from fruits of Amomum tsaoko L..J Chin Agric Chem Soc,1996,34:438-451.
11 Olufunke MD,Adebayo OI,Ajani OI,et al.Comparison of the chemical compositions of the essential oils from the aerial parts,fruits and roots of nigerian Laportea aestuans(L.)Chew(Urticaceae).Nat Prod Commun,2008,3:1921-1924.
12 Wahidulla S,D’souza L,Govenker M.Lipid constituents of the red alga Acanthophora spicifera.Phytochemistry,1998,48:1203-1206.
13 Li Y,Qian JZ,Kim S.Cathepsin B inhibitory activities of three new phthalate derivatives isolated from seahorse,Hippocampus Kuda Bleeler.Bioorg Med Chem Lett,2008,18:6130-6134.
14 Xu Y,Li HL,Li XC,et al.Inhibitory effects of a branchedchain fatty acid on larval settlement of the polychaete Hydroides elegans.Mar Biotechnol,2009,11:495-504.
15 Gao CH,Tian XP,Qi SH,et al.Antibacterial and antilarval compounds from marine gorgonian-associated bacterium Bacillus amyloliquefaciens SCSIO 00856.J Antibiot,2010,63:191-193.
16 Adam QS,Carlo B,Christopher M,et al.The presence of substituents on the aryl moiety of the aryl phosphoramidate derivative of d4T enhances anti-HIV efficacy in cell culture:a structure-activity relationship.J Med Chem,1999,42(3):393-399.
17 Gupta SP.Quantitative structure-activity relationships of antianginal drugs,Prog Drug Res,2001,56:121-154.

