仪器对液相色谱-同位素稀释质谱测试结果的影响
李秀琴,杨 总,张庆合
(中国计量科学研究院,化学计量与分析科学研究所,北京 100013)
仪器对液相色谱-同位素稀释质谱测试结果的影响
李秀琴,杨 总,张庆合
(中国计量科学研究院,化学计量与分析科学研究所,北京 100013)
以同位素稀释质谱法测定奶粉中氯霉素为例,比较了近几年商品化的API5000、Q-trap5500、Agilent 6490、Waters XEVO TQS 4种高效液相色谱-串联三重四极杆质谱仪(LC-MS/MS)的关键指标,并重点研究了由于离子源设计导致的样品基质中残留化合物对氯霉素及其氘代同位素试剂测量的基质效应差异。通过比较测量氯霉素的线性、灵敏度和精密度等指标,发现这4种仪器测量氯霉素的线性和检测灵敏度差异不大。在0.2~1.0 ng/g痕量浓度范围分析时,在低浓度点时,不同仪器上两种化合物的离子化差异较大,测量精密度在1.0%~9.8%之间;在高浓度时,仪器对目标物响应的影响较小。考察了各仪器对不同基质溶液所产生的基质效应,发现在所有仪器上被测物与其同位素稀释剂的响应均存在差异,且随浓度增大差异越来越明显;不同预处理方法下得到的样品基质溶液,在不同仪器可能出现抑制或增强两种相反的基质效应现象,且强度差异也较大。表明基质中不同类型的干扰物在不同类型的离子源上的离子化模式与机理可能存在较大差异,从而导致同位素试剂之间响应的差异,在准确测量中必须分别进行基质效应的验证与确认。
高效液相色谱-串联三重四极杆质谱(LC-MS/MS);同位素稀释质谱法;基质效应;氯霉素
随着现代质谱技术的飞速发展,食品中农兽药残留、临床样品中药物以及药物代谢物等成分的痕量分析已成为可能,其中高效液相色谱-串联三重四极杆质谱(LC-MS/MS)由于其高选择性、高灵敏度、高通量等优点被广泛应用[1-8]。商品化的液相色谱-质谱联用仪器的发展非常迅猛,很多公司推出的LC-MS/MS仪器不断更新,并在离子化、检测、软件等方面取得了很多创新与改进,以降低基质效应[9-12]。AB Sciex API5000仪器系统有很高的定量分析灵敏度,其离子源的帘气专利技术能有效降低离子源的污染;Q-trap5500是API5000的升级版本,将串联四极杆与线性离子阱结合,使其成为药物发现、食品分析等领域的有效平台;Waters XEVO TQS系统拥有StepWave创新离轴离子源技术,大幅度提高了灵敏度;Agilent 6490系统具有Ifunnel技术,使得灵敏度达到新的水平,同时弯曲碰撞池也在很大程度上降低了背景噪音。不同品牌仪器应用不同离子源设计技术,能有效的电离被测物,提高仪器测量灵敏度。在测量过程中,不同离子源设计的质谱仪的电离效率、电离稳定性等鲜有报道。另外,近年来,同位素稀释质谱法被普遍用于复杂样品基质的测定,以消除或减少基质效应的影响[13-19]。实验中发现,被测物与其同位素稀释剂的响应并不完全相同,基质效应对二者的影响也不相同,尤其是复杂基质样品中的目标物在不同品牌仪器上离子化时,所产生基质效应差异较大,甚至可能出现相反的基质效应,这种差异不仅直接影响测量结果,而且给分析工作者造成很大的困惑。Ghosh等[20]指出,液相和离子源设计可能在基质效应中起到非常重要的作用。因此,本研究采用4种不同样品预处理方法提取奶粉中氯霉素,以氘代氯霉素同位素稀释剂为内标,比较研究4种不同品牌质谱仪对不同基质中氯霉素的同位素稀释质谱法测定结果的影响。采用空白基质溶液(A)和空白溶剂(B)配制系列浓度的被测物混合溶液,通过比较二者质谱响应曲线斜率的差异[21],研究基质效应ME%,用校正因子θ来量化基质效应对测量结果的影响。
1实验部分
1.1主要仪器与装置
高效液相色谱HPLC串联XEVO-TQS三重四极杆质谱:美国Waters公司产品;LC-20AD XR液相色谱仪,LC-30AD SR液相色谱仪:日本Shimadzu公司产品;串联API5000三重四极杆质谱,串联Q-trap5500质谱:美国AB Sciex公司产品;液相色谱仪1290串联6490三重四极杆质谱:美国Agilent公司产品;3K30离心机:德国Sigma公司产品;MS 3DS25微量振荡器:德国IKA公司产品:N-EVAPTM111氮吹仪:美国Organomation Associates 公司产品;固相萃取装置:美国Supelco公司产品;Mettler Toledo XP 205天平:瑞士梅特勒-托利多公司产品;OASIS HLB固相萃取柱(150 mg/60 mL):美国Waters公司产品;Supe MIPTMChloramphenicol (25 mg/10 mL) LRC 柱:美国Supelco公司产品;HiCape MCX柱:维泰克科技(武汉)有限公司产品。
1.2主要材料与试剂
氯霉素(CAP)标准物质((99.8±0.2)%,GBW(E) 060907):由中国计量科学研究院提供;甲醇、乙腈(色谱纯):美国Fisher Scientific公司产品;氘代氯霉素(D5-CAP,≥98%):Cambridge Isotope Laboratories Inc;乙酸乙酯、正己烷(色谱纯):德国Merck公司产品;硫酸钠(分析纯,纯度不小于99.0%):美国Alfa Aesar公司产品;实验用水为经Milli-Q净水系统(0.22 μm过滤膜)过滤的去离子水;奶粉样品:市购,4 ℃保存备用。
1.3实验方法
1.3.1基质样品溶液的制备 1)液液萃取:称取0.5 g(准确称量至0.000 1 g)奶粉于15 mL离心管中,加入一定量的氘代氯霉素(D5-CAP)标记物,严格按照1∶5的比例加入水(准确称量至0.000 1 g),混匀,55 ℃下加热10 min;加入3 g无水硫酸钠和6 mL乙酸乙酯,剧烈震荡30 s,涡旋2 min;在4 ℃,以8 000 r/min离心10 min,取上层有机相,重复提取1次,合并提取液,45 ℃下氮气吹干,用2 mL流动相复溶,混匀,过0.22 μm滤膜,上机测试。
2)固相萃取
HLB萃取:取1.3.1吹干后样品,用2 mL 0.1 mol/L乙酸钠缓冲液(pH 5)复溶,待净化。依次用6 mL甲醇,4 mL水,4 mL 10 mmol/L HCl溶液活化HLB小柱,上样,然后再用4 mL水,2 mLV(水)∶V(甲醇)=95∶5的溶液,2 mLV(水)∶V(甲醇)=50∶50的溶液洗涤,最后用4 mL甲醇洗脱,收集全部洗脱液,40 ℃下氮气吹干,用2 mL流动相复溶,混匀,过0.22 μm滤膜,上机测试。
MCX萃取:取1.3.1吹干后样品,用2 mL流动相复溶,待净化。依次用3 mL甲醇,3 mL水活化MCX小柱,上样,再用3 mL水,3 mL甲醇洗涤,用5 mL 5%氨化甲醇洗脱,收集全部洗脱液,40 ℃下氮气吹干,用2 mL流动相复溶,混匀,过0.22 μm滤膜,上机测试。
MIP萃取:称取0.5 g(准确称量至0.000 1 g)奶粉于15 mL离心管中,加入一定量的氘代氯霉素(D5-CAP)标记物,严格按照1∶5的比例加入水(准确称量至0.000 1g),混匀;在4 ℃,以8 000 r/min离心15 min,弃上层脂肪,用乙酸或氨水调节pH 7,待净化;依次用1 mL甲醇,1 mL水活化MIP小柱,上样1 mL,再用2 mL水、1 mL 0.5%乙酸(含5%乙腈)、2 mL水、1 mL 1%氨水(含20%乙腈)洗涤,抽干;再用3 mL二氯甲烷洗涤,抽干;用V(2 mL甲醇)∶V(乙酸)∶V(水)=89∶1∶10的溶液洗脱,收集全部洗脱液,40 ℃下氮气吹干,用2 mL流动相复溶,混匀,过0.22 μm滤膜,上机测试。
1.3.2仪器测试条件 色谱条件:Waters XTerra MS C18色谱柱(100 mm×2.1 mm×3.5 μm),流动相为V(高纯水)∶V(乙腈)=70∶30的溶液,等度洗脱,流速0.25 mL/min,柱温30 ℃,进样量10 μL。
质谱条件:负离子多反应监测扫描(MRM)模式,CAP的监测离子分别是m/z321.0→152.0(定量离子),m/z321.0→256.9(定性离子),D5-CAP的监测离子是m/z326.0→157.1(定量离子)。
API5000:去簇电压(DP)-100.0 V,入口电压(EP)-10.0 V,碰撞池出口电压(CXP)-11.0 V,帘气(CUR)流速18 L/min,雾化气(GS1)流速70 L/min,辅助气(GS2)流速80 L/min,电喷雾电压-4 500 V,离子源温度500 ℃,碰撞能(CE)-22 eV。
Q-trap5500:去簇电压-130.0 V,入口电压-10.0V,碰撞池出口电压-15.0 V,帘气流速35 L/min,雾化气流速55 L/min,辅助气流速50 L/min,电喷雾电压-4 500 V,离子源温度580 ℃,碰撞能-20 eV。
XEVO-TQS:毛细管电压-0.5 kV,锥孔电压-30 V,离子源补偿电压-60 V,离子源温度500 ℃,干燥气流速1 000 L/h,锥孔气流速150 L/h,雾化气压力7×105Pa,碰撞气流速0.18 L/min,碰撞能-24 eV。
Aglient6490:毛细管电压-3 000 V,雾化气温度200 ℃,雾化气流速14 L/min,喷雾器压力3.8×105Pa,鞘气温度400 ℃,鞘气流速12 L/min,碰撞能-14 eV。
2结果与讨论
2.1仪器参数优化
质谱参数设置直接影响检测灵敏度、精密度等。4种LC-MS/MS仪器的质谱参数优化过程是在具有足够的灵敏度条件下,围绕目标物的母离子,再经过碎裂电压调整得到碎片离子,通常选择丰度最高的碎片离子作为定量离子,丰度较高的其它离子作为定性离子,采用MRM模式进行定量检测。
以Q-trap5500为例,喷雾针到锥孔的距离直接影响被分析目标物带电粒子的数量,实验考察了喷雾针与锥孔的距离对总离子流的影响,距离调节为2 mm时,响应强度明显高于4 mm和6 mm,达到3.58×107,所以实验选择2 mm的距离,总离子流图示于图1。由CAP结构可以推测,CAP分子在ESI电离源中容易丢失1个质子而带上负电荷。采用针泵注射50 ng/g CAP标准溶液,进行负离子模式全扫描,确定母离子为m/z321.1,进行碎片离子扫描,碎片离子有m/z152、257.1、194.1、175.9等,其中碎片离子m/z152和m/z257.1丰度较高,因此选择m/z152为定量离子,m/z257.1为定性离子,其二级质谱图示于图2。同位素D5-CAP的优化与CAP的优化方法一致。实验进一步优化了去簇电压和碰撞能量,最佳条件分别是-130 V和-24 eV。

图1 喷雾针与锥孔口不同距离的质谱响应总离子流图Fig.1 TIC of the different distance between the spray needle and ions entrance

图2 氯霉素的二级质谱图Fig.2 Mass spectrum of chloramphenicol
2.2仪器性能参数的比较
在各仪器测定CAP的最佳条件下,分别对系列浓度的CAP与D5-CAP混合溶液进行测定,其中内标D5-CAP浓度均为1.0 ng/g,比较了4种仪器的关键性能指标参数,包括线性、检出限、定量限及测量精密度,结果列于表1。由表1可知,氯霉素浓度在0.2~5.0 ng/g范围内,各仪器的线性良好,相关系数(R2)均大于0.999;以3倍信噪比作为检出限(LOD),以10倍信噪比作为定量限(LOQ),4种仪器的检出限和定量限比较接近,说明在空白溶剂基质中,CAP与D5-CAP的离子化效率差异较小,检测限相差约3倍。比较了不同浓度的CAP在4种仪器上的测量精密度,示于图3。可以看出,随着氯霉素浓度的升高,测量精密度变好,在5.0 ng/g时,4种仪器上测量值RSD在0.4%~0.5%之间,非常接近,但在0.2 ng/g时,RSD变化范围为2.1%~9.8%,说明在低浓度下,仪器响应重现性之间存在较为显著的差异;从图3还可以看出,离子源设计相同或者相近的仪器,其在低浓度下离子化效率的稳定性较一致。上述仪器性能的差异主要取决于仪器的离子源、质量分析器、检测器等的设计与安装,以及数据采集与处理系统性能等。
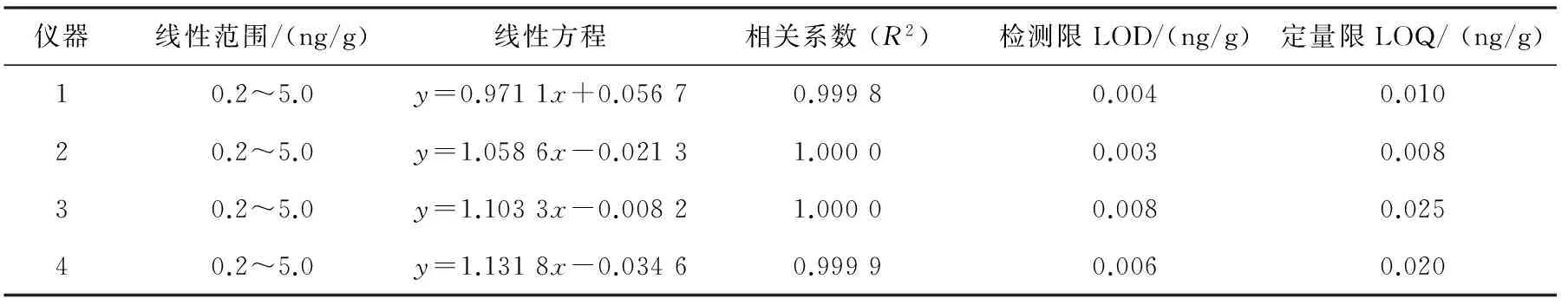
表1 4种仪器的线性范围,检出限和定量限

图3 4种仪器的精密度比较(n=5)Fig.3 Comparison of four instruments precision
2.3仪器的CAP与D5-CAP质谱响应比较
本实验用流动相溶液配制CAP与D5-CAP混合溶液,考察不同浓度CAP与D5-CAP在3种仪器(ABI Q-trap5500除外,其离子源设计原理同API5000)上的质谱响应情况。不同浓度时,CAP与D5-CAP面积比的变化趋势示于图4。结果表明,3种仪器上,面积比与浓度的变化趋势基本一致,即随着浓度的升高,CAP的响应从小于D5-CAP的响应逐渐变成大于D5-CAP的响应,且两者的响应差别逐渐增大。1号仪器在低浓度(0.2和0.5 ng/g)时,两个化合物的响应是完全相同的,随着浓度的增大,CAP的响应越来越大于D5-CAP的响应;2号仪器在低浓度(0.2和0.5 ng/g)时,CAP的响应小于D5-CAP的响应,但随着浓度的增大,CAP的响应也越来越大于D5-CAP的响应;3号仪器仅在0.2 ng/g时,CAP的响应小于D5-CAP的响应,而在0.5 ng/g时,CAP的响应大于D5-CAP的响应,之后变化趋势同其他仪器。综上,在低浓度点时,不同仪器上2种化合物的离子化差异较大,而在高浓度时,仪器对响应的影响较小。有文献[22-23]报道在ESI电离过程中,分析物与其同位素稀释剂和其他基质成分都要获得喷雾液滴表面的电荷而带电进入质谱检测,在获得电荷过程中分析物之间有竞争关系,仪器离子源的设计差异会引起目标物离子化过程的不同。上述实验结果可能是在低浓度时,溶剂干扰较大,不同离子源去溶剂能力的差异使CAP与D5-CAP获得足够的电荷能力差别较大,因此受仪器的影响较大;随着浓度提高,离子化竞争过程中的差异能够表现出来,而由仪器不同引起的差异则表现不明显。

注:质谱响应为CAP与D5-CAP的峰面积比,n=5图4 CAP与D5-CAP在3种仪器上的质谱响应趋势图Fig.4 Mass response trend graph of CAP and D5-CAP in three instruments
2.4仪器对不同前处理基质溶液的基质效应影响
比较了4种前处理技术得到的样品在不同仪器上的基质效应指数ME,计算公式示于式(1),测试结果列于表2。

(1)
式中,A为基质添加测试得到的峰面积;B为标准溶液测试得到的峰面积;ME%为基质效应指数。
由表2可知:MIP和MCX固相萃取柱净化的溶液基质效应非常显著,尤其在3号仪器上,经MIP柱净化的溶液基质,离子增强效应达到60.3%;在2号仪器上,MCX柱净化样品的离子增强效应也达到31.8%;而在1号仪器上,除了MCX柱净化的溶液基质效应较显著,达到18.3%外,其他3种溶液的基质效应均较低。这说明对于选择性更强的样品净化方法,在离子源离子化过程中更易受到内源性物质的干扰。原因可能是,选择性强的净化方法可去除基质中大量的成分,但是,残留物可能是与CAP和D5-CAP结构性质最为接近的,因而对它们离子化过程的影响也最为显著,分析工作者在选择前处理方法以及质谱测定时应予以重视。从本实验结果看,1号仪器较适合分析经选择性净化方式处理的样品。HLB净化后的样品表现出较低的基质效应,尤其是在2号和3号仪器上,可能的原因是氯霉素本身的极性相对较强,HLB净化可以去除大量与氯霉素性质相近的干扰物质,所以这种方法处理的样品溶液的基质效应较小,2号和3号仪器更适合分析这种样品。LLE提取后的样品不经过净化直接进样,其中残留的内源性成分最多,但是除了在2号仪器上基质效应稍大外,1号和3号仪器产生的基质效应均较小,可能是由于尽管LLE萃取液中基质成分复杂,但是在离子化过程中可能起到“拉平效应”(促进和抑制目标物离子化的化合物同时存在),最终的ME值并非最大。该实验结果也说明,在同位素稀释质谱分析中,并非样品净化越彻底结果就越准确。

表2 HLB,MCX,MIP和LLE萃取的基质效应(n=5)
2.5仪器的同位素稀释质谱法基质效应量化研究
在同位素稀释质谱检测奶粉中氯霉素和氘代氯霉素的基质效应中,通过检测氯霉素在校准溶液和基质溶液中的响应曲线斜率(K)值的比值MEα来表示氯霉素的基质效应,同时用MEβ表示同位素内标试剂氘代氯霉素的基质效应,示于式(2)和式(3)。这种评价方式能够反映样品基质对氯霉素和内标在质谱中响应的趋势并予以量化,ME大于1说明基质增强效应,小于1是基质抑制效应。校正因子θ评价被测物与其同位素稀释剂的基质效应差异,示于式(4)。θ大于1,说明被测物的响应大于同位素稀释剂的响应,此时采用IDMS方法定量,基质效应会导致测量结果偏高;θ小于1,说明被测物的响应小于同位素稀释剂的响应,会导致测量结果偏低。
MEα=Kcap-s/Kcap-DI
(2)
式中,Kcap-Ds和Kcap-DI分别是基质和空白溶剂中添加氯霉素响应曲线的斜率。
MEβ=KD5-Dcap-Ds/KD5-Dcap-DI
(3)
式中,KD5-Dcap-Ds和KD5-Dcap-DI分别是基质和空白溶剂中添加D5-氯霉素响应曲线的斜率。
θ=MEα/MEβ
(4)
在本实验中,空白样品通过LLE、MCX、HLB、MIP萃取后,采用30%乙腈水溶液溶解样品,并在复溶后的基质中分别添加氯霉素和D5-氯霉素,浓度分别为0.2、0.5、1.0、2.0、5.0 ng/g。用30%乙腈水为溶剂配制校正溶液,氯霉素和D5-氯霉素浓度分别为0.2、0.5、1.0、2.0、5.0 ng/g。在流动相为30%乙腈水的条件下,分别用3种仪器进行测试分析,结果列于表3。
在本实验中,采用1号仪器测试4种前处理方法得到的氯霉素和D5-氯霉素的基质效应,表现出相同的抑制或增强趋势,θ值非常接近,分别为0.96、0.99、0.96、0.98,标准偏差为1.6%。采用2号和3号仪器测定4种样品溶液,这2种仪器对4种基质样品溶液产生的基质抑制效应趋势是一致的,即对LLE的样品溶液均表现出较强的基质抑制效应,且氯霉素和D5-氯霉素的基质抑制率差异很大,θ值分别为0.86和0.94,会导致测量结果偏低约14%和6%。而对MIP的样品溶液均表现出较强的基质增强效应,氯霉素和D5-氯霉素的基质增强率差异较大,θ值分别为1.14和1.05,会导致测量结果偏高约14%和5%。MCX的样品溶液在这2种仪器上均产生基质增强效应,且增强率差异很小,θ值分别为1.00,1.01,接近于1,此条件下的测量结果较准确。HLB的样品溶液在这2种仪器上产生的基质效应为抑制效应,抑制率的差异较小,θ值分别为0.98和0.97。综上,由于仪器离子源设计的差异,导致离子化的效率以及受基质干扰的程度不同。从这3种仪器对4种样品处理方法得到的样品溶液所产生差异较大的基质效应可以看出,不同的离子源在离子化过程中,基质中的中性、离子型干扰物对目标物的离子化具有不同程度的影响。文献[20]研究了不同质谱离子化模式和检测器的基质效应,指出液相和离子源设计可能在基质效应中起到重要的作用。
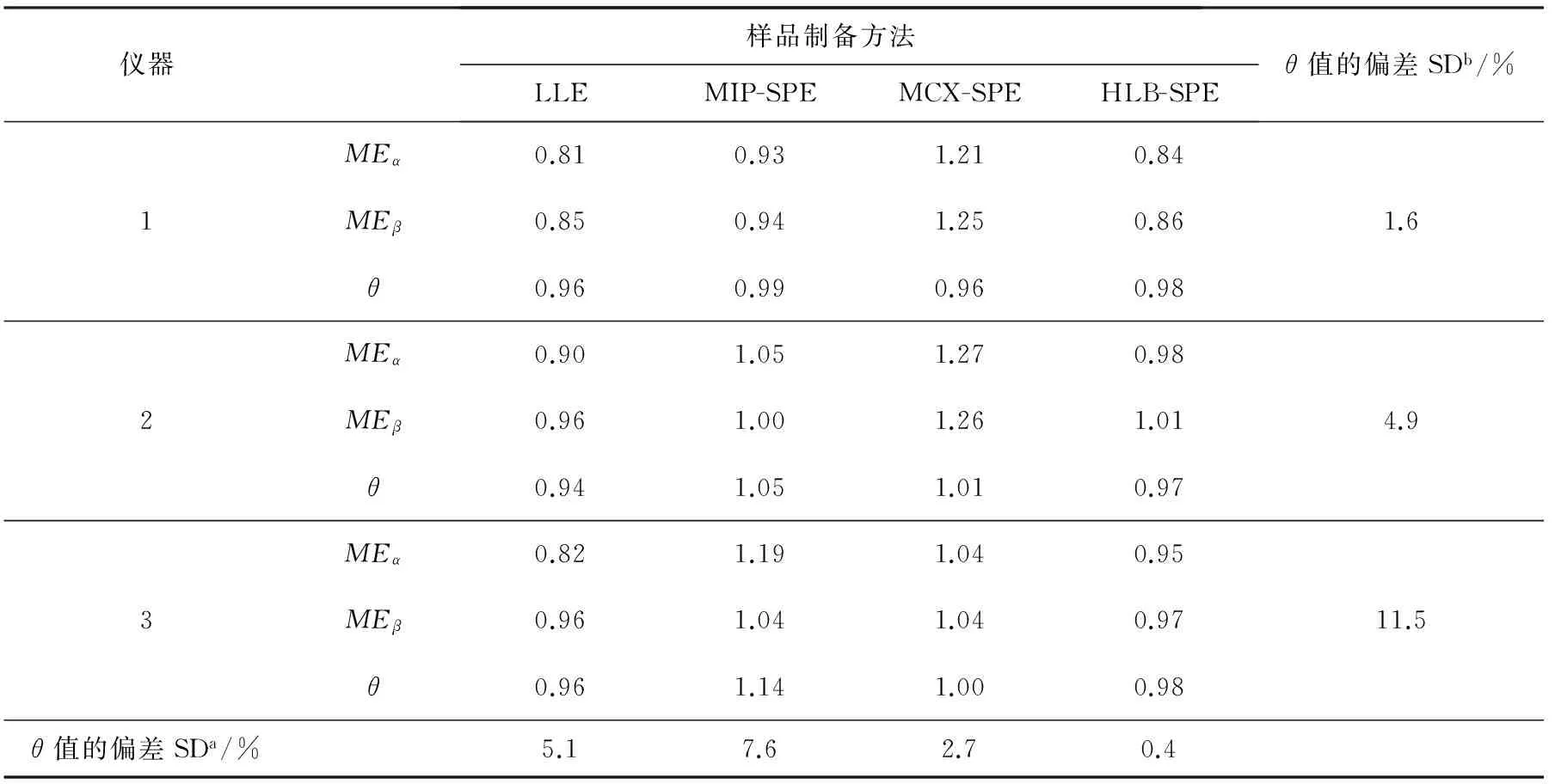
表3 离子源对不同样品前处理基质中氯霉素和D5-氯霉素基质效应的影响
注:SDa代表相同样品处理条件下,3种仪器θ值之间的标准偏差;SDb代表相同仪器条件下,4种样品处理方法θ值之间的标准偏差
3结论
近年来,同位素稀释质谱法被普遍用于复杂样品基质的测定,以消除或减少基质效应的影响。本实验发现,被测物与其同位素稀释剂的响应并不完全相同,基质效应对二者的影响也不相同,尤其是复杂基质样品中的目标物在不同品牌仪器上离子化时,所产生的基质效应差异较大,甚至出现了相反的基质效应。基质效应与前处理技术及分析物浓度密切相关,有的表现为抑制,有的表现为增强。在低浓度时,不同仪器上目标物的离子化差异较大,仪器对目标物的响应影响较大;而在高浓度时,仪器对响应的影响较小。1号仪器较适合分析经选择性净化方式处理的样品;就对氯霉素的分析而言,HLB固相萃取柱可以去除一些极性的干扰物质,氯霉素本身的极性相对较强,HLB净化可以去除大量与氯霉素性质相近的干扰物质,2号和3号仪器更适合分析这种样品。在对CAP与D5-CAP的基质效应进行量化比较研究后发现,CAP与D5-CAP在1号仪器上的离子源中离子化过程相对稳定,受不同方法得到的基质干扰一致,在4种基质溶液中校正因子θ值的标准偏差仅为1.6%。而2、3号仪器离子源的设计会导致氯霉素与D5-氯霉素的离子化过程受到样品前处理方法的影响较大,尤其是在3号仪器上,氯霉素与D5-氯霉素在这4种基质溶液中校准因子θ值的标准偏差达到11.5%。综上,在采用同位素稀释质谱法检测时,仪器对测量结果所产生的影响不容忽视,在进行优化方法时需要充分考察。为了保证测量结果的准确性,可以采用不同仪器进行方法验证,并对基质效应进行合理的评估和计算。
[1] 冯 峰,杨 烁,凌 云,等. 超高效液相色谱-串联质谱快速筛查葡萄酒中的14种禁用食品添加剂[J]. 分析化学,2011,39(11): 1 732-1 737.
FENG Fen, YANG Shuo, LING Yun, et al. Simultaneous screening of 14 illegal food additives in wines using ultra performance liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011,39(11): 1 732-1 737(in Chinese).
[2] 王 炼, 黎源倩, 王海波,等. 基质固相分散-超高效液相色谱-串联质谱法同时测定畜禽肉和牛奶中20种兽药残留[J]. 分析化学,2011,39(2):203-207.
WANG Lian, LI Yuanqian, WANG Haibo, et al. Simultaneous determination of twenty veterinary drug residues in milk and meat using matrix solid phase dispersion-ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(2):203-207(in Chinese).
[3] Van den O J M W, KEMA I P. The role of liquid chromatography-tandem mass spectrometry in the clinical laboratory[J]. J Chromatogr B, 2012,(883/884):18-32.
[4] MARKUS H. 10 years of MS instrumental developments-impact on LC-MS/MS in clinical chemistry[J]. J Chromatogr B, 2012, (883/884): 3-17.
[5] BUHRMAN D L, PRICE P I, RUDEWICZ P J. Quantitation of SR 27417 in human plasma using electrospray liquid chromatography-tandem mass spectrometry: A study of ion suppression[J]. J Am Soc Mass Spectrom, 1996,7(11): 1 099-1 105.
[6] FU I, WOOLF E J, MATUSZEWSKI B K. Eff-ect of the sample matrix on the determination of indinavir in human urine by HPLC with turbo ion spray tandem mass spectrometric detection[J]. J Pharm Biomed Anal, 1998, 18(3): 347-357.
[7] ANNESLEY T M. Ion suppression in mass spectrometry[J]. Clin Chem, 2003, 49(7): 1 041-1 044.
[8] CECH N B, ENKE C G. Relating electrospray ionization response to nonpolar character of small peptides[J]. Anal Chem, 2000, 72(13): 2 717-2 723.
[9] KRUVE A, HERODES K, LEITO I. Electrospray ionization matrix effect as an uncertainty source in HPLC/ESI-MS pesticide residue analysis[J]. J AOAC Int, 2010, 93(1): 306-314.
[10] GARCIA-AC A, SEGURA P A, VIGLINO L, et al.
Comparison of APPI, APCI and ESI for the LC-MS/MS analysis of bezafibrate, cyclophosphamide, enalapril, methotrexate and orlistat in municipal wastewater[J]. J Mass Spectrom, 2011, 46(4): 383-390.
[11] OMNIA I A, MATTHEW H S, MAGDA E Y. Monitoring phospholipids for assessment of ion enhancement and ion suppression in ESI and APCI LC/MS/MS for chlorpheniramine in human plasma and the importance of multiple source matrix effect evaluations[J]. J Chromatogr B, 2008, 875(2):333-343.
[12] IKONOMOU M G, BLADES A T, KEBARLE P. Electrospray mass spectrometry of methanol and water solutions suppression of electric discharge with SF6 gas[J]. J Am Soc Mass Spectrom, 1991, 2(6): 497-505.
[13] PHILIPPE A G, DELPHINE R, PASCAL M, et al. Quantitative determination of chloramphenicol in milk powders by isotope dilution liquid chromatography coupled to tandem mass spectrometry[J]. J Chromatogr A,2004,1 054(1/2):365-371.
[14] RAYANE M,JANIQUE R P,ERIC G,et al. Advantages of molecularly imprinted polymers LC-ESI-MS/MS for the selective extraction and quantification of chloramphenicol in milk-based matrixes. Comparison with a classical sample preparation[J]. Anal Chem,2007,79(24):9 557-9 565.
[15] MARCHI I, RUDAZ S, VEUTHEY J L. Sample preparation development and matrix effects evaluation for multianalyte determination in urine[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009,49(2):459-467.
[16] LINDEGARDH N,ANNERBERG A,WHITE N J,et al. Development and validation of a liquid chromatographic-tandem mass spectrometric method for determination of piperaquine in plasma stable isotope labeled internal standard does not always compensate for matrix effects [J]. J Chromatogr B,2008,862(1/2):227-236.
[17] MATUSZEWSKI B K, CONSTANZER M L,CHAVEZ-ENG C M. Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J]. Anal Chem,2003,75(13):3 019-3 030.
[18] JIAN W Y,RICHARD W E,XU Y D,et al. Potential bias and mitigations when using stable isotope labeled parent drug as internal standard for LC-MS/MS quantitation of metabolites[J]. J Chromatogr B,2010,878(31):3 267-3 276.
[19] JESSOME L L,DIETRICH A V. Ion suppression: A major concern in mass spectrometry[J]. LCGC North America,2006,24(5):498-510.
[20] GHOSH C, SHINDE C P, CHAKRABORTY B S. Influence of ionization source design on matrix effects during LC-ESI-MS/MS analysis[J]. J Chromatogr B, 2012, (893/894): 193-200.
[21] BOYD B, BJÖRK H, BILLING J, et al. Development of an improved method for trace analysis of chloramphenicol using molecularly imprinted polymers[J]. J Chromatogr A, 2007, 1 174(1/2): 63-71.
[22] TRUFELLI H, PALMA P, FAMIGLINI G. An overview of matrix effects in liquid chromatography-mass spectrometry[J]. Mass Spectrometry, 2011, 30(3): 491-509.
[23] BEAUDRY F, VACHON P. Electrospray ionization suppression, a physical or a chemical phenomenon?[J]. Biomedical Chromatography, 2006, 20(2): 200-205.
InstrumentInfluencesontheMeasurementResultsofIsotopeDilutionMassSpectrometry
LI Xiu-qin, YANG Zong, ZHANG Qing-he
(DivisionofMetrologyinChemical,NationalInstituteofMetrology,Beijing100013,China)
High performance liquid chromatography-tandem triple quadrupole mass spectrometry(LC-MS/MS) instrument influences on the measurement results of isotope dilution mass spectrometry method were studied with the measurement of chloramphenicol in milk powder. The basic parameters of API5000, Q-trap5500, Agilent6490, Waters XEVO TQS were investigated e.g. linearity, sensitivity and precision. The results showed that the linearity and sensitivity of the four instruments were good and similar each other, but the precision was quite different with the relative standard deviations of 1.0%—9.8% at the concentration range of 0.2—1.0 ng/g. The affection of instruments was obviously observed in the level of lower concentration. Matrix effect of different instruments during the measurements process was studied. The response of the analyte and its isotope diluent were different in all of mass spectrometers. And the disparity increased with the growing of the concentration of analyte. The use of different apparatus might cause different and even opposite matrix effects such as matrix inhibition and enhancement. And the differences of the effects could be significant. Therefore, the instruments may be play a very important role during the detection programs using LC-MS/MS. The impact of the LC-MS/MS instrument on the measurement results should be given full consideration in the application of isotope dilution mass spectrometry.
high performance liquid chromatography-tandem triple quadrupole mass spectrometry(LC-MS/MS);isotope dilution mass spectrometry;matrix effect;chloramphenicol
O 657.63
A
1004-2997(2013)06-0338-09
10.7538/zpxb.youxian.2013.34.0002
2013-02-04;
2013-05-06
国家科技基础性工作专项项目(2008FY130200);国家青年科学基金项目(21105093)资助
李秀琴(1979~),女,山西人,博士,从事食品安全计量研究。E-mail: lixq@nim.ac.cn
张庆合(1968~),男,河南人,研究员,从事食品安全计量研究。E-mail: zhangqh@nim.ac.cn
时间:2013-09-16;
http://www.cnki.net/kcms/detail/11.2979.TH.20130916.1537.002.html

