Apelin及其受体和一氧化氮合酶在氧诱导的新生小鼠增生性视网膜病变中表达上调*
伍蒙爱, 陈婕灵, 王 维, 陈惠惠, 刘园园, 杨姗姗, 胡良冈, 范小芳, 龚永生△
(1温州医学院低氧医学研究所,浙江 温州 325035; 2温州医学院附属眼视光学院,浙江 温州 325003)
Apelin及其受体和一氧化氮合酶在氧诱导的新生小鼠增生性视网膜病变中表达上调*
伍蒙爱1,2, 陈婕灵1,2, 王 维1, 陈惠惠2, 刘园园2, 杨姗姗2, 胡良冈1, 范小芳1, 龚永生1△
(1温州医学院低氧医学研究所,浙江 温州 325035;2温州医学院附属眼视光学院,浙江 温州 325003)
目的通过观察apelin及其受体APJ和一氧化氮合酶(NOS)在氧诱导的新生小鼠增生性视网膜病变中的表达,探讨apelin/APJ和一氧化氮(NO)是否参与了早产儿视网膜病变新生血管的发生。方法36只7日龄C57BL/6J新生小鼠随机均分为高氧组和对照组。高氧组暴露在75%±2%的氧浓度下5 d后,在正常空气环境下饲养5 d;对照组小鼠在正常氧环境下饲养10 d。两组均在17日龄处死,取左眼眼球做石蜡切片,HE染色计数突破内界膜的血管内皮细胞核数,以判断造模是否成功。实时荧光定量PCR检测右眼视网膜组织apelin和APJ mRNA的表达,免疫荧光组织化学法检测视网膜apelin、APJ、eNOS和iNOS蛋白的表达。结果高氧组视网膜平均每个切面突破内界膜的血管内皮细胞核数(35.13±10.13)明显高于对照组(0.30±0.21,P<0.01),说明造模成功。高氧组apelin和APJ mRNA水平显著高于对照组,分别为对照组的32.2倍和17.6倍(均P<0.01)。组织免疫荧光结果显示高氧组apelin和APJ蛋白表达明显强于对照组,并且主要强表达于新生血管周围;高氧组eNOS和iNOS蛋白表达明显强于对照组,但主要强表达于新生血管下方视网膜组织,在突破内界膜的血管内皮细胞核周围未见表达明显增强。结论Apelin/APJ及NOS可能与氧诱导的新生小鼠增生性视网膜病变新生血管的发生有关。
Apelin; 视网膜; 新生血管形成; 氧诱导的视网膜病变; 早产儿视网膜病变
早产儿视网膜病变(retinopathy of prematurity,ROP)是发生于早产儿的一种严重致盲性视网膜病变,其发病与出生后吸氧治疗等密切相关,但ROP的发病机制仍未完全阐明,已有的研究显示视网膜新生血管的形成可能起主导作用。本研究在氧诱导视网膜病变(oxygen-induced retinopathy,OIR)的新生小鼠模型上,探讨血管生长刺激因子apelin及其受体APJ、一氧化氮合酶(nitric oxide synthase,NOS)是否参与了视网膜新生血管的发生,为预防和治疗ROP提供新的思路与实验依据。
材 料 和 方 法
1材料
1.1主要试剂 兔多克隆apelin和APJ抗体购自Santa Cruz,兔多克隆eNOS和iNOS抗体购自武汉博士德公司,Trizol和山羊抗兔IgG绿色DyLight 488荧光标记Ⅱ抗购自Invitrogen,Quantscript RT Kit和Real Master Mix(Probe)购自天根生化科技(北京)有限公司。
1.2设备 实验动物常压高氧氧舱,由我校低氧医学研究所自制;CYES II型O2气体测定仪;Beckman核酸蛋白测定仪;尼康倒置荧光显微镜;ABI StepOnePlus实时荧光定量PCR仪。
1.3动物 7日龄的清洁级健康C57BL/6J乳鼠36只,母鼠7只,由温州医学院实验动物中心提供。
2方法
2.1OIR模型的建立 高氧环境通过常压高氧氧舱实现,具体是在自制的氧舱里充入浓度接近100%的医用氧气,使舱内氧浓度维持在75%±2%。每24 h更换垫料、食物和钠石灰。将36只7日龄乳鼠随机均分成高氧组和对照组。将高氧组乳鼠分成2窝,每窝由2只母鼠间隔6 h交替进入氧舱喂养,乳鼠持续在氧舱生长5 d,再返回正常氧气环境饲养5 d。对照组乳鼠在空气中饲养10 d。
2.2组织取材 用0.3%戊巴比妥钠麻醉后处死乳鼠,取右眼放入0.1% DEPC水中,在解剖显微镜下用角膜剪沿眼球角巩膜缘剪开,去除角膜、虹膜、晶状体和玻璃体。将视网膜与巩膜及视网膜色素上皮层分离后,待测apelin和APJ。取左眼眼球置入4%多聚甲醛4 ℃固定24 h,常规石蜡包埋、切片,用于病理组织学检查和免疫组织化学荧光检测。
2.3病理组织学检查 于左眼眼球平行角膜至视神经的矢状位连续6 μm切片,间隔30 μm取1张切片,每只眼球取10张切片。切片经HE染色行常规病理学检查,光学显微镜下观察结果。统计平均每只眼球每张切片突破内界膜的血管内皮细胞核数。计数时仅计数与内界膜有紧密联系的血管内皮细胞核,不包括与内界膜无联系的玻璃体腔内的其它血管内皮细胞核。
2.4实时荧光定量PCR 按Trizol说明书提取实验各组小鼠视网膜的总RNA,测定A260/A280的比值(1.8~2.0)及总RNA含量。Quant Reverse Transcriptase一步法逆转录成cDNA,TaqMan探针法行实时定量PCR扩增,反应条件为:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。每个样本做3个复孔。TaqMan探针由ABI公司提供,小鼠内参照β-actin探针号为Mm00607939,apelin探针号为Mm00443562,APJ探针号为Mm00442191。以10倍稀释模板梯度样本进行实时定量PCR反应,目标基因与内参照基因扩增效率接近100%情况下,以内参照基因作为标准进行相对定量,采用2-ΔΔCT计算apelin和APJ相对水平。ΔCT= CT目标基因- CT内参照基因;ΔΔCT=ΔCT高氧组-ΔCT对照组。
2.5免疫荧光组织化学法 取视网膜石蜡切片,经常规脱蜡水化后,PBS洗涤3次,正常山羊血清室温封闭1 h,分别加入apelin、APJ、eNOS和iNOS Ⅰ抗(1∶100)4 ℃孵育过夜,PBS洗涤3次,羊抗兔488标记的荧光Ⅱ抗37 ℃孵育1 h,DAPI复染细胞核5 min,PBS洗涤3次,抗荧光淬灭封片液封片,荧光显微镜下观察,488标记的羊抗兔IgG染apelin、APJ、eNOS和iNOS蛋白呈绿色荧光,DAPI染细胞核的颜色为蓝色荧光。设阴性对照,以PBS替代Ⅰ抗。
3统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件进行统计分析,两组间均数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1视网膜新生血管内皮细胞核计数及实验动物成模率
对照组18只眼180张切片中,共计5张切片可见极少数突破内界膜的视网膜新生血管芽,其细胞核数为1~2个,余175张切片均未见视网膜新生血管芽,见图1A;高氧组12眼120张切片均可见突破内界膜的视网膜新生血管芽,血管腔切面呈不规则扩张,成模率100%,见图1B。对照组18眼180张切片中视网膜新生血管内皮细胞核数,平均每张切片为(0.30±0.21),少于1个,而高氧组12眼120张切片中视网膜新生血管内皮细胞核数,平均每张切片为(35.13±10.13)个,与对照组相比差异有统计学意义(P<0.01)。

Figure 1. HE staining of retinal paraffin sections (×200). A: control group, the retina showing good and complete structure, without neovascular endothelial cell nuclei extending from retinal area into vitreous area; B: high-oxygen group, the retina showing slightly disordered structure, with many neovascular endothelial cell nuclei extending from retinal area into vitreous area (white arrows), and dilated blood vessels close to retinal surface (blue arrow).
图1视网膜石蜡切片HE染色
2视网膜组织apelin和APJmRNA表达结果
高氧组apelin mRNA表达水平比对照组高32.2倍(P<0.01);高氧组APJ mRNA表达水平比对照组高17.6倍(P<0.01),见表1。
3视网膜apelin、APJ、eNOS和iNOS蛋白的表达
3.1Apelin蛋白表达的分布特点 细胞核荧光染料DAPI染色显示为蓝色荧光,apelin蛋白表达阳性染色显示为绿色荧光。对照组小鼠视网膜内界膜完整,未见内皮细胞核突破,整个视网膜未见apelin表达,见图2A。高氧组可见许多蓝色细胞核突破内界膜,在这些细胞核周围可见有大量apelin蛋白表达,此外,在神经节细胞层、神经纤维层血管及深层扩张的血管周围也可见绿色荧光apelin蛋白表达,见图2B。
表1实时荧光定量PCR检测视网膜组织apelin和APJmRNA的表达水平
Table 1. The expression levels of apelin and APJ mRNA in retinal tissues detected by real-time fluorescence quantitative PCR (ΔCT. Mean±SD.n=9)

GroupApelinAPJControl7.391±1.9079.37±1.23High-oxygen2.383±0.353**5.24±1.29**
**P<0.01vscontrol group.

Figure 2. The expression of apelin protein in retinal tissues (immunofluorescence staining, ×200). A: control group; B: high-oxygen group.
图2视网膜组织apelin蛋白的免疫荧光染色
3.2APJ蛋白表达的分布特点 细胞核显示为蓝色荧光,APJ蛋白表达阳性染色为绿色荧光。APJ蛋白的表达特点与apelin相似。对照组视网膜未见明显绿色荧光的APJ蛋白,见图3A;高氧组可见绿色荧光APJ蛋白在突破内界膜的内皮细胞核周围,深层扩张的血管周围强表达,见图3B。
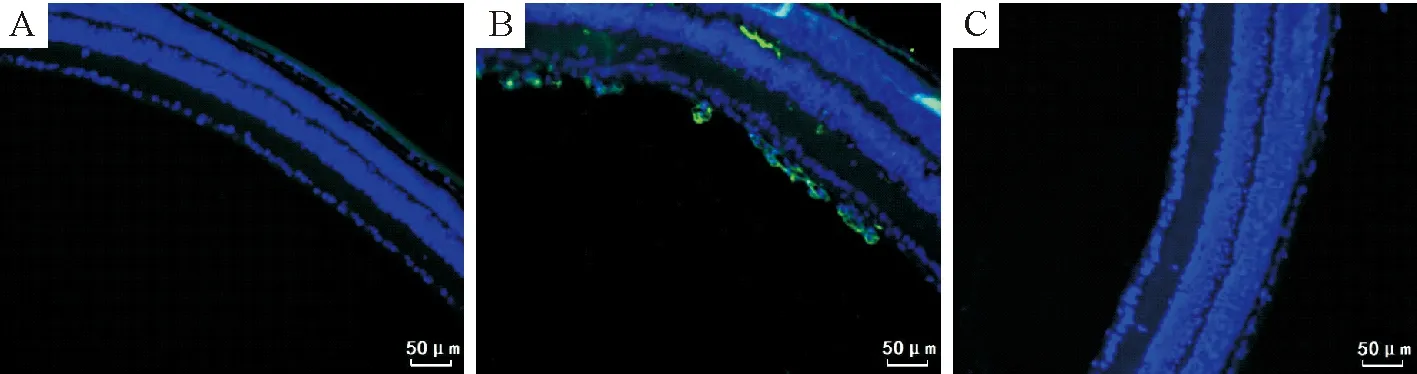
Figure 3. The expression of APJ protein in retinal tissues (immunofluorescence staining, ×200). A: control group; B: high-oxygen group; C: negative control group.
图3视网膜组织APJ蛋白的免疫荧光染色
3.3eNOS蛋白表达的分布特点 细胞核显示为蓝色荧光,eNOS蛋白表达阳性染色为绿色荧光。正常小鼠绿色荧光eNOS蛋白分布于整个视网膜,在内核层细胞的胞浆和外丛状层表达显著,此外在神经节细胞胞浆、内丛状层、光感受器细胞层、视网膜色素上皮细胞层均可见其表达,见图4A。高氧组可见eNOS蛋白表达在各层均不同程度增强,在突破内界膜的内皮细胞核周围亦可见eNOS蛋白表达,但与周围组织相比表达并未明显增强,见图4B。
3.4iNOS蛋白表达的分布特点 细胞核显示为蓝色荧光,iNOS蛋白表达阳性染色为绿色荧光。正常小鼠绿色荧光iNOS蛋白表达主要分布于内丛状层、内核层、视网膜色素上皮细胞层,神经节细胞层也可见少量分布,见图5A。高氧组绿色荧光的iNOS蛋白表达特点与eNOS蛋白基本一致,在新生血管下端的内丛状层表达明显增强,在突破内界膜的内皮细胞核周围可见iNOS蛋白表达,但与周围组织相比表达并未明显增强,见图5B。
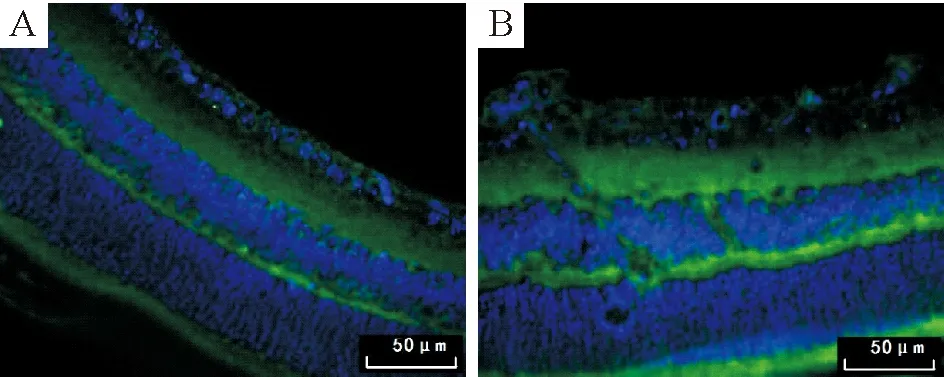
Figure 4. The expression of eNOS protein in retinal tissues (immunofluorescence staining, ×400). A: control group; B: high-oxygen group.
图4视网膜组织eNOS蛋白的免疫荧光染色
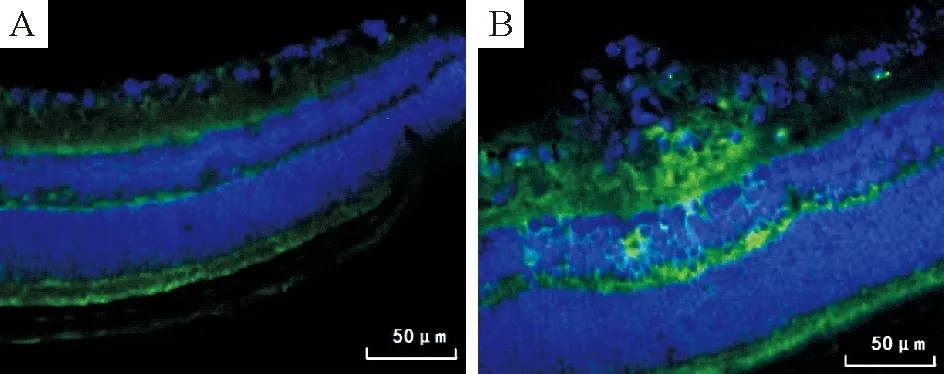
Figure 5. The expression of iNOS protein in retinal tissues (immunofluorescence staining, ×400). A: control group;B: high-oxygen group.
图5视网膜组织iNOS蛋白的免疫荧光染色
讨 论
近年来随着医疗技术的进步,早产儿的生存率明显提高,ROP的发生率也呈显著上升趋势,然而ROP的发病机制仍未完全阐明。以往学者认为高浓度氧是导致ROP的主要原因,但现有的研究发现ROP的产生与“相对缺氧”有着密切关系。人类胚胎早期视网膜无血管,主要由玻璃体动脉提供营养。胎龄4个月时视网膜血管由视盘开始发生,逐渐向周边延伸,胎龄8个月血管发育到达鼻侧周边部,直到足月时视网膜颞侧血管才发育成熟。因此,早产婴儿的周边视网膜血管尚未发育完成。当早产儿处于高浓度氧环境时,视网膜血管收缩、闭塞、停止发育,回至正常氧环境后,视网膜相对缺血缺氧引起大量血管生长刺激因子的释放,导致新生血管的发生。由于小鼠和大鼠在刚出生时视网膜血管尚未发育完全,因此是研究早产儿视网膜病变的良好动物。大鼠模型通过改变氧舱氧浓度(50% 24 h,10% 24 h,再50% 24 h,如此循环)的方法建立,虽然具有更接近临床上早产儿吸氧状态、眼球大而容易操作的优点,但新生血管的发生率低,且与动物品种、甚至同一品种不同实验室来源等有关[1],在我们的预实验中也发现SD大鼠的成模率极低。目前经典的模型是Smith等[2]建立的OIR小鼠模型,该模型视网膜血管新生的发生率可达100%且重复性好[3],与我们的实验结果一致。
Apelin是1998年发现的孤儿G蛋白受体APJ的天然配体[4]。1999年发现apelin/APJ在血管系统,特别是血管内皮细胞高度表达[5]。2002年Saint-Geniez等[6]发现apelin/APJ参与了生理性小鼠视网膜血管发生,并且具有独特的表达方式。2004年Kasai等[7]发现apelin具有促进猴视网膜内皮细胞生长的作用,提示apelin可能是新的血管生长刺激因子。为了进一步研究apelin/APJ在视网膜新生血管发生中的作用,本实验在氧诱导的OIR小鼠模型上发现高氧组小鼠视网膜apelin及其受体APJ的基因表达明显上调,这与Kasai等[7]的研究结果一致。2010年Kasai等[8]发现apelin和APJ mRNA在小鼠OIR模型中表达显著增加,而apelin基因敲除小鼠在同样的相对缺氧环境下几乎不产生新生血管,提示apelin/APJ可能是缺氧诱导的视网膜新生血管发生的先决条件。为了进一步探讨apelin/APJ在OIR中的作用特点,本研究利用免疫荧光染色检测apelin和APJ蛋白在视网膜上的表达,发现apelin和APJ蛋白在高氧组,尤其是血管新生的部位(突破内界膜的血管内皮细胞核即新生血管)表达显著增强,表明apelin/APJ参与了视网膜新生血管的发生。此外在视网膜中间层血管(内丛状层)和深层血管(外丛状层)可见血管管腔扩大,apelin/APJ荧光亮度明显增加,据文献报道apelin具有扩张血管的作用[9],推测apelin在此可能起着扩张血管增加血流的作用。
目前关于apelin/APJ促进新生血管形成的分子机制尚不十分清楚。有报道发现在心血管系统,apelin通过激活eNOS引发内皮细胞释放NO,产生强有力的内皮依赖的血管扩张作用[10],给予NOS抑制剂后,apelin的降压作用被抑制,提示NO是apelin发挥作用的下游信号分子[11]。同时,许多研究表明NO在新生血管的形成中发挥重要的作用,NO是内皮细胞的存活因子,可以抑制内皮细胞凋亡,促进内皮细胞增殖、迁移,血管生长刺激因子如VEGF、TGF-β、bFGF均可引起内皮细胞释放NO[12],并且低氧可以上调人脐静脉内皮细胞iNOS mRNA水平,刺激其释放NO[13]。本实验发现高氧组eNOS和iNOS蛋白在光感受器细胞层和内核层、视网膜色素上皮细胞层表达明显增强,在新生血管下端的内丛状层亦见强表达,但在突破内界膜的内皮细胞核周围未见明显表达,提示eNOS和iNOS参与了视网膜新生血管的发生。eNOS和iNOS在新生血管下方组织的表达增强,释放的NO可以通过旁分泌间接作用于新生血管内皮细胞,促进内皮细胞存活、增殖和迁移,同时NO能起到扩张血管、增加血流的作用从而间接辅助新生血管的发生,其具体作用机制尚有待进一步研究。目前已有学者设计和发现了apelin受体的拮抗剂[14-15],早期阻断apelin受体表达可能有助于抑制血管新生,但其在视网膜血管新生疾病如ROP、增殖性糖尿病视网膜病变中的作用效果有待进一步研究。
本研究在氧诱导的新生小鼠增生性视网膜病变模型上发现,apelin及其受体APJ和NOS参与了ROP视网膜新生血管的发生,但apelin与NOS之间的相互作用尚待进一步研究。
[1] Barnett JM, Yanni SE, Penn JS. The development of the rat model of retinopathy of prematurity [J]. Doc Ophthalmol, 2010, 120(1):3-12.
[2] Smith LE, Wesolowski E, McLellan A, et al. Oxygen-induced retinopathy in the mouse [J]. Invest Ophthalmol Vis Sci, 1994, 35(1):101-111.
[3] Stahl A,Connor KM,Sapieha P,et al. The mouse retina as an angiogenesis model[J]. Invest Ophthalmol Vis Sci, 2010, 51(6): 2813-2826.
[4] Castan-Laurell I, Dray C, Attané C, et al. Apelin, diabetes, and obesity[J]. Endocrine, 2011,40(1):1-9.
[5] Devic E, Rizzoti K, Bodin S, et al. Amino acid sequence and embryonic expression ofmsr/apj, the mouse homolog ofXenopusX-msrand humanAPJ[J]. Mech Dev, 1999, 84(1-2):199-203.
[6] Saint-Geniez M, Masri B, Malecaze F, et al. Expression of the murinemsr/apjreceptor and its ligand apelin is upregulated during formation of the retinal vessels [J]. Mech Dev, 2002, 110(1-2): 183-186.
[7] Kasai A, Shintani N, Oda M, et al. Apelin is a novel angiogenic factor in retinal endothelial cells [J]. Biochem Biophys Res Commun, 2004, 325(2):395-400.
[8] Kasai A, Ishimaru Y, Kinjo T, et al. Apelin is a crucial factor for hypoxia-induced retinal angiogenesis [J]. Arterioscler Thromb Vasc Biol, 2010, 30(11):2182-2187.
[9] Kidoya H, Ueno M, Yamada Y, et al. Spatial and temporal role of the apelin/APJ system in the caliber size regulation of blood vessels during angiogenesis [J]. EMBO J, 2008, 27(3):522-534.
[10] Kagiyama S, Fukuhara M, Matsumura K, et al. Central and peripheral cardiovascular actions of apelin in conscious rats [J]. Regul Pept, 2005, 125(1-3):55-59.
[11] Tatemoto K, Takayama K, Zou MX, et al. The novel peptide apelin lowers blood pressure via a nitric oxide-dependent mechanism [J]. Regul Pept, 2001, 99(2-3):87-92.
[12] Cooke JP. NO and angiogenesis[J]. Atheroscler Suppl, 2003,4(4):53-60.
[13] 胡晓兰,林树新,于代华,等. 低氧对人脐静脉内皮细胞一氧化氮和内皮素-1的生成及诱导型一氧化氮合酶mRNA表达的影响[J]. 中国病理生理杂志, 2005, 21(11):2119-2122.
[14] Iturrioz X, Alvear-Perez R, De Mota N, et al. Identification and pharmacological properties of E339-3D6, the first nonpeptidic apelin receptor agonist [J]. FASEB J, 2010, 24(5):1506-1517.
[15] Macaluso NJ, Pitkin SL, Maguire JJ, et al. Discovery of a competitive apelin receptor (APJ) antagonist [J]. Chem Med Chem, 2011, 6(6):1017-1023.
Up-regulationofapelinanditsreceptoraswellasnitricoxidesynthaseinneonatalmicewithproliferativeretinopathyinducedbyoxygen
WU Meng-ai1,2, CHEN Jie-ling1, 2, WANG Wei1, CHEN Hui-hui2, LIU Yuan-yuan2, YANG Shan-shan2, HU Liang-gang1, FAN Xiao-fang1, GONG Yong-sheng1
(1InstituteofHypoxiaMedicine,WenzhouMedicalCollege,Wenzhou325035,China;2CollegeofOptometryandOphthalmology,WenzhouMedicalCollege,Wenzhou325003,China.E-mail:fxbwzmc@126.com)
AIM: To explore whether apelin and its receptor (APJ) as well as nitric oxide synthase (NOS) were involved in the neovascularization of retinopathy of prematurity by observing their expression characteristics in the retina of a mouse model of oxygen-induced retinopathy.METHODSThirty-six 7-day-old C57BL/6J neonatal mice were randomly divided into high-oxygen group and control group. The mice in high-oxygen group were exposed to 75%±2% oxygen for 5 d, and then changed to normoxia for the next 5 d. The control ones were kept in a normoxic environment for 10 d. The mice in both groups were sacrificed on day 17 of life. The left eyes were isolated to make paraffin sections. The number of endothelial cell nuclei extending from the retinal area into the vitreous area was counted under microscope with HE staining to judge whether the model was successfully established, and immunofluorescence was performed to detect the protein expression of apelin, APJ, eNOS and iNOS. The retinas of the right eyes were dissected for applying real-time fluorescence quantitative PCR to detect the mRNA levels of apelin and APJ.RESULTSThe number of neovascular endothelial cell nuclei extending from the retinal area into the vitreous area in high-oxygen group was much higher than that in control group (35.13±10.13vs0.30±0.21,P<0.01).The mRNA levels of apelin and APJ were higher than those in control group (P<0.01), by 32.2 times and 17.6 times, respectively. The expression of apelin and APJ proteins was significantly increased in high-oxygen group, mainly around the neovessels. The expression of eNOS and iNOS proteins was also significantly increased in high-oxygen group, mainly in the retinal tissue under the neovessels, but not around the neovascular endothelial cell nuclei .CONCLUSIONApelin and its receptor as well as NOS may be involved in the neovascularization in oxygen-induced retinopathy.
Apelin; Retina; Neovascularization; Oxygen-induced retinopathy; Retinopathy of prematurity
R774.1
A
10.3969/j.issn.1000- 4718.2013.06.022
1000- 4718(2013)06- 1081- 05
2012- 09- 19
2013- 04- 23
浙江省自然科学基金资助项目(No.Y2091033);浙江省大学生科技创新项目(No.2010R413012);高原医学教育部重点实验室(第三军医大学)资助项目(No.2009GK04;No.2011JSGY07)
△通讯作者 Tel: 0577-86699521; E-mail: fxbwzmc@126.com

