向日葵下胚轴遗传转化影响因素的研究
刘海臣
(内蒙古民族大学生命科学院,内蒙古 通辽 028042)
向日葵属于菊科一年生草本植物,具有耐盐碱、抗干早、耐贫瘠等优良特性,是植物油脂和蛋白质的重要来源,同时,它也是重要的生物能源之一。向日葵很容易受农杆菌侵染[1],所以目的基因很容易通过农杆菌进入向日葵的肿瘤细胞。向日葵遗传工程获得首例转化植株报道的是利用下胚轴经农杆菌介导的未知序列基因的转化[2],并且是用卡那霉素作为再生植株的筛选标记。在向日葵遗传转化过程中,一些研究表明:利用农杆菌介导法转化向日葵受许多因素影响。这些因素包括外植体的生理年龄[3]、外植体的接种时间[4,5]、农杆菌株[6]、共培养时间[3]、培养基中激素种类及浓度[7]、筛选剂的类型及浓度[8,9]和不同的遗传转化方法[10,11]。
本试验利用农杆菌介导法,研究了共培养时间、侵染时间、重悬液浓度等因素对向日葵下胚轴遗传转化的影响。
1 材料与方法
1.1 材料
1.1.1 植物材料与转化受体
HA300、NC208、诺杂212三种基因型均由内蒙古通辽市种子公司提供,以向日葵下胚轴为转化受体。
1.1.2 质粒和菌株
根癌农杆菌EHA101由本实验室保存,质粒 (本室构建)上含有目的基因Psy和植物抗性筛选标记Hpt基因。
1.1.3 向日葵组织培养及农杆菌转化所用培养基
向日葵下胚轴组织培养及农杆菌转化所用培养基,其成分见表1。

表1 向日葵下胚轴组织培养及农杆菌转化所用培养基
1.2 试验设计
1.2.1 潮霉素适宜筛选浓度试验
将3个向日葵品种的下胚轴作为外植体,接种到含潮霉素分别为0、5、10、15、20mg/L的诱导培养基上培养,每一梯度每一品种接种外植体数10,各4次重复。2~3周后调查下胚轴的分化情况。
1.2.2 影响农杆菌转化因素试验
实验中设置共培养时间、侵染时间、农杆菌菌液浓度和干燥时间4个因子试验,共培养时间设置5个处理 (1、2、3、4、5d);侵染时间设5个梯度 (1、5、10、15、20min);农杆菌菌液浓度A600值分别为0.3、0.6、0.9、1.2;干燥处理时间为0、4、8h,干燥处理方法:将切割好的下胚轴放置在铺有滤纸的培养皿中,在工作台里放置,让其自然干燥。以上每一梯度接种外植体数为48个。
1.2.3 试验结果的调查与数据处理
外植体接种到含不同浓度的Hyg培养基上培养3周后调查下胚轴的芽诱导情况,并统计不定芽率,不定芽率 (%)=发生不定芽的外植体数/接种的外植体数×100;侵染的外植体在脱菌筛选培养基上培养2~3周后,调查产生抗性芽的外植体数,计算抗性芽诱导率,抗性芽诱导率 (%)=抗性芽的外植体数/侵染的外植体数×100;抗性芽诱导率用SSPS(13.0版本)软件进行方差分析与显著性测验。
1.3 植物材料的培养
取3个品种向日葵的种子,挑选粒大饱满的在超净工作台上先用75%酒精浸泡1~2min,无菌水冲洗1~2次,然后用无菌水浸泡12h,再用0.1%升汞溶液浸泡10min,用无菌水冲洗3~4次,然后取出向日葵籽仁接种到发芽培养基上,于25℃、无光照条件下培养。当苗龄2~3d左右时,取无菌苗的下胚轴作为外植体用于转化。
1.4 脱菌筛选培养
共培养3d后,将向日葵下胚轴转移到脱菌筛选培养基上,诱导抗性芽的产生。每天光照16h,温度25℃,每15~20d天继代一次,头孢霉素浓度由300mg/L逐渐降低,以抑制住农杆菌的生长为宜。筛选压Hyg浓度由高到低,10~5mg/L。培养时以未作转化的材料为对照。由于具有Hyg抗性的下胚轴在筛选培养基上能正常生长,并且在下胚轴处分化出绿色芽,而非抗性的小芽逐渐黄化、死亡。
1.5 抗性植株PCR检测
PCR扩增的引物分别为:引物1:5'—GAA TTC ATG TCT ATT TGT ACG CTA TGG GTT GTT—3',引物2:5'—GC GGC CGC TCA TGT TTG GGG TAT CAT AAA AGA—3'。按王关林的SDS方法提取植物基因组DNA,分别从抗性植株和未转化对照植株叶片提取DNA作为模板,按94℃预变性3min;94℃变性1min;61℃退火1min;72℃延伸1min。重复30个循环。最后72℃延伸11min的程序进行PCR扩增,质粒为阳性对照,未转化对照植株DNA为阴性对照。PCR反应体系为25μL,模板DNA为1μL。扩增结束后,取5μL PCR产物用0.8%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 筛选剂潮霉素浓度的确定
从图1可以看出,3种基因型(HA300、NC208和诺杂212)向日葵下胚轴对潮霉素的敏感性相似,均随着潮霉素浓度的增加,出芽率呈下降趋势。无潮霉素时芽的诱导率为68.9%,而当加入不同浓度的潮霉素后对向日葵下胚轴芽的诱导却有明显的抑制作用,当潮霉素浓度为15mg/L时,不定芽诱导率降为1.97%,且外植体开始变白、变褐并萎缩。对不同潮霉素浓度和向日葵品种的出芽率进行了方差分析可知,下胚轴出芽率在潮霉素的不同浓度处理间存在极显著差异 (F=247.2>F0.01=7.01)。10mg/L潮霉素时,下胚轴出芽率极显著地低于对照,基本上完全抑制不定芽形成。因此,在遗传转化时,以10mg/L潮霉素作为选择压力。
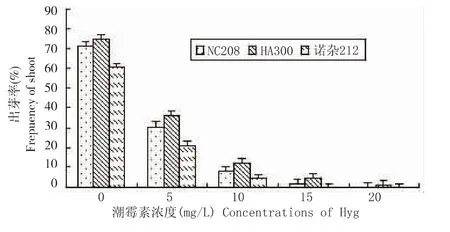
图1 不同潮霉素浓度对向日葵下胚轴诱导率的影响
2.2 共培养时间对抗性芽率的影响
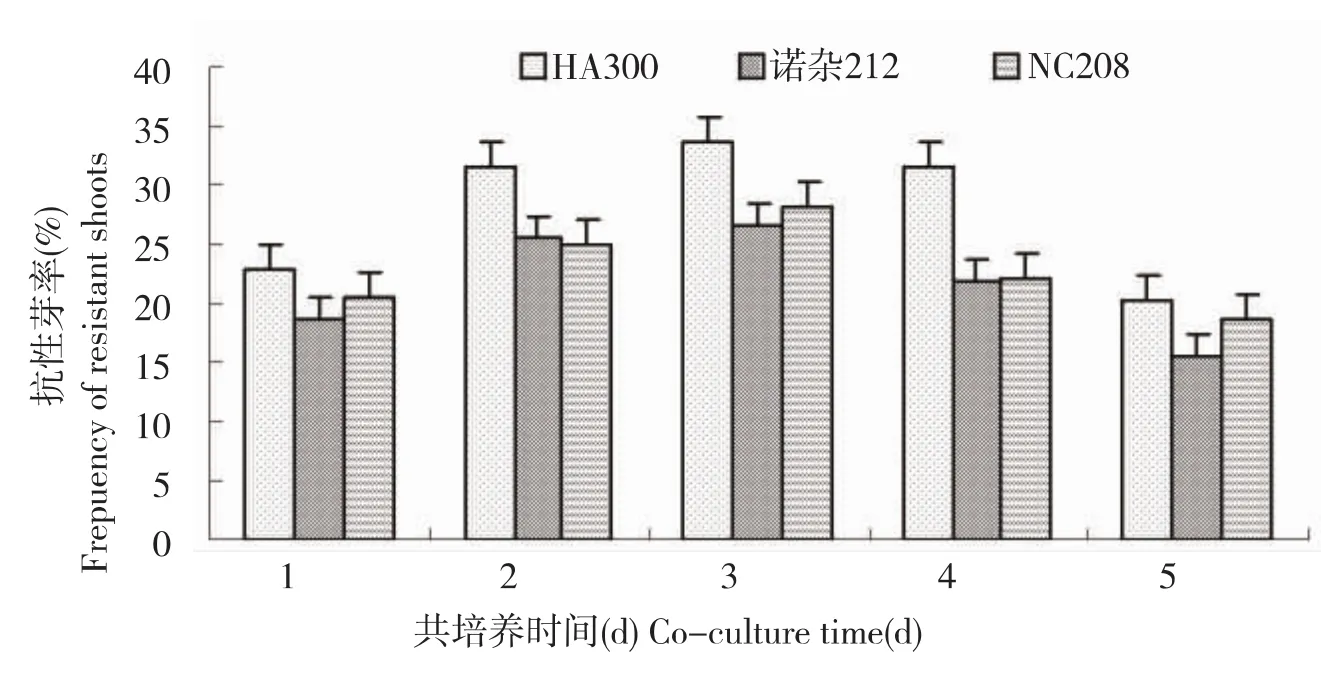
图2 共培养时间对向日葵子叶节抗性芽率的影响
农杆菌侵染下胚轴后共培养时间试验结果见图2。由图2可知,共培养时间对下胚轴抗性芽率的影响存在显著差异,共培养时间3d的较1d的抗性芽率HA300提高了11.0%、诺杂212提高了7.8%、NC208提高了7.6%,3d的较5d的抗性芽率HA300 高 11.5%、 诺 杂 212 高11.0%、NC208高9.3%,且5个处理以共培养时间3d的抗性芽率最高。因此,确定向日葵下胚轴农杆菌侵染后适宜的共培养时间为3d。
2.3 侵染时间对向日葵抗性芽诱导率的影响
在农杆菌介导的遗传转化中,菌液的浸染时间对转化有一定的影响。农杆菌侵染时间试验结果 (图3)表明,农杆菌对HA300、NC208和诺杂212向日葵的下胚轴的侵染时间不同,下胚轴抗性芽率也存在差异,3个品种下胚轴的侵染时间以10min的抗性芽率最高,且显著地高于1min和20min两个处理。因此,确定农杆菌侵染下胚轴的较适宜时间为10min。
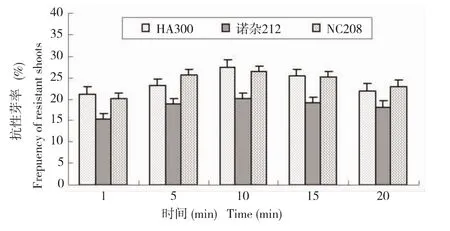
图3 侵染时间对抗性芽率的影响
2.4 重悬液的浓度对抗性芽的影响
以A600为0.3、0.6、0.9和1.2五种浓度的重悬液分别侵染向日葵HA300、NC208和诺杂212的下胚轴,5周之后调查抗性芽率 (图4)。由图4可知,当菌液浓度达到0.6时,抗性芽率最高,随着重悬液浓度的增加抗性芽率而减少。对不同重悬液浓度进行方差分析结果表明,不同重悬液间的抗性芽率存在极显著差异 (F=12.53>F0.01=4.76),但重悬液浓度A600为0.6和0.9之间的下胚轴抗性芽率差异不显著。在试验中还发现,当重悬液浓度增加时,虽然侵染机率很大,但是下一步抑菌工作带来很大困难,而且对植物细胞的伤害也很大,导致相当一部分细胞褐化、失去再生能力或死亡。因此我们选择A600为0.6为侵染时所用重悬液浓度。
2.5 外植体干燥处理对抗性芽率的影响
细胞渗透压的改变可以影响转化效果,研究者通过添加甘露醇或山梨醇来改变植物细胞的渗透压,来提高转化效率。但通过对外植体干燥处理还未见报道。本试验对侵染的向日葵下胚轴进行了4h和8h的干燥处理(图5)。由图5可知,向日葵品种HA300和NC208下胚轴4h干燥处理的抗性芽率,较不处理分别提高11.8%和19.6%,较8h处理分别高6.7%和10.7%,说明对预侵染的下胚轴进行适当的干燥处理有助于抗性芽率的提高。
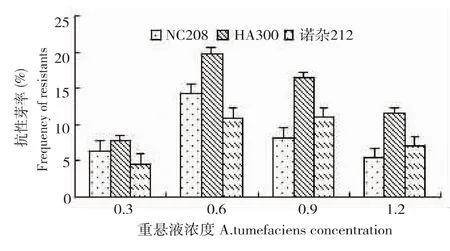
图4 农杆菌重悬菌液浓度对抗性芽率的影响
2.6 抗性苗的PCR检测
从抗性植株和未转化对照植株叶片提取总DNA作为模板进行PCR扩增,未转化苗为阴性对照,质粒为阳性对照,以λDNA/EcoRⅠ+HindⅢ 双酶切DNA分子为标准分子量,电泳结果见图6。图6表明,转基因苗和质粒都在1.3kb附近扩增出特异条带,而阴性对照苗却未扩增出相应的特异条带,由此初步证实,目的基因Psy已转入到向日葵中。本试验共获得向日葵抗性苗126株,经PCR检测得到4株转基因向日葵苗,转化率为3.2%。NC208得到1株,HA300得到3株,诺杂212未得到转化株。
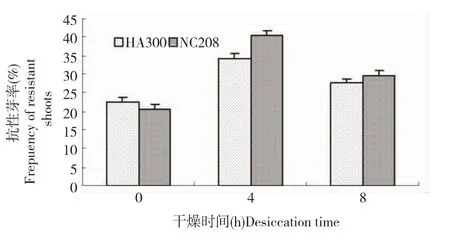
图5 干燥时间对向日葵下胚轴抗性芽率的影响
3 讨 论
3.1 筛选剂对农杆菌转化的影响
遗传转化过程中,重要的一个环节是受体的抗性筛选。通过筛选那些未转化的受体就会死亡,而已转化的受体因有抗性而存活下来。一般的做法是,在继代时去掉褐化或死亡的外植体,但我们在向日葵下胚轴抗性筛选时发现,抗性芽不但从绿色的愈伤组织上长出芽,而且会从褐化非常严重、看上去死亡的愈伤组织上长出,而这些芽很有可能发育成抗性的苗。这可能是由于转化首先是对细胞的转化,而不是组织;表现褐化的愈伤组织,是大多数的细胞死亡了,而个别抗性细胞仍还活着,只是被大量的褐化细胞包围而难于生长。一旦去掉筛选剂,这些抗性细胞便进行生长发育,进而分化成苗。因此,褐化的下胚轴不要过早地丢弃。本实验研究结果表明,不同的基因型对潮霉素的敏感性确实存在差别,潮霉素使用浓度为10mg/L最佳。此外,潮霉素的使用方式如筛选压浓度宜由低到高还是由高到低,仍需进一步探索。

图6 向日葵下胚轴遗传转化的PCR检测
3.2 共培养时间与侵染时间对农杆菌转化的影响
向日葵下胚轴作为农杆菌转化的受体,由于下胚轴是器官组织,且表面积较小,农杆菌侵染时不易接触到伤口细胞。因此,所需的侵染时间比其它组织,如愈伤、体细胞胚组织等要长。在本试验确定10min为农杆菌侵染下胚轴的较适宜时间。
农杆菌对植物进行转化时,必须在伤口部位存活16h以上,才能进行T-DNA的转移。此期间涉及农杆菌向受伤部位的附着,Vir区基因的诱导活化及T-DNA的转移整合。因此,需要较长的共培养时间,但在实际操作中,共培养时间也不宜太长,如果共培养时间太长,农杆菌过度生长,不仅造成脱菌困难,还会使下胚轴受到毒害,不定芽形成困难或褐化死亡。本试验确定向日葵下胚轴农杆菌侵染的共培养时间为3d。
3.3 外植体干燥处理对农杆菌转化的影响
细胞渗透压的改变可以影响转化效果,研究者通过添加甘露醇或山梨醇来改变植物细胞的渗透压,来提高转化效率。本研究试图通过对下胚轴干燥处理来改变细胞的渗透压,进而提高抗性芽率。试验表明,对下胚轴进行适当的干燥处理有利于抗性芽率的提高。以干燥处理4h的下胚轴为外植体进行遗传转化,下胚轴抗性芽率较不处理有明显的提高。
4 小 结
建立了农杆菌介导的向日葵下胚轴遗传转化体系,适宜的菌液浓度A600为0.6、侵染时间为10min、共培养时间为3d、筛选剂潮霉素的浓度为10mg/L,下胚轴干燥处理时间4h有利于向日葵的遗传转化。
[1]Braun A C.Development of secondary tumors strands in the crown gall of sunflower[J].Phytopathology,1941,31:135-149.
[2]Everett N P,Robinson K E P,Mascarenhas D.Genetic engineering of sunflower(Helianthus annuus L.)[J].Biotechnology,5:1987,1201-1204.
[3]Schrammeijer B,Sijmons P C,van den Elzen P J M,et al.Meristem transformation of sunflower via Agrobacterium[J].Plant Cell Rep,1990,9:55-60.
[4]Knittel N,Gruger V,Hahne G,et al.Transformation of sunflower(Helianthus annuus L.):A reliable protocol[J].Plant Cell Rep,1994,14:81-86.
[5]Grayburn W S,Vick B A.Transformation of sunflower(Helianthus annuus L.)following wounding with glass beads[J].Plant Cell Rep,1995,14:285-289.
[6]Bidney D,Scelonge C,Martich J,et al.Microprojectile bombardment of plant tissues increases transformation frequency by Agrobacterium tumefaciens[J].Plant Mol Biol,1992,18:301-313.
[7]Burrus M,Rousselin P,Knittel N,et al.Transformation of sunflower:an overview of different approaches,their difficulties,how to overcome them,and first results[A].Proceeding 14th International Sunflower Conference[C].Beijing/Shenyang:Sunflower Association,1996:1064-1068.
[8]Escandón AS,Hahne G.Genotype and composition of culture medium are factors important for transformed sunflower(Helianthus annuus L)callus[J].Physiol Plant,1991,1:367-376.
[9]Pugliesi C,Biasini M G,Fambrini M,et al.Genetic transformation by Agrobacterium tumefaciens in the interspecific hybrid Helianthus annuus x Helianthus tuberosus[J].Plant Sci,1993,93:105-115.
[10]Moyne A L,Tagu D,Thor V,et al.Transformation calli obtained by direct gene transfer into sunflower protoplast[J].Plant Cell Rep,1989,8:97-100.
[11]Laparra H,Burrus M,Huonold R,et al.Expression of foreign genes in sunflower(Helianthus annuus L.)evaluation of three gene transfer methods[J].Euphytica,1995,85:63-74.

