2型糖尿病合并非酒精性脂肪性肝病与血清脂联素、瘦素水平的相关研究
陈玉林,李明珍,孙丽荣,张 晓,姜春艳
(1.天津医科大学代谢病医院糖尿病痛风科,卫生部激素与发育重点实验室,天津300070;2.山东省临沂市人民医院内分泌科,临沂276000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其它明确的肝损害因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,包括单纯性脂肪性肝病(non-alcoholic fatty liver,NAFL)以及由其演变的脂肪性肝炎(non-alcoholic steatohepatitis,NASH)和肝硬化,是发达国家最常见的肝病之一[1],也是我国常见的慢性肝病之一,胰岛素抵抗(IR)与其发病关系密切。而2型糖尿病(T2DM)合并NAFLD患病率正在逐年增加,我院住院患者T2DM合并NAFLD的患病率为29.29%[2]。近年来发现瘦素(Leptin)及脂联素(APN)与IR关系密切,国内外对脂联素/瘦素比值(A/L)与T2DM合并NAFLD的相关研究较少。本研究旨在通过观察T2DM合并NAFLD患者中APN、Leptin和A/L的变化,探讨其在T2DM合并NAFLD发病机制中的作用。
1 资料与方法
1.1 一般资料 选择2011年4月至2012年2月我院的T2DM住院患者117例,其中男性65例,女性 52例,年龄 30~77岁,平均年龄(54.83±7.87)岁,其中合并NAFLD 59例(T2DM+NAFLD组),不合并NAFLD的T2DM 58例(T2DM组)。另选我院体检中心健康体检无DM及NAFLD正常对照者55例(NC组),其中男性25例,女性30例,年龄35~84岁,平均年龄(53.85±8.81)岁,年龄、性别与病例组匹配。糖尿病符合1999年WHO糖尿病诊断标准。NAFLD由专业医师行彩超根据2006年中华医学会肝病学分会制定的标准诊断。入选者排除严重的肝、肾功能损害及恶性肿瘤,排除病毒性肝病、酒精性肝病,排除自身免疫性及遗传性、药物性肝病,排除胆道梗阻、严重的糖尿病急慢性并发症等。
1.2 方法
1.2.1 临床资料收集 由专人负责测定身高、体质量、腰围、臀围,受试者脱鞋、免冠,分别以kg、m为单位记录,腰围取腋中线肋弓下缘平髂前上棘连线中点水平面周径,臀围取臀部最突点水平面周径。计算体质量指数(BMI)和腰臀比(WHR)。BMI=体质量/身高(kg/m2),WHR=腰围/臀围。记录所有 T2DM患者降糖、降压、降脂方案。
1.2.2 血标本采集 采血前低脂饮食3 d,隔夜空腹8~12 h,采集肘静脉血,血样注入非抗凝管中,室温静置20~30min后,分离血清,分别留取血清冻存于-80℃冰箱内,待测APN、Leptin和空腹胰岛素(FPI)浓度,其余血清用于测定FPG、血脂、肝功能。
1.2.3 实验室指标测定 (1)日立7070型全自动生化分析仪测定 FPG、血脂(TC、TG、HDL-c、LDL-c)、肝功能(ALT、AST、ALP、GGT)。FPI用放射免疫分析法测定。(2)血清APN和Leptin测定采用ELISA测定,APN试剂盒购自北京奇松生物科技有限公司,线性检测范围0~32μg/mL,板内、板间变异系数均<10%;Leptin试剂盒购自北京翰科恒誉生物科技有限公司,线性检测范围0~16μg/L,批内、批间变异系数均<15%。(3)稳态模型评估法评估IR,HOMA-IR=FPG(mmol/L)×FPI(m IU/L)/22.5。(4)计算A/L比值。
1.2.4 腹部彩超 由专业影像医师采用LOGI7型彩色超声诊断仪(美国GE公司)对所有受试者进行腹部B超检查,诊断脂肪肝。
1.3 统计学处理 采用SPSS18.0进行统计学分析。计量资料均以x±s表示,并进行正态性和方差齐性检验。正态分布数据或经转换后服从正态分布的数据,两组间指标比较采用t检验,多组间APN及Leptin比较采用协方差分析,多组间其它指标比较采用单因素方差分析(ANOVA),指标的两两比较采用LSD法;率的比较应用pearsonχ2检验。偏态分布数据采用秩和检验分析。多因素分析采用多元逐步回归分析和二分类Logistic回归。P<0.05为差异有统计学意义。
2 结果
2.1 各组临床资料的比较 见表1。各组间年龄、性别、ALP、GGT、Leptin 差异无统计学意义(P>0.05)。与对照组相比,T2DM患者(包括合并NAFLD者)的WHR、SBP、HbA1c、LDL-c、FPG、FPI 和 HOMA-IR均升高(P<0.05或 P<0.01),APN 和 A/L均降低(P<0.01);合并 NAFLD 的 T2DM 患者 DBP、ALT、TC 水平均高于对照组(P<0.01),而 BMI、AST、TG、FPI均高于对照组和单纯 T2DM 患者(P<0.05、P<0.01),HDL-c、APN和A/L水平低于对照组和单纯T2DM患者(P<0.01)。
表1 各组临床生化资料比较Tab1 Comparison ofbiochem icalcharacteristicsamong groups

表1 各组临床生化资料比较Tab1 Comparison ofbiochem icalcharacteristicsamong groups
与 NC 组比较 #P<0.01,*P<0.05;与 T2DM 组比较△P<0.05,▲P<0.01
组别NC T2DM NAFLD+T2DM病程/年-7.25±5.58 7.13±6.12年龄/岁53.85±8.81 55.09±7.52 54.58±8.27例数(男/女)/n 55(25/30)58(34/24)59(31/28)BMI/(kg/m2)24.38±3.38 25.54±3.10 27.80±3.54#▲DBP/(mmHg)77.92±9.45 80.05±10.89 84.73±10.02#△SBP/(mmHg)122.58±16.04 134.06±19.98#134.15±22.58#WHR 0.88±0.05 0.93±0.05#0.93±0.10#组别NC T2DM NAFLD+T2DM A/L 3.11±0.67 1.60±0.86#1.02±0.53#▲Leptin/(μg/L)7.99±2.41 8.52±2.71 8.24±2.67 APN/(mg/L)24.12±6.98 12.52±4.17#7.92±3.47#▲HbA1c/%-8.77±2.22 8.53±2.11 ALP/(IU/L)68.90±24.50 77.49±27.30 76.85±22.40 AST/(IU/L)19.14±5.87 19.98±8.89 24.05±11.21#△ALT/(IU/L)18.29±9.63 22.75±13.13 27.80±12.80#GGT/(IU/L)27.56±33.70 29.90±35.80 39.64±33.52组别NC T2DM NAFLD+T2DM HDL-c/(mmol/L)1.47±0.40 1.31±0.25#1.18±0.19#△TC/(mmol/L)4.93±0.95 5.14±1.02 5.48±0.95#TG/(mmol/L)1.35±0.68 1.83±0.97#2.48±0.87#▲LDL-c/(mmol/L)3.07±0.88 3.47±0.83*3.50±0.89#HOMA-IR 1.85±1.25 4.03±3.30#4.57±2.58#FPI/(m IU/L)7.78±5.03 11.52±10.02*13.54±8.42#FPG/(mmol/L)5.26±0.58 8.22±2.47#7.92±2.32#
2.2 用药情况 T2DM合并NAFLD与单纯T2DM患者均应用磺脲类、双胍类、噻唑烷二酮类(TZDs)、他汀类、β受体阻滞剂、血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体阻滞剂(ARB)药物进行降糖、降压和调脂治疗,两组差异没有统计学意义(P>0.05)。合并NAFLD的T2DM患者应用贝特类降低TG,明显多于单纯T2DM组(P<0.01)。见表2。

表2 T2DM患者降糖降压降脂用药情况χ2检验Tab2 Theχ2 testofmedication for hyperglycem ia,hypertension and hyperlipidem ia in patientswith T2DM
2.3 回归分析 多元逐步回归分析得到的回归方程:Y(APN)=18.64-0.265(病程)-0.19(FPG)+3.198(HDL-c),R2=0.52,Y (HOMA-IR)=2.184+0.242(BMI)-0.273(APN),R2=0.179,表明 FPG、病程和HDL-c是APN水平的主要影响因素,而BMI、APN是胰岛素抵抗HOMA-IR的预测因子,A/L未能进入回归方程。在糖尿病组(包括T2DM+NAFLD组和T2DM组),以有无NAFLD(无 NAFLD为 0,有NAFLD为1)为因变量,上述指标为自变量,进行二分类Logistic回归分析表明TG是T2DM合并NAFLD的危险因素,APN是其保护因素。见表3。
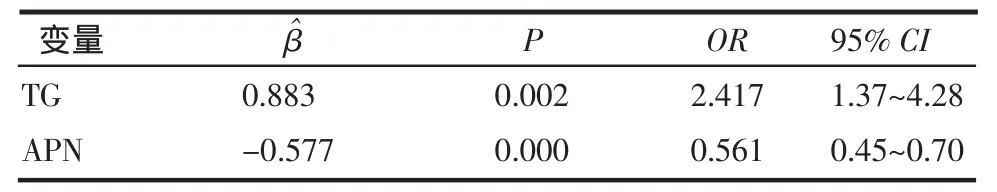
表3 Logistic回归分析T2DM合并NAFLD的独立危险因素Tab3 The independent risk factors for T2DM with NAFLD in Logistic regression analysis
3 讨论
最新研究表明NAFLD可以作为代谢综合征的一部分,被认为在非肥胖和非糖尿病的人群中,与IR密切相关[3]。本研究结果提示:(1)T2DM合并NAFLD者存在体型肥胖、血压(DBP)升高、脂代谢紊乱(TG升高和HDL-c下降),肝转氨酶高于正常对照组(尽管仍在正常范围),存在IR;(2)T2DM合并NAFLD患者基础胰岛素水平高于单纯T2DM患者,其HOMA-IR较单纯T2DM组有升高的趋势,但差异未达统计学意义,提示两组间的IR程度并无大的差异,可能与两组糖尿病病程相近,病情控制相似有关,也可能与T2DM合并NAFLD组脂肪肝程度较轻有关。尽管Leptin水平没有改变,但是血清APN水平明显低于正常对照组及T2DM组。
APN是脂肪组织特异性分泌的一种胶原样细胞因子,主要生理作用为减轻体质量、调节糖代谢和抗动脉粥样硬化等[4]。我们发现,合并NAFLD的T2DM患者血清APN水平明显低于正常对照组和T2DM组,这与Pagano[5]的研究结果一致。血清APN水平降低在肥胖早期即可出现,在发生2型糖尿病后继续降低,提示血清APN水平降低与IR发生和发展密切相关[6]。IR又加重机体糖脂代谢紊乱,引起肝脏脂肪沉积。当NAFLD合并2型糖尿病或代谢综合征时IR更为严重,APN水平更低[7]。TNF-α、IL-6等炎症因子是APN分泌拮抗剂,能抑制APN的表达[8],NAFLD时肝脏能分泌大量的炎症因子,这些炎症因子的增加也成为脂联素进一步减少的重要因素。低APN血症可能导致血管内皮功能障碍,引起动脉硬化,导致高血压病的发生,并将导致肝细胞炎症反应。多因素回归分析显示FPG、病程和HDL-c是APN水平的独立预测因子,提示APN在长期慢性高血糖、低HDL-c人群中分泌明显减少。而希腊学者也发现HDL-c与APN水平呈明显正相关[9]。
研究显示,临床常用的磺脲类、双胍类及TZDs降糖药物[10]、他汀类及贝特类降脂药物[11]以及ARB/ACEI降压药物[12]的应用可能会增加血循环中APN的含量。我们同时记录并分析了所有糖尿病患者的用药方案,发现合并NAFLD组患者由于存在明显的高甘油三酯血症,因此较多应用贝特类降脂药,与单纯T2DM组比较差异有统计学意义,而其他用药情况两组间没有统计学差异,据此推测,由于糖尿病患者应用了上述药物,很可能使血清APN检测值偏高;而他汀和贝特类药物的应用会降低LeptinmRNA及蛋白水平,这可能是3组间Leptin水平未发现差异的原因之一。Pagano等[5]关于APN与NAFLD关系的研究结果显示NAFLD组与对照组相比,APN降低,而Leptin无统计学差异。Nar等[13]研究表明应用胰岛素增敏剂二甲双胍可以改善NAFLD的临床生化指标和超声改变,这也是造成瘦素无差异的原因之一。因此,瘦素在NAFLD的发病机制中的作用尚待明确。
回归分析显示,BMI、APN是胰岛素抵抗HOMA-IR的预测因子,A/L未能进入回归方程。目前国内外对A/L比值的临床意义较为关注。Mirza等[14]通过对367例墨西哥裔美国人的横断面研究显示,A/L可作为一个诊断代谢综合征的高敏感、高特异性的生化指标。但本研究并未发现A/L对IR HOMA-IR的预测作用,可能与研究例数偏少有关。
总之,血清APN水平的变化可能在T2DM合并NAFLD的发生、发展中起一定的作用。应用A/L优于单独用APN或Leptin评估胰岛素抵抗。TG和Leptin是T2DM合并NAFLD的危险因素,而APN是保护因素,因此,APN将是防治NAFLD的新靶点。由于条件所限,本研究未能对脂肪因子与T2DM合并不同严重程度的NAFLD的关系进行进一步研究,这将在今后的工作中加以开展。
[1]Greenfield V,Cheung O,Sanyal A J.Recentadvances in nonalcoholic fatty liver disease[J].Curr Opin Gastroenterol,2008,24(3):320
[2]姜春艳,李明珍,孙丽荣.2型糖尿病合并非酒精性脂肪性肝病患者临床特征及相关因素分析[J].中国慢性病预防与控制,2012,20(2):190
[3]Musso G,Gambino R,Bo S,etal.Should nonalcoholic fatty liver disease be included in the definition of metabolic syndrome?A cross-sectional comparisonwith Adult TreatmentPanel IIIcriteria in nonobese nondiabetic subjects[J].Diabetes Care,2008,31(3):562
[4]Stofkova A.Leptin and adiponectin:from energy and metabolic dysbalancetoinflammationandautoimmunity[J].EndocrRegul,2009,43(4):157
[5]Pagano C,Soardo G,Esposito W,etal.Plasma adiponectin is de creased in nonalcoholic fatty liver disease[J].Eur JEndocrinol,2005,152(1):113
[6]Li Y L,Yang M,Meng X D,etal.The relationship of leptin and adiponectin with insulin resistance in nonalcoholic fatty liver disease[J].ZhonghuaGan Zang Bing Za Zhi,2010,18(6):459
[7]Lee Y S,Cho Y K,Pae JC,etal.The relationship between serum adiponectin level and serum alanine aminotransferase elevation in Korean male with nonalcoholic fatty liver disease[J].Korean J Hepatol,2006,12(2):221
[8]Silfen M E,Manibo AM,McMahon D J,etal.Comparison ofsimplemeasuresof insulin sensitivity in young girlswith premature adrenarche:the fasting glucose to insulin ratiomay be a simple and usefulmeasure[J].JClin EndocrinolMetab,2001,86(6):2863
[9]Christou GA,Tellis KC,ElisafM C,etal.High density lipoprotein is positively correlated with the changes in circulating total adiponectin and highmolecularweightadiponectin during dietary and fenofibrate treatment[J].Hormones(Athens),2012,11(2):178
[10]Kanda Y,Matsuda M,Tawaramoto K,etal.Effects of sulfonylurea drugson adiponectin production from 3T3-L1 adipocytes:implication ofdifferentmechanism from pioglitazone[J].DiabetesRes Clin Pract,2008,81(1):13
[11]Wanders D,Plaisance E P,Judd R L.Pharmacological effects of lipid-lowering drugs on circulating adipokines[J].World JDiabetes,2010,1(4):116
[12]Yilmaz M I,Sonmez A,Caglar K,etal.Effect of antihypertensive agents on plasma adiponectin levels in hypertensive patientswith metabolic syndrome[J].Nephrology(Carlton),2007,12(2):147
[13]Nar A,Gedik O.Theeffectofmetformin on leptin in obese patients with type 2 diabetesmellitus and nonalcoholic fatty liver disease[J].ActaDiabetol,2009,46(2):113
[14]Mirza S,Qu HQ,LiQ,etal.Adiponectin/leptin ratioandmetabolic syndrome in aMexican American population[J].Clin InvestMed,2011,34(5):E290

