Mir-30的研究进展
易 韬
(四川大学华西第二医院 妇科肿瘤生物治疗实验室,成都 610041)
MicroRNAs 家族是一类内源性的非编码小RNA 分子,大多数miRNA 来自于70~90个碱基大小的单链RNA 前体,经过Dicer酶加工后产生成熟的19~25个小核苷酸[1-4],在基因表达的转录后调节中发挥重要作用,参与多种细胞过程,包括信号转导、器官发育、疾病发生、药理和毒理作用等[5]。miRNAs拥有复杂的调节网络,一个miRNA 可以调控多个基因的表达,而多个miRNAs也可以组合来调控某个基因的表达。虽然已经有大量针对miRNA 的研究,但是绝大部分miRNA 的生物学功能仍然有待研究。
miR-30家族是由6个位于人类1,6,和8染色体上的基因编码,包括5 个成员,miR-30a、miR-30b、miR-30c、miR-30d、miR-30e,它们之间的序列同源性非常高。microRNA 5’端2-8个核苷酸被称为种子序列(seed sequence),是靶标结合最关键的位点[6]。种子序列与mRNA 转录目标之间的互补性和mRNA 位点的二级结构是靶向识别的关键因素[7-8]。由于miR-30家族的microRNA 的核苷酸种子序列有较高的保守性和重叠的表达模式,提示miR-30家族在生物功能上可能发挥关键作用(图1)[9]。已查明miR-30的家族成员与成骨细胞分化,脂肪细胞分化,上皮细胞间质转化(EMT),细胞衰老,心肌基质重构和肿瘤相关。
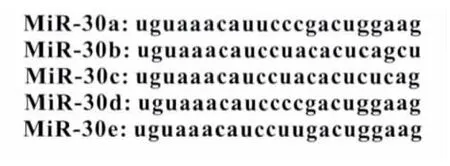
图1 miR-30家族microRNA的核苷酸种子序列的保守性
1 miR-30 与上皮细胞-间充质转化间的关系
上皮细胞-间充质转化(epithelial-mesenchymal transition)简称EMT,是指上皮细胞失去上皮细胞的特征获得典型的间充质细胞特性的变化的生物学过程[10-11](图2)。EMT 在疾病的发病机制过程中通过促进细胞发育和运动来促使新组织类型的产生,其主要的特征有细胞黏附分子减少、细胞角蛋白细胞骨架转化为波形蛋白等,在胚胎发育、慢性炎症、组织重建、癌症转移和多种纤维化疾病中发挥重要作用[12-15]。EMT 包括三种类型。I型EMT 是原始上皮细胞的过渡到能动间充质细胞与胚胎形成过程中的细胞类型多样化及器官形成相关。Ⅰ型EMT 既不引起纤维化也不诱导侵袭发生,并且在许多情况下,所产生的间充质细胞经历MET 后引致次级上皮细胞产生。Ⅱ型EMT 涉及次级上皮细胞向成纤维细胞转变,与伤口愈合,组织再生和器官纤维化相关[16]。Ⅲ型EMT 发生在已经形成的实体瘤和与转移性肿瘤上,是一种与上皮细胞恶性肿瘤相关的表型转化[17]。原发性上皮组织肿瘤细胞通过Ⅲ型EMT 形成具有迁移能力的间充质细胞,随血流转移至不同部位,形成肿瘤转移灶。EMT 的启动依赖许多不同的分子过程包括转录因子的激活,特异性细胞表面蛋白的表达,重组细胞骨架蛋白的表达,ECM 降解酶的产生,以及特定微小RNA 的表达[18]。
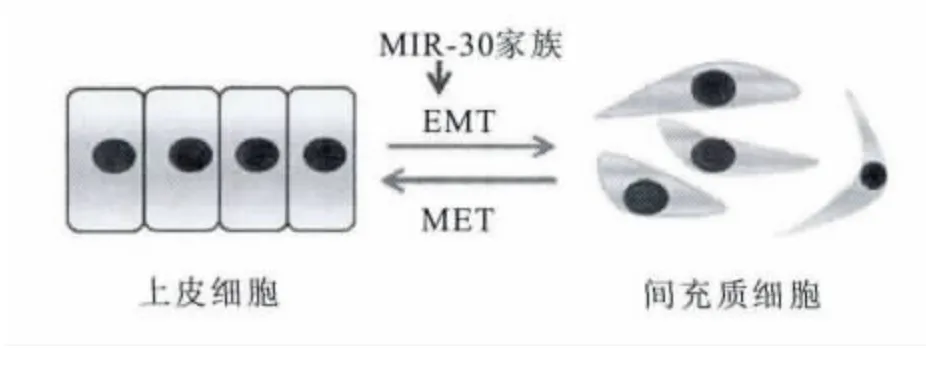
图2 上皮细胞在miR-30家族作用下发生间充质转化
许多上皮向间质转化(EMT)相关的基因被预测为miR-30的靶点。研究发现,miR-30家族水平与人胚胎胰腺上皮细胞间充质表型转化相关[18]。另一方面,在胰岛间充质细胞去分化向产生激素的胰岛样细胞团块发展过程中miR-30家族的miRNA水平提高。根据这些研究结果,使用anti-miRNA去除miR-30导致上皮细胞发现间充质表型转化,而miR-30异位过表达的组织维持上皮细胞表型。此外,研究者发现,miR-30家族的miRNA 靶向间充质的波形蛋白的mRNA 并抑制其翻译[19]。
在心肌肥大过程中miR-30和miR-133对纤维化的作用可以通过下调来影响其靶向的系列ECM mRNA,包括胶原,原纤维蛋白和弹性蛋白mRNA。miR-30靶向转化生长因子(TGF-β)的下游促纤维化的分子-结缔组织生长因子在心肌的细胞外基质结构变化中起重要作用[20]。在肾脏内环境研究中,渗透调节转录因子NFAT5(TonEBP)有三个保守的miR-30的结合位点[21]。同样,大量的溶质载体(SLC)的蛋白质中的mRNA 在它们的3'UTR 端有miR-30的结合位点[22]。通过敲 除miR-30A-5P 确定转录因子Xlim1/Lhx1是miR-30的重要靶标,这个转录因子在老鼠和青蛙肾发育中必需[23]。
miR-30是由致癌信号如表皮生长因子(EGF)和肝细胞生长因子下调,在前列腺癌标本中低表达。这些基因中的ETS相关基因(ERG)是最常见的癌基因。miR-30在前列腺癌细胞中过度表达抑制EMT 表型从而抑制细胞迁移和侵袭。它也能在体外体内抑制依赖于TMPRSS2-ERG 增殖的VCAP细胞的生长[24]。在HT-29 细胞系的上皮-间质转化microRNA 表达研究中发现,HT-29经过TGF-β处理后建立EMT 模型,通过实时定量PCR分析,miR-30水平明显下调[25]。
miR-30也参与肝细胞的EMT 过程。研究发现,TGF-β1 诱导的EMT 过程在AML12小鼠肝细胞中当锌指转录因子SNAIL1的表达增加时,miR-30的表达显著下调。通过计算microRNA 靶标预测到SNAIL1 的mRNA 的3′UTR 区域有一个与miR-30保守序列匹配的位点。研究结果证实miR–30通过与SNAIL1的预测位点结合产生负反应调节。更重要的是,通过细胞形态的变化和SNAIL1的表达谱,E-cadherin和其他纤维母细胞标记物评估发现用miR-30b的化学合成物转染细胞能显著抑制TGF-β1诱导的EMT 过程[26]。
在对甲状腺癌研究中发现miR-200和miR-30的下降可明确区分乳头和滤泡来源的甲状腺癌。ATC来源的间充质细胞中这些microRNA 的表达通过调节MET 标志物蛋白的表达减少其入侵和诱导间充质上皮转化(MET)。ATC 源性细胞miR-30和/或miR-200成员控 制Smad2 和TGFBR1 的 表达的上调从而调节转化生长因子TGF-β 信号在MET/EMT 中的作用[27]。
2 miR-30与肿瘤的关系
研究者对4419例人体样本(3312例癌症,1107例良性肿瘤)microRNA(miRNA)进行了详细分析,研究了miRNA 表达谱,其中包括50种正常组织和51 种癌症组织。良性肿瘤和癌症microRNA 网络显示MIR-30处于网络中心作用最为突出[28](图3)。
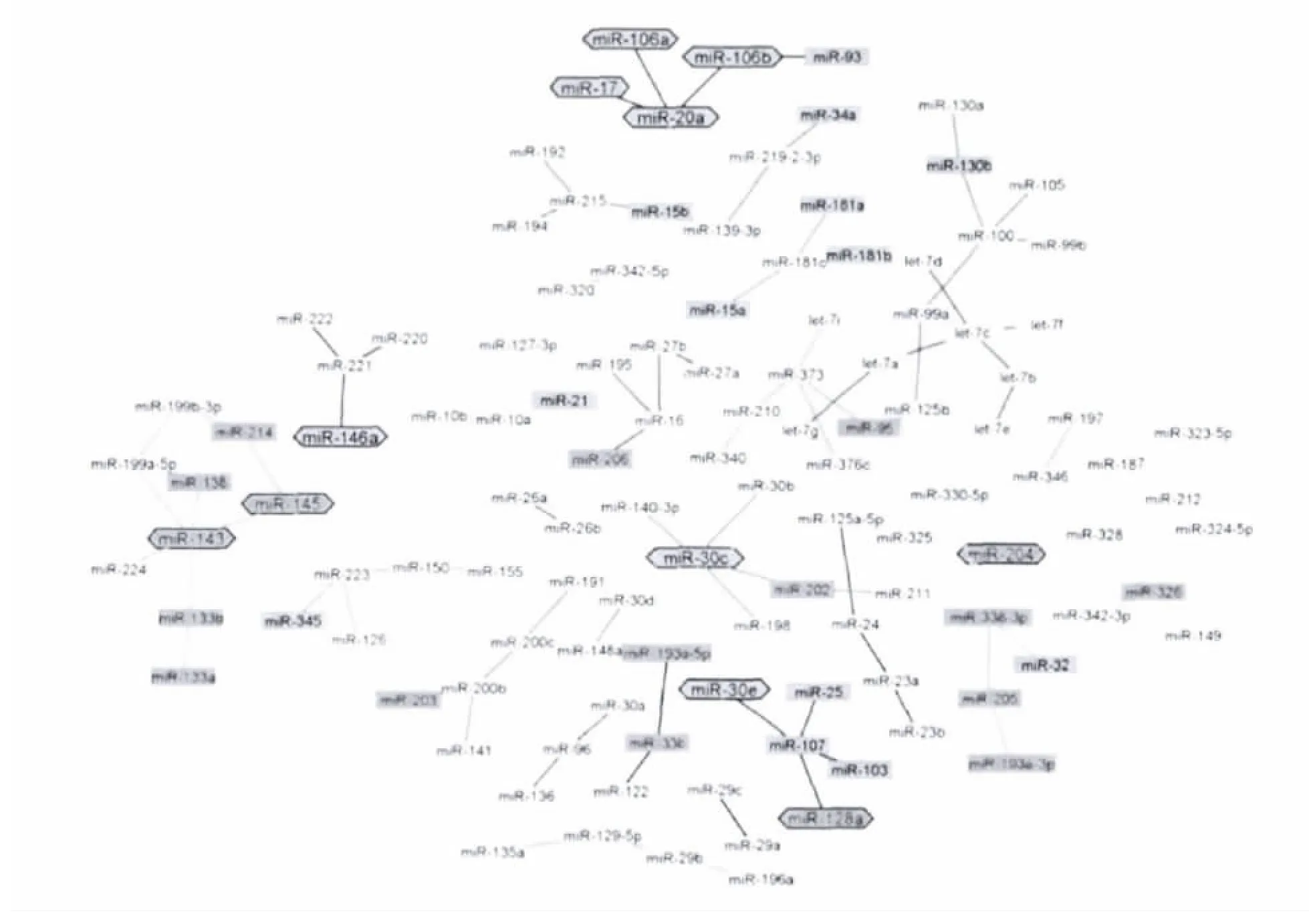
图3 miR-30处于miRcroRNA网络中心调控位置摘自Genome Res,2010,20(5):589-99
最近的研究显示miR-30的表达与肿瘤之间关系密切,miR-30被认为是乳腺癌,膀胱癌,结肠癌和肺癌转移的标志[29]。事实上miR-30c的表达已被建议作为内分泌治疗雌激素受体阳性乳腺癌的预测因子[30]。miR-30家族成员在雌激素受体和孕激素受体阴性的肿瘤都是下调,这表明miR-30的表达是通过这些激素调节[31]。miR-30家族调节乳腺癌细胞在非粘附条件下生长。研究发现非粘附条件下生长的亲代乳腺癌细胞miRNA表达中miR-30 低表达。进一步的研究表明主要是miR-30a通过调节凋亡和增殖相关基因的表达来控制肿瘤细胞非粘附性生长。抗凋亡蛋白AVEN能部分逆转miR-30a过表达的影响。而miR-30a的体内的过表达可以降低乳腺肿瘤的发展趋势[32]。
DLL4属于Notch 信号家族膜结合配体,在肿瘤血管发生和发展过程中起基础性作用[33-34]。在血管生成的体外模型中,miR-30b在内皮细胞中过表达导致新生血管数量和长度增加。在斑马鱼胚胎显微注射miR-30b化学合成物造成DLL4抑制导致节间血管过度萌发和背主动脉直径的减少。对DLL43′-UTR端使用靶点保护拮抗miR-30结合导致DLL4上调,与VEGFA信号通路敲除协同作用可抑制新生血管生成[35]。另有研究报道miR-30a的表达通过刺激顶端细胞导致节间动脉的分支增加。在体外和体内实验中发现miR-30a直接靶向Notch配体Dll4。在人类内皮细胞中,miR-30a下调将增加DLL4蛋白质水平激活Notch信号通路导致HEY2和EFNB2(和ephrin-B2)的表达。miR-30b可以通过靶向DLL4调节血管生成[36]。
研究表明,在TRAIL-耐受的神经胶质瘤细胞中,miR-30b/c和miR-21水平升高,这些miRcroRNA通过抑制功能蛋白的表达来抑制TRAIL依赖性凋亡的发生。用miR-21或miR-30b/c处理T98G敏感细胞诱导产生TRAIL耐受。此外,miR-30b/c和miR-21的分别靶向caspase-3和TAp63的mRNA,而这些蛋白质在在人成胶质细胞瘤原代细胞和肺癌细胞TRAIL耐受过程中发挥作用[37]。
细胞衰老是不可逆转的生长过程和主要的抑癌机制。miR-29和miR-30的microRNA家族在诱导细胞衰老过程中上调并激活Rb的途径。miR-29和miR-30和结合B-Myb蛋白3'UTR位点导致BMyb蛋白基因表达被抑制从而导致细胞衰老。在增殖期细胞中,miR-29和miR-30阻遏野生型BMyb蛋白3'UTR,抑制细胞DNA的合成。miR-29和miR-30通过结合到B-Myb蛋白3'UTR结构域激活Rb的途径在细胞衰老中起重要调节作用[38]。
LIN28是一种进化上保守的RNA结合蛋白在肿瘤发生和胚胎干细胞的分化中起重要作用。let-7,miR-125,miR-9,和miR-30与LIN28的表达水平呈负相关。LIN28-阳性的肿瘤细胞与LIN28-阴性的肿瘤细胞相比较,这四个miRNA的表达水平显著降低。研究表明在胚胎干细胞和癌细胞中这四个miRRNA 能直接抑制LIN28表达[39]。
[1]Lee RC,Feinbaum RL,Ambros V:The C.elegans heterochronic gene lin-4encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75:843-854.
[2]Lagos-Quintana M,Rauhut R,Lendeckel W,et al:Identification of novel genes coding for small expressed RNAs[J].Science,2001,294:853-858.
[3]Lee RC,Ambros V:An extensive class of small RNAs in Caenorhabditis elegans[J].Science,2001,294:862-864.
[4]Ambros V:MicroRNA pathways in flies and worms.Growth,death,fat,stress,and timing [J].Cell,2003,113:673-676.
[5]Suh N,Blelloch R:Small RNAs in early mammalian development:from gametes to gastrulation[J].Development,2011,138:1653-1661.
[6]Ambros V,Bartel B,Bartel DP,et al:A uniform system for microRNA annotation[J].RNA,2003,9:277-279.
[7]Hofacker IL:How microRNAs choose their targets[J].Nat Genet,2007,39:1191-1192.
[8]Kertesz M,Iovino N,Unnerstall U,Gaul U,Segal E,et al:The role of site accessibility in microRNA target recognition[J].Nat Genet,2007,39:1278-1284.
[9]Ketley A,Warren A,Holmes E,et al:The miR-30microRNA family targets smoothened to regulate hedgehog signalling in zebrafish early muscle development[J].PLoS One,2013,5;8(6):e65170.
[10]Hay ED:An overview of epithelio-mesenchymal transforma-tion[J].Acta Anat.(Basel),1995,154:8-20.
[11]Kalluri R,Neilson EG:Epithelial-mesenchymal transition and its implications for fibrosis[J].J Clin Invest,2003,112:1776-1784.
[12]Yu F,Yao H,Zhu P,et al:let-7regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007,131:1109-1123.
[13]Yu F,Deng H,Yao H,et al:MiR-30reduction maintains self-renewal and inhibits apoptosis in breast tumor-initiating cells[J].Oncogene,2010,29:4194-4204.
[14]Lee JM,Dedhar S,Kalluri R,et al:The epithelial-mesenchymal transition:new insights in signaling,development and disease[J].J Cell Biol,2006,172:973-81.
[15]Kalluri R:EMT:when epithelial cells decide to become mesenchymal-like cells[J].J Clin Invest,2009;119:1417-1419.
[16]Zeisberg M,Bottiglio C,Kumar N,et al:Bone morphogenic protein-7inhibits progression of chronic renal fibrosis associated with two genetic mouse models[J].AM J PHYSIOL,2003,285(6):F1060-F1067.
[17]López-Nouoa JM,Nieto MA:Inflammation and EMT:an alliance towards organ fibrosis and cancer progression[J].EMBO,2009,1(6-7):303-314.
[18]Kalluri R,Weinberg RA:The basics of epithelial-mesenchymal transition[J].J Clin Invest,2009,119(6):1420-1428.
[19]Joglekar MV,Patil D,Joglekar VM,et al:The miR-30family microRNAs confer epithelial phenotype to human pancreatic cells[J].Islets,2009,1:137-147.
[20]Duisters RF,Tijsen AJ,Schroen B,et al:MiR-133and miR-30Regulate connective tissue growth factor:implications for a role of micrornas in myocardial matrix remodeling[J].CIRC RES,2009,104(2):170-178.
[21]Ho SN:Intracellular water homeostasis and the mammalian cellular osmotic stress response[J].J Cell Physiol,2006,206:9-15.
[22]He L,Vasiliou K,Nebert DW:Analysis and update of the human solute carrier(SLC)gene superfamily[J].Hum Genomics,2009,3:195-206.
[23]Agrawal R,Tran U,Wessely O:The miR-30miRNA family regulates Xenopus pronephros development and targets the transcription factor Xlim1/Lhx1[J].Development,2009,136(23):3927-3936.
[24]Kao CJ,Martiniez A,Shi XB,et al:miR-30as a tumor suppressor connects EGF/Src signal to ERG and EMT[J].Oncogene,2013,3.
[25]Zhang H,Zhou YY,Wu HB,Xu XP:Aberrant expression of microRNAs involved in epithelial-mesenchymal transition of HT-29cell line[J].Cell Biol Int,2013,37(7):669-74.
[26]Zhang J,Zhang H,Liu J,et al:miR-30inhibits TGF-β1-induced epithelial-to-mesenchymal transition in hepatocyte by targeting Snail1.Biochem Biophys Res Commun,2012,417(3):1100-1105.
[27]Braun J,Hoang VuC,Dralle H et al:Downregulation of microRNAs directs the EMT and invasive potential of anaplastic thyroid carcinomas[J].Oncogene.2010Jul 22;29(29):4237-4244.
[28]Volinia S,Galasso M,Costinean S,et al:Reprogramming of miRNA networks in cancer and leukemia[J].Genome Res,2010,20(5):589-599.
[29]Baffa R,Fassan M,Volinia S,et al:MicroRNA expression profiling of human metastatic cancers identifies cancer gene targets[J].J Pathol,2009,219:214-221.
[30]Rodriguez-Gonzalez FG,Sieuwerts AM,Smid M,et al:MicroRNA-30cexpression level is an independent predictor of clinical benefit of endocrine therapy in advanced estrogen receptor positive breast cancer[J].Breast Cancer Res Treat,2011,127:43-51.
[31]Iorio MV,Ferracin M,Liu C,et al:MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65:7065–7070.
[32]Ouzounova M,Vuong T,Ancey PB,et al:MicroRNA miR-30family regulates non-attachment growth of breast cancer cells[J].BMC Genomics,2013,14:139.
[33]Raphael K,Gridley T:Notch signaling in the vasculature.In:Raphael K,editor.Current Topics in Developmental Biology Notch Signaling.Vol 92.Waltham,MA:Academic Press;2010.p.277-309.
[34]Phng LK,Gerhardt H:Angiogenesis:a team effort coordinated by Notch[J].Dev Cell,2009,16(2):196-208.
[35]Bridge G,Monteiro R,Henderson S,et al:The microRNA-30family targets DLL4to modulate endothelial cell behavior during angiogenesis[J].Blood,2012,13,120(25):5063-5072.
[36]Jiang Q,Lagos-Quintana M,Liu D,et al:miR-30aregulates endothelial tip cell formation and arteriolar branching [J].Hypertension,2013,62(3):592-598.
[37]Quintavalle C,Donnarumma E,Iaboni M,et al:Effect of miR-21and miR-30b/c on TRAIL-induced apoptosis in glioma cells[J].Oncogene,2013,32(34):4001-4008.
[38]Martinez I,Cazalla D,Almstead LL,et al:miR-29and miR-30regulate B-Myb expression during cellular senescenc[J]e.Proc Natl Acad Sci U S A,2011,108(2):522-527.
[39]Zhong X,Li N,Liang S,et al:Identification of microRNAs regulating reprogramming factor LIN28in embryonic stem cells and cancer cells[J].J Biol Chem,2010,285(53):41961-41971.

