六水合氯化铝在不同氯化物体系中的溶解度现象研究*
崔慧霞,程文婷,郭彦霞,程芳琴
(山西大学资源与环境工程研究所,环境与资源学院,国家环境保护煤炭废弃物资源化高效利用技术重点实验室,山西太原 030006)
六水合氯化铝(AlCl3·6H2O)是一种较为常见的无机化合物,它在水处理及催化剂制备等行业具有广泛用途,同时也是制备聚合氯化铝絮凝剂[1-4]的原料。近年来,常采用酸溶法利用煤矸石、粉煤灰、铝矾土制取铝系列产品[5]。酸浸提取出氧化铝后需通过结晶工序得到AlCl3·6H2O。采用盐酸从废渣中浸出AlCl3·6H2O 的同时也会使 NaCl、KCl等电解质浸出,导致AlCl3·6H2O在结晶过程中出现KCl、NaCl等杂盐的夹带现象。因此有必要研究AlCl3·6H2O在NaCl、KCl、HCl溶液中的溶解度现象,并探索煤矸石等矿物提取AlCl3·6H2O的工艺条件。
关于AlCl3·6H2O溶解度数据的相关报道较少。Fátima Farelo 等[6]测定了 25~70 ℃下 AlCl3·6H2O 分别 在 H2O、NaCl、KCl 溶 液 (NaCl 浓 度 为 0.086~0.230 mol/kg,KCl浓度为 0.191~0.914 mol/kg)中的溶解度,R.R.Brown 等[7]测定了 25、45、65、85 ℃条件下 AlCl3·6H2O 在 HCl溶液(浓度为 0~17 mol/kg)中的溶解度数据。然而测定的数据大多为单点数据,且数量较少,较难体现系统规律性,对于工业生产中组分多变的情况难以准确调控。笔者通过预测AlCl3·6H2O在不同氯化物体系中的溶解度,分析结晶的难易程度,同时将溶解度数据作为控制溶液过饱和度的依据,为结晶过程的控制和优化提供技术支撑。
1 活度系数模型建立
常用的电解质溶液的活度系数模型有Pitzer方程、Meissmer方程、Bromley方程、NRTL 模型、MSE模型。这些模型有各自适用的体系,Bromley模型是应用较为广泛的活度系数模型之一,适用于多组分电解质水溶液体系的预测,具有适用浓度范围宽,预测性较好的优点[8]。彭小奇等[9]基于该模型成功计算了NaOH-NaAl(OH)4-H2O体系活度因子。J.F.Zemaitis通过修正Bromley方程的经验参数后得到Bromley-Zemaitis 模型[10-11],该模型适用于温度为0~200℃、电解质溶液浓度为0~30 mol/L的体系。J.M.Casas等[12]用 Bromley-Zemaitis方程计算了Al2(SO4)3-MgSO4-H2SO4-H2O 溶 液系统中各离子的活度系数,最终预测了 Al2(SO4)3和 MgSO4在H2SO4-H2O二元体系中的溶解度,预测结果与实验结果吻合良好。在煤矸石酸浸液中AlCl3·6H2O结晶的温度区间(0~100℃)及电解质溶液的浓度(0~17 mol/kg)均与Bromley-Zemaitis模型的适用范围相符。
当AlCl3·6H2O在溶液中结晶析出时,会发生如下的化学平衡:
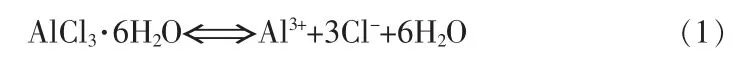
溶液中相应离子的浓度必须满足:
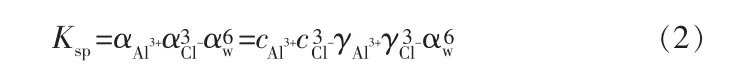
式中,Ksp为沉淀平衡常数;αw分别为 Al3+、、H2O 的活度(有效浓度),mol/L分别为 Al3+、Cl-的浓度,mol/L;分别为 Al3+、Cl-的活度系数。求解晶体的溶解度实际上是解上述的溶度积,即式(2)。用于计算活度系数的模型有很多,笔者选择嵌入OLI软件的Bromley-Zemaitis方程来计算式(2)中的 γ 和 αw。
阳离子i在多元电解质溶液中的Bromley-Zemaitis活度系数模型可由式(3)来表示:
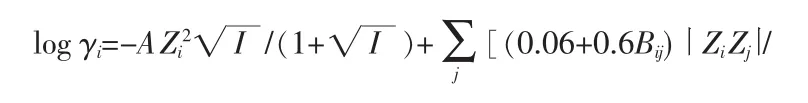

式中,j为溶液中所有的阴离子;A为Debye-Huckel参数;I为溶液的离子强度;B、C和D为与温度相关的经验系数,Bij=B1ij+B2ijT+B3ijT2(T 为温度,℃),C 和D均可使用相似形式的计算式来表示;Zi和Zj分别为阳离子和阴离子的电荷数。需注意的是,对于阴离子在多元电解质溶液中的活度系数,则方程中的i代表阴离子,j代表溶液中所有的阳离子。
通过计算得到离子活度系数的数值后,AlCl3·6H2O的溶解度可由式(2)计算得到。
以OLI软件为平台,用嵌入其中的Bromley-Zemaitis活度系数模型在不增加任何模型参数的前提下对 AlCl3·6H2O 分别在 H2O、NaCl、KCl、HCl溶液中的溶解度进行了预测。并将预测值与文献[6-7]的实验测定值进行了比较。以检验Bromley-Zemaitis模型对于AlCl3·6H2O溶解度预测的可靠性和对实际工业结晶过程的适用性。
2 不同体系的溶解度计算与讨论
2.1 AlCl3·6H2O在H2O溶液体系中的溶解度
图1是利用Bromley-Zemaitis活度系数模型计算的在H2O溶液体系中AlCl3·6H2O溶解度随温度的变化关系。
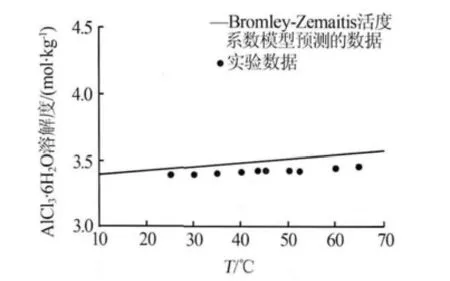
图1 AlCl3·6H2O在H2O中的溶解度
由图1可见,在常压、温度为10~70℃的条件下,AlCl3·6H2O在H2O溶液中的溶解度随温度的升高而增大,但增幅变化并不明显。温度为10℃时AlCl3·6H2O溶解度为3.396 mol/kg,温度升至50℃和70℃时,AlCl3·6H2O溶解度仅分别增至3.521 mol/kg和3.580 mol/kg。在10~70℃区间,溶解度增幅仅为5.4%,由此可知温度对AlCl3·6H2O在H2O中溶解度的影响可忽略。
为了验证该模型对于AlCl3·6H2O溶解度预测的适用性,图 1中也给出了文献[6]中 AlCl3·6H2O在H2O溶液中溶解度的实验数据(散点)。将模拟结果与文献[6]的实验数据相比较,变化趋势基本一致。在35℃和65℃时,AlCl3·6H2O在H2O中溶解度的预测值分别为3.482mol/kg和3.560mol/kg,文献[6]的实验值分别为3.406 mol/kg和3.450 mol/kg。经计算,不同温度下,模型预测值与文献[6]中实验值的相对误差为1.7%~3.1%。该结果表明Bromley-Zemaitis活度系数模型可以预测AlCl3·6H2O在H2O中的溶解度。
2.2 AlCl3·6H2O在NaCl溶液体系中的溶解度
图2是利用Bromley-Zemaitis活度系数模型计算的在NaCl溶液体系中AlCl3·6H2O溶解度随温度(25、40、60 ℃)的变化关系。

图2 AlCl3·6H2O在NaCl溶液中的溶解度
由图2可知,在同一浓度的NaCl溶液中,AlCl3·6H2O的溶解度随温度的升高而略有增加,如在0.1mol/kg的NaCl溶液为中,在25℃和60℃时,AlCl3·6H2O溶解度分别为 3.428 mol/kg和3.523 mol/kg,溶解度增幅为2.8%;而在同一温度下,AlCl3·6H2O的溶解度随着NaCl浓度的增加而减小,但变化也不显著,如在40℃时,0.10 mol/kg和0.25 mol/kg的NaCl溶液中AlCl3·6H2O溶解度分别为3.472 mol/kg和3.435mol/kg,溶解度仅减少1.1%。以上结果表明,NaCl对AlCl3·6H2O在溶液中溶解度的影响可忽略。
图2 中散点是 Fátima Farelo 等[6]得到的 AlCl3·6H2O在NaCl溶液中溶解度的实验数据。通过计算可知,该模型预测的数据与实验数据有较好的一致性。不同温度下,模型预测值与文献实验值的相对误差均很小。25、40、60℃时平均相对误差分别为4.3%、4.7%、2.3%。与文献数据相比,Bromley-Zemaitis活度系数模型较好地预测了AlCl3·6H2O在NaCl溶液中的溶解度。
2.3 AlCl3·6H2O在KCl溶液体系中的溶解度
图3是利用Bromley-Zemaitis活度系数模型计算的在KCl溶液体系中AlCl3·6H2O溶解度随温度(25、30、50、60℃)的变化关系。 由图 3可知,在同一浓度的KCl溶液中,AlCl3·6H2O的溶解度随溶液温度的升高而缓慢增大,如在0.4mol/kg的KCl中,30℃和60℃时AlCl3·6H2O的溶解度分别为3.390 mol/kg和3.473 mol/kg,溶解度增幅为2.4%;在同一温度下,AlCl3·6H2O的溶解度随着KCl浓度的增加而减小,但变化不显著。如在50℃时,0.05 mol/kg和0.25 mol/kg的KCl溶液中AlCl3·6H2O溶解度分别为 3.512 mol/kg和 3.334 mol/kg,溶解度减幅为5.1%。由此可得KCl浓度和溶液温度对AlCl3·6H2O在KCl溶液中溶解度的影响可忽略。
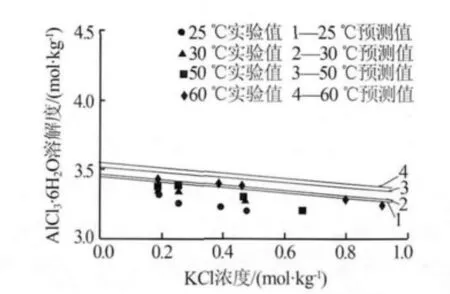
图3 AlCl3·6H2O在KCl溶液中的溶解度
图3 中散点是 Fátima Farelo 等[6]得到的 AlCl3·6H2O在KCl溶液中溶解度的实验数据。通过比较可得,预测的数据与文献数据变化趋势一致,且二者的相对误差不超过5%,如在60℃时,0.189 mol/kg的KCl溶液中AlCl3·6H2O的溶解度预测值为3.512 mol/kg,文献[6]实验值为 3.430 mol/kg,二者相差仅为0.082 mol/kg。即利用Bromley-Zemaitis活度系数模型预测AlCl3·6H2O在KCl溶液中溶解度与文献中的实验值有很好的一致性。
2.4 AlCl3·6H2O在HCl溶液体系中的溶解度
由于酸浸液中含有大量的HCl溶液,而HCl溶液的存在必然影响AlCl3·6H2O的结晶。因此就HCl溶液对AlCl3·6H2O溶解度的影响进行了研究。图4是利用Bromley-Zemaitis活度系数模型计算的在HCl溶液体系中 AlCl3·6H2O 溶解度随温度(25、45、65、85℃)的变化关系。
由图4可知,在同一浓度的HCl溶液中,随着温度的升高AlCl3·6H2O溶解度略有增大,但变化不显著;在相同温度下,AlCl3·6H2O在HCl溶液中的溶解度随着HCl浓度的升高急剧下降。如HCl浓度为10 mol/kg时,25℃和85℃下AlCl3·6H2O的溶解度分别为0.492 mol/kg和0.702 mol/kg,溶解度增幅较小;当盐酸浓度低于6 mol/kg时,不同温度下氯化铝溶解度曲线基本重合。而在25℃时,1.0 mol/kg和16.5 mol/kg的HCl溶液中AlCl3·6H2O溶解度分别为 3.075 mol/kg和 0.013 mol/kg,溶解度减幅为99.6%。由此可知,相同浓度的HCl溶液中温度对AlCl3·6H2O的溶解度影响不显著;而相同温度下,HCl浓度对AlCl3·6H2O溶解度的影响非常显著。
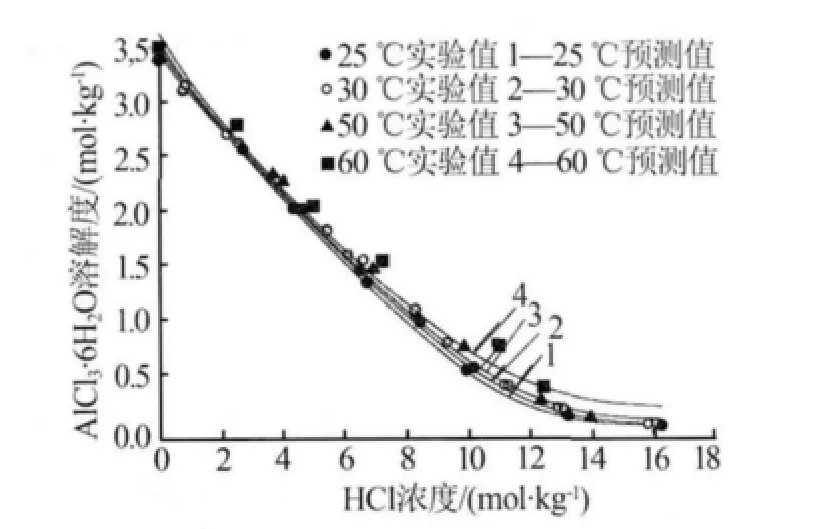
图4 AlCl3·6H2O在HCl溶液中的溶解度
为了验证该模型对于AlCl3·6H2O溶解度预测的适用性,图4给出了文献 [7]中AlCl3·6H2O在HCl溶液中溶解度的实验数据(散点)。预测数据与R.R.Brown等[7]的实验数据对比表明,吻合程度较高,25℃和 45℃时,AlCl3·6H2O 在 0.78 mol/kg HCl溶液中溶解度的文献[7]实验值分别为3.110 mol/kg和3.128 mol/kg,而预测值分别为3.147 mol/kg和3.183 mol/kg,相对误差分别为1.2%和1.7%。当HCl溶液浓度较高时,由于溶解度数值极小,尽管文献值与预测值的差值仍然很小,但计算出的相对偏差会有所增大,只不过平均相对偏差仍不超过10%。这说明Bromley-Zemaitis活度系数模型可以预测AlCl3·6H2O在HCl溶液中溶解度。
3 结论
1)Bromley-Zemaitis活度系数模型适用于预测AlCl3·6H2O 在 H2O、NaCl、KCl、HCl体系中的溶解度,与已有的实验数据相比,相对误差最大不超过10%。2)AlCl3·6H2O的溶解度随着溶液中HCl浓度的增加而减小,可以利用高浓度HCl溶液使AlCl3·6H2O结晶析出,通过模拟预测可以减少实验工作量,为工艺优化提供便利。
[1]Zhao Y X,Gao B Y,Cao B C,et al.Comparison of coagulation behavior and floc characteristics of titanium tetrachloride(TiCl4) and polyaluminum chloride(PACl) with surface water treatment[J].Chemical Engineering Journal,2011,166(2):544-550.
[2]Takaara T,Sano D,Masago Y,et al.Surface-retained organic matter of Microcystis aeruginosa inhibiting coagulation with polyaluminum chloride in drinking water treatment[J].Water Research,2010,44(13):3781-3786.
[3]连明磊,冯权莉.煤矸石制无机高分子絮凝剂进展[J].无机盐工业.2012,44(1):7-9.
[4]Wang D,Tang H,Gregory J.Coagulation behavior of aluminum salts in eutrophic water:significance of Al13species and pH control[J].Environ.Sci.Technol.,2006(40):325-331.
[5]赵丽,张庆,赵明明,等.聚硅氯化铝铁絮凝剂的制备及应用研究[J].无机盐工业, 2012, 43 (7):54-55.
[6]Fátima Farelo,Cristina Fernandes,Antonio Avelino.Solubilities for six ternary systems:NaCl+NH4Cl+H2O,KCl+NH4Cl+H2O,NaCl+LiCl+H2O,KCl+LiCl+H2O,NaCl+AlCl3+H2O,and KCl+AlCl3+H2O at T=(298 to 333) K[J].Chem.Eng.Data,2005(50):1470-1477.
[7]Brown R R,Daut G E,Mrazek R V.Solubility and activity of aluminum chloride in aqueous hydrochloric acid solutions[M].Ann Arbor,Michigan:University of Michigan Library,1979.
[8]李以圭,陆九芳.电解质溶液理论[M].北京:清华大学出版社,2005.
[9]彭小奇,宋国辉,宋彦坡,等.NaOH-NaAl(OH)4-Na2CO3-H2O 体系活度因子的计算模型[J]. 中国有色金属学报,2009,19(7):1332-1337.
[10]Rafal M,Berthold J W,Scrivner N C.Models for electrolyte solutions[M]//Sandler S I.Models for thermodynamic and phase equilibria calculations.New York:CRC Press,1994.
[11]OLI Systems,Inc..Aqueous system modeling course and workshop[Z].Morris Plains,NJ,USA:OLI Systems,Inc.,2002.
[12]Casas J M,Papangelakis V G,Liu Haixia.Performance of three chemical models on the high-temperture aqeous Al2(SO4)3-MgSO4-H2SO4-H2O system[J].Ind.Eng.Chem.Res.,2005,44 (9):2931-2941.

