阻断剂对磁致伸缩生物传感器性能的影响
张克维,张 麟,柴跃生
(1.太原科技大学材料科学与工程学院,太原 030024;2.奥本大学材料研究与教育中心,美国 奥本 36849)
目前,国内外研究机构高度重视对磁致伸缩生物传感器在各种病菌检测中的应用研究[1-3]。磁致伸缩生物传感器由于其低成本、高灵敏度、操作简便、无线检测等优点,引起了研究者极大的兴趣。其工作原理是利用磁致伸缩材料的磁致伸缩效应。当磁致伸缩材料在外磁场下,它的尺寸会发生改变。如果磁致伸缩材料被置于交变磁场中,则会发生受迫振动。磁致伸缩弹性杆的无阻尼纵向受迫振动方程为[4]:
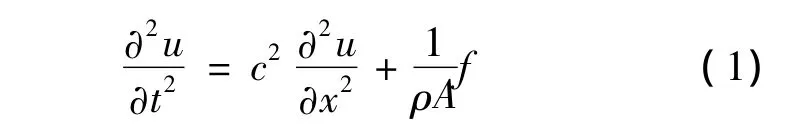
式中c:弹性纵波沿杆纵向传播速度,f:单位长度上的均匀分布的激振外力,u:纵向位移,ρ:密度,A:杆横截面积。
一端固定、一端自由,长为L的弹性杆自由振动的谐振频率可表示为:
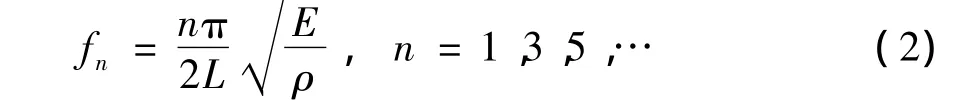
上式所定义的谐振频率忽略了磁致伸缩弹性杆材料泊松比的影响,但是由于磁致伸缩生物传感器用于检测微量细菌,对于磁致伸缩弹性杆自由振动的谐振频率的精度高度敏感[5]。对于矩形截面磁致伸缩弹性杆在考虑到泊松比的影响后,其自由振动的谐振频率可表示为:
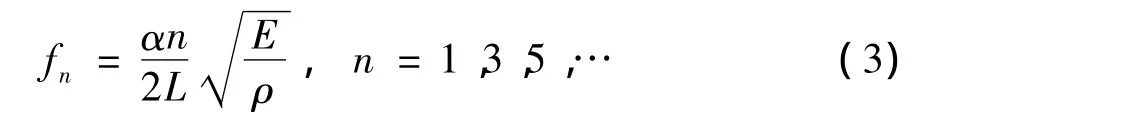
式中,L:磁致伸缩生物传感器的半长度(两端自由的磁致伸缩生物传感器在交变磁场中振动时,沿长度的中间点为节点,节点处视为固定端),fn:第n 阶模态频率,E:杨氏模量,ρ:密度,μ:泊松比,α:磁致伸缩生物传感器谐振频率修正系数,可表示为:
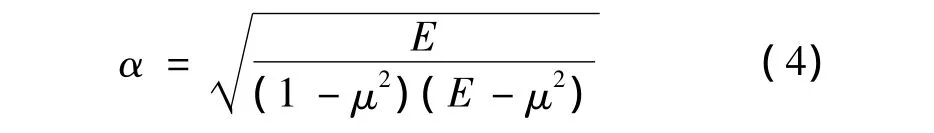
当磁致伸缩弹性杆的力学特性或表面质量载荷发生变化时,其谐振频率也会相应的改变。如果一个质量为m(m<<M)的载荷被均匀地加载到磁致伸缩弹性杆表面,其谐振频率的漂移量(△f)可用下式表示:

式中,M是无载荷时磁致伸缩弹性杆的质量。
谐振频率可以作为磁致伸缩生物传感器的输出信号。磁致伸缩弹性杆表面加载生物识别体(如:抗体)后,与待测物(如:病菌)发生特异性结合时,磁致伸缩生物传感器表面质量载荷增加,导致其谐振频率发生漂移。而频率漂移量与待测物的浓度成正比。因此,通过检测其谐振频率的漂移量便可计算出待测物的浓度。然而,病菌与生物传感器表面的非特异性结合是影响传感器性能一个非常重要的因素。有些病菌非特异性能力强,此时往往需要阻断剂来阻止病菌的非特异性结合。通过使用阻断剂可以阻止病菌与传感器表面之间的非特异性结合,提高传感器的专一性及可靠性,如图所示。
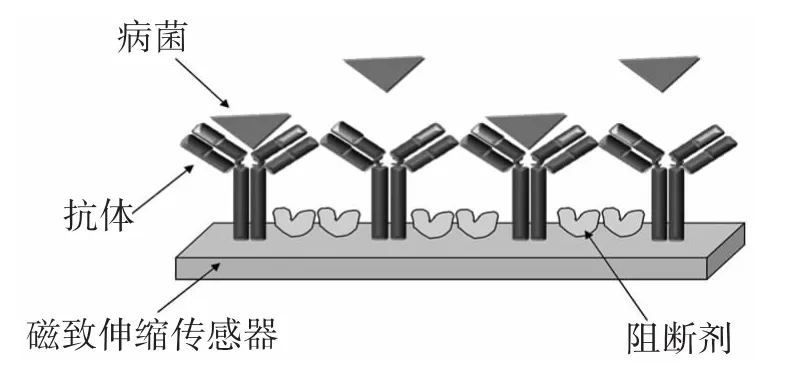
图1 阻断剂阻止病菌与传感器表面非特异性结合示意图Fig.1 Illustration of immobilization of blocking agents for preventing nonspecific binding of bacteria
由于酪蛋白和牛血清白蛋白具有良好的稳定性,同时不与大多数生物发生化学反应,作为阻断剂已经被广泛的应用于 ELISA和其他实验中[6-7]。另外,酪蛋白和牛血清白蛋白分子量较小,理论上有更大的几率占据生物抗体之间的空位。因此,在这项研究中,以李斯特菌为目标病菌,通过实验研究酪蛋白和牛血清白蛋白对李斯特菌与磁致伸缩生物传感器表面之间非特异性结合的阻断效率。
1 实验与方法
1.1 传感器制备
磁致伸缩生物传感器所使用的材料是从美国Honeywell International公司购买的磁致伸缩薄膜MetglasTM2826 MB(铁镍合金),厚度为 30 μm.为了提高传感器的质量灵敏度,首先用#2000的砂纸使薄膜磨到15 μm厚。然后,用高精度切割机把薄膜切割成尺寸为1.0 mm×0.3 mm长方条。之后,放入甲醇中用超声波清洗30 min,再用氮气吹干。最后,用磁控溅射仪先在薄膜上下两个表面溅射一层厚度为100 nm的Cr,再溅射一层厚度为125 nm的Au.其中,Cr镀层用来增强磁致伸缩材料和Au镀层之间的结合力,而Au镀层则是用于固定抗体,同时也可以保护磁致伸缩材料不被腐蚀。这些磁致伸缩长方条即为磁致伸缩生物传感器的基体,用于抗体和阻断剂的生物加载。
1.2 生物抗体加载
单克隆抗体C11E9溶液在蒸馏水中稀释成浓度为1.05×1012viron/ml的溶液。为了使抗体更牢固的固定在上述Cr/Au传感器表面,对抗体改性后与传感器表面的Au镀层通过共价键结合在一起[8]。
1.3 阻断剂加载
酪蛋白和牛血清白蛋白粉末分别在磷酸盐缓冲盐水中稀释并配成5%wt和3%wt的溶液,把Cr/Au传感器放入5%wt的酪蛋白或者3%wt牛血清白蛋白溶液中并旋转1 h,使阻断剂酪蛋白或者牛血清白蛋白颗粒附着在传感器表面。为了分析阻断剂对传感器性能的影响,使用了四种不同的处理方式,如表1所示。
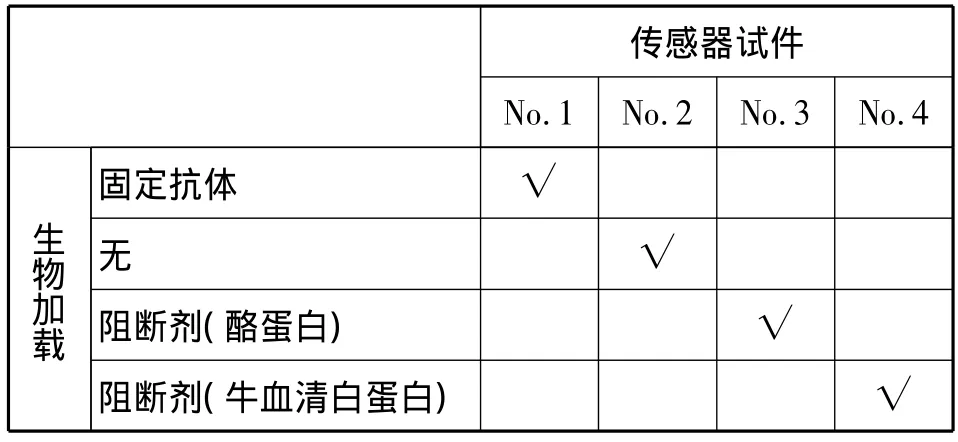
表1 磁致伸缩传感器生物加载情况Tab.1 Different immobilization conditions of magnetostrictive biosensors
1.4 李斯特菌准备
使用浓度为5×108cfu/ml李斯特菌溶液。将李斯特菌溶液依次用蒸馏水稀释成溶度为5×107cfu/ml,5 ×106cfu/ml…5 ×101cfu/ml的溶液。
1.5 实验设备
磁致伸缩生物传感器系统实验设备如图2所示。
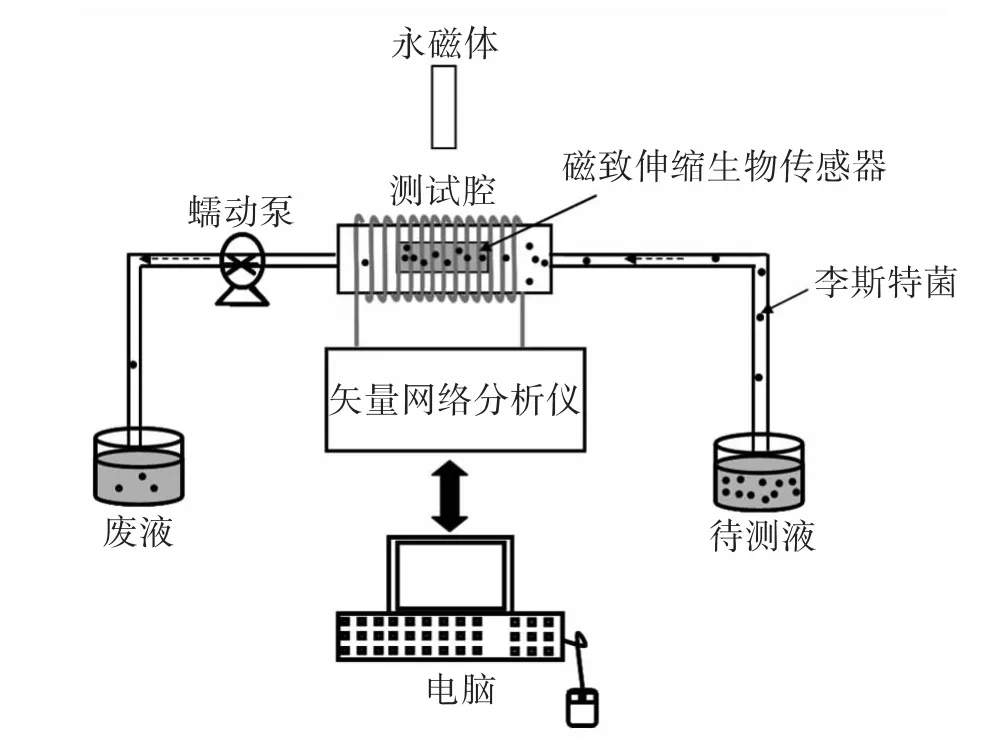
图2 磁致伸缩生物传感器系统实验装置示意图Fig.2 Schematic illustration of experiment setup for a magnetostrictive biosensor system
该实验设备包括:一个绕有铜线圈的测试腔、一个蠕动泵、两个病菌存储器、一个永磁铁、一个矢量网络分析仪以及一台电脑。测试时,磁致伸缩生物传感器被放入测试腔内。矢量网络分析仪(HP 87511)用于提供交流电并通过扫频检测磁致伸缩传感器的谐振信号。线圈把交流电转换成交变磁场并激励磁致伸缩传感器振动。电脑通过控制矢量网络分析仪实时监测并记录传感器的谐振频率。永磁铁用来提供一个偏置磁场,通过调节永磁体与传感器位置使谐振信号最优化。测试时,将磁致伸缩生物传感器放入测试腔内,用蠕动泵使蒸馏水以30 μl/min的流速通过测试腔直到传感器的谐振频率在水中达到稳定并保持20 min.该频率则作为初始参考频率。然后,使不同浓度(即5×101cfu/ml,5×102cfu/ml…to 5 ×108cfu/ml)的李斯特菌以相同的流速流过测试腔。每个浓度的溶液流过的时间为20 min,每隔30 s记录一次谐振频率。实验完成后,传感器在蒸馏水中侵润3次后在空气中干燥,并对其表面进行SEM观察。
2 实验结果与讨论
不同处理条件的磁致伸缩生物传感器对李斯特菌检测结果如图3所示。图中,每一个数据点都是2个相同尺寸的传感器在相同实验条件下测试结果的平均值。由图3可以看出,在相同的李斯特菌浓度中,谐振频率漂移量从大到小的传感器分别是:No.1,No.2,No.3 和 No.4.由此可以推断,No.1传感器表面质量载荷最大,即传感器表面李斯特菌的数量最多。其原因是由于传感器表面既有李斯特菌与抗体的特异性结合又有李斯特菌与传感器表面的非特异性结合。而No.2传感器表面只有李斯特菌的非特异性结合,而这里非特异性结合是一种随机的物理吸附,所以No.2传感器表面李斯特菌的数量小于No.1传感器。No.3和No.4传感器频率漂移量最小而且比较相近。其原因是由于No.3和No.4传感器表面分别被酪蛋白和牛血清白蛋颗粒覆盖,导致李斯特菌难以与传感器表面发生非特异性结合。
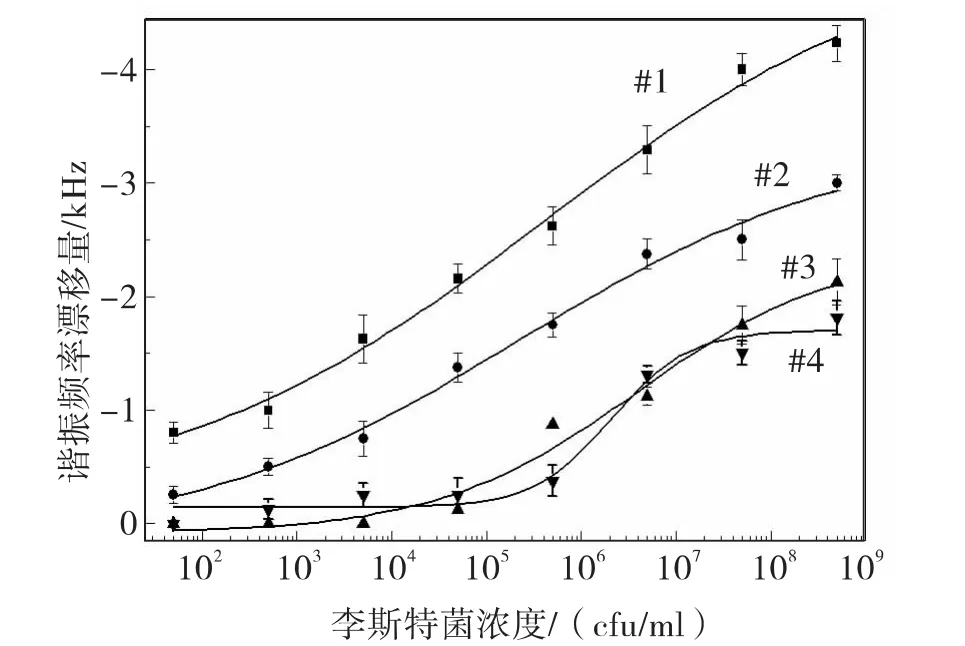
图3 磁致伸缩生物传感器谐振频率漂移量与李斯特菌浓度的曲线关系Fig.3 Resonance frequency shift of sensor No.1-No.4 vs populations of Listeria Monocytogenes

图4 实验后No.1-No.4传感器表面的SEM图Fig.4 The SEM images of No.1-No.4 sensor surfaces after experiments
图4为实验后生物加载条件下的磁致伸缩生物传感器表面的SEM图。
从图中可以看出,传感器表面李斯特菌(黑色条状物)数量由多到少的顺序分别是:No.1,No.2,No.3和No.4传感器,与上述检测结果基本相符。
3 结论
研究结果表明:尺寸为1.0 mm×0.3 mm×15 μm的磁致伸缩生物传感器的检测极限是102cfu/ml.李斯特病菌与传感器表面金镀层的非特异性结合能力较强,不使用阻断剂会影响磁致伸缩生物传感器的专一性和可靠性。而阻断剂酪蛋白和牛血清白蛋白均可以明显阻止李斯特菌非特异性结合,提高磁致伸缩生物传感器的性能。本研究结果对磁致伸缩生物传感器的系统设计有重要指导意义。
[1]PARK M K,LI S Q,WEERAKOON K,et al.Performance of Optimized Phage based Magnetoelastic Biosensors[J].ECS Trans,2013,50(12):69-76.
[2]FU L L,ZHANG K W,LI S Q,et al.In situ real-time detection of E.coli in water using antibody-coated magnetostrictive microcantilever[J].Sensor Actuat B-Chem,2010,150(1):220-225.
[3]LI S Q,HORIKAWA S,SHEN W,et al.Detection of Salmonella Typhimuriumon Fresh Food Produce Using Phage-Based Magnetoelastic Biosensors[J].ECS Trans.2010,33(8):91-97.
[4]胡海岩.机械振动基础[M].北京:北京航空航天大学出版社,2005.
[5]GRIMES C A,MUNGLE C S,ZENG K F,et al.Wireless Magnetoelastic Resonance Sensors:A Critical Review[J].Sensors-Basel,2002,2(7):294-313.
[6]SENTANDREU M A,AUBRY L,TOLDR F.Blocking agents for ELISA quantification of compounds coming from bovine muscle crude extracts[J].Euro Food Res Technology,2007,224(5):623-628.
[7]HUANG T T,STURGIS J,GOMEZ R,et al.Composite Surface for Blocking Bacterial Adsorption on Protein Biochips[J].Biotechnology Bioeng,2002,81(5):618-624.
[8]FU L L.Development of phage/antibody immobilized magnetostrictive biosensors[D].US:Auburn:Materials Research and Education Center of Auburn University,2010.

