栉孔扇贝骨形态发生蛋白Ⅰ型受体基因的克隆及表达分析*
郭慧慧,包振民,连姗姗,贺 艳,胡晓丽
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛266003)
转化生长因子β(Transforming growth factorβ,TGF-β)超家族是一组具有结构相关性的多功能细胞因子,包 括 TGF-βs、抑制 素 (Inhibins)/活 化 素 (Activins)、骨形态发生蛋白 (Bone morphogenetic proteins,BMPs)、穆 勒 氏 抑 制 物 (Mullerian inhibitory substance,MIS)、生长分化因子(Growth/differentiation factors,GDFs)等。目前已发现超过60个成员,广泛存在于从蠕虫、昆虫到哺乳类等多个物种中[1-2]。TGF-β超家族成员参与了广泛的生物学过程,如早期胚胎发生时身体的构建;软骨、骨及性器官的形成;组织修复;细胞的增殖、分化、凋亡和迁移;内分泌和免疫功能等[2]。
作为分泌型的细胞因子,TGF-β超家族成员的细胞功能是通过其信号通路实现的。胞外的TGF-β超家族配体首先形成同源二聚体,与细胞膜表面的丝氨酸/苏氨酸Ⅱ型和Ⅰ型激酶受体特异性结合形成复合体。在这个过程中,Ⅱ型受体蛋白激酶区将Ⅰ型受体的GS(甘氨酸-丝氨酸串联重复)结构域磷酸化,从而使Ⅰ型受体活化。活化的受体复合物特异性激活Smad等下游信号转导分子,将信号传递至细胞核内,进而调控一系列基因的转录[3-6]。其中,Ⅰ型受体的活化是TGF-β信号转导过程中最重要的步骤之一。
目前,TGF-β信号通路相关基因的研究主要集中在人、小鼠等高等脊椎动物,而在海洋无脊椎动物如贝类等中开展的研究较少。双壳贝类中的相关研究主要集中在牡蛎,已在牡蛎中得到多个TGF-β超家族配体及其信号传导过程中必需的Ⅰ型、Ⅱ型受体和Smad家族成员,表明双壳贝类中可能存在同脊椎动物相似的TGF-β信号通路[7-14]。在扇贝中也获得了一种 TGF-β超家族成员myostatin的基因序列[15-16],但目前尚未有扇贝TGF-β受体的报道。本文首次从我国北方主要的养殖贝类栉孔扇贝(Chlamys farreri)中克隆得到了BMPⅠ型受体(BMP type I receptor,BMPR1)的cDNA全长序列,并检测了该基因在扇贝胚胎、幼虫不同发育时期及成体组织中的表达水平,为进一步研究扇贝中BMPⅠ型受体及TGF-β信号通路的功能提供了基础信息。
1 材料与方法
1.1 栉孔扇贝组织及胚胎、幼虫材料的采集
成体栉孔扇贝于2010年11月取自山东寻山养殖场,实验室18℃暂养24h,解剖取外套膜、鳃、性腺、肾、横纹肌和消化腺等组织,液氮速冻后,-80℃冻存。不同发育时期胚胎、幼虫材料(受精卵、4细胞期、囊胚期、原肠胚期、担轮幼虫期、D形幼虫期和壳顶幼虫期)于2010年5月采集,液氮速冻后,-80℃冻存。
1.2 总RNA提取及单链cDNA合成
按照Trizol试剂盒(Invitrogen)说明书提取6只成体扇贝各组织及不同发育时期胚胎、幼虫总RNA,经DNase I(TaKaRa)处理后,按照 M-MLV反转录酶(Invitrogen)说明书,以 Oligo(dT)18(TaKaRa)为引物,用2μg总RNA为模板进行反转录,合成单链cDNA。
1.3 栉孔扇贝BMPR1cDNA全长序列的克隆
在本实验室栉孔扇贝转录组数据库(注册号:SRA027310)中筛查得到BMPR1同源片段(443bp)。根据该序列分别设计5′RACE引物cfBMPR1-r1和3′RACE引物cfBMPR1-f1 (见表1),按照 SMARTTMRACE cDNA 扩增 试 剂盒 (Clontech)说 明 书 进 行RACE扩增。1%琼脂糖凝胶检测扩增产物,UNIQ-10柱式胶回收试剂盒回收目的片段。回收片段连接插入pMD18-T载体(TaKaRa),转化入大肠杆菌DH5α。菌落PCR筛选阳性重组质粒,对5′和3′RACE产物分别挑取3个阳性克隆,送上海Sangon生物工程公司测序。
1.4 序列分析
将测序结果与GenBank核酸数据库中的已知序列作 Blastx 同 源 性 分 析,用 Blast 2 程 序 (http://blast.ncbi.nlm.nih.gov/Blast/)进行5′和3′末端序列拼接,获得目的基因cDNA全长序列。用GeneRunner程序搜索开放阅读框(open reading frame,ORF)、推测编码氨基酸序列。将推测的氨基酸序列与Genbank数据库中已知序列作Blastp同源性比对和相似性搜索,用 SMART 工具 (http://smart.emblheidelberg.de/)预测保守域,SignalP4.0Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽位置。用ClustalW2程序对栉孔扇贝BMPR1和其它物种BMPR1蛋白进行多序列比对,GenDOC程序编辑比对结果。采用 MEGA 5.0软件,以最小进化法(minimum evolution method)构建系统进化树(1000runs)。
1.5 时空表达分析
采用实时荧光定量反转录 PCR (real-time qRTPCR)方法检测BMPR1在栉孔扇贝不同发育时期(受精卵、4细胞期、囊胚期、原肠胚期、担轮幼虫期、D形幼虫期和壳顶幼虫期,每时期3套材料,每套n>500)及成体组织(外套膜、鳃、性腺、肾、横纹肌和消化腺,n=6)中的表达水平。以特异引物cfBMPR1-r2和cfBMPR1-f2(见表1)扩增cfBMPR1基因片段,引物cfActin-r和cfActin-f(见表1)扩增内参基因β-actin 的基因片段。PCR反应在ABI 7500定量PCR仪上进行,每个样品均设3个技术重复。反应体系如下:单链cDNA模板1μL,上下游引物各0.2μmol/L,2×SYBR Green I Real-time PCR Master Mix (TOYOBO)10 μL,加水补足至20μL。反应条件如下:50℃2min;94℃预变性10min;94℃变性15s,63℃退火1min,40个循环;94℃15s,0.5℃/10s降至55℃,55℃1min。为排除引物二聚体及非特异性扩增产物对基因表达定量影响的可能性,PCR反应结束后进行熔解曲线分析。利用 Real-time PCR Miner[17]分析 BMPR1基因的相对表达水平。采用One-way ANOVA分析统计学差异。

表1 本文的引物信息Table 1 Information of the primers used in this study
2 结果
2.1 栉孔扇贝BMPR1(cfBMPR1)序列分析
将RACE扩增产物序列拼接后,获得1851bp cDNA序列 (GenBank注册号:JX050135),含1560bp开放阅读框,编码519个氨基酸,预测蛋白分子量59.30 KD,等电点为6.52;5′非编码区(untranslated region,UTR)长度为18bp,3′UTR长度为273bp。获得的cDNA序列及其编码的氨基酸序列见图1。BlastX分析显示,编码的氨基酸序列与BMPR1相似性最高。氨基酸序列的N末端有一段30个氨基酸残基组成的信号肽序列,在第139~161位氨基酸处有一段跨膜区。胞外区有10个保守的半胱氨酸残基,第44~46和115~117位氨基酸处各有1个N-糖基化位点。胞内主要是丝氨酸/苏氨酸激酶区,第183和190位氨基酸处有2个可能通过磷酸化参与信号传导的丝氨酸残基,随后是Ⅰ型受体的典型结构GS区,第224~229位氨基酸处是ATP结合位点(GKGRYG),第277~285位氨基酸处为决定受体-Smad结合特异性的L45loop(ADIKGTGSW),第422~424和499~504位氨基酸处处是EIX和RVKKTL等丝氨酸/苏氨酸Ⅰ型受体典型结构。将栉孔扇贝BMPR1氨基酸序列与太平洋牡蛎(Crassostrea gigas)、斑马鱼(Danio rerio)、爪蟾(Xenopus tropicalis)和人(Homo sapiens)的同源序列进行ClastW 比对,相似性分别达到了74%、63%、66%和69%,其中丝氨酸/苏氨酸激酶区保守性较高,相似性分别达到了86%、87%、86%和87%。图2也显示BMPR1的激酶区在物种间保守性高于其它区域。

图1 cfBMPR1基因全长cDNA序列及其编码的氨基酸序列Fig.1 The full-length cDNA and deduced amino acid sequences of C.farreri BMPR1
2.2 系统发生分析
利用最小进化法对cfBMPR1与其它TGF-β超家族Ⅰ型受体 (BMP I型受体、TGF-βⅠ型受体、ActivinⅠ型受体)进行系统进化分析,以果蝇Ⅱ型受体Punt作为外群。结果显示,cfBMPR1首先与进化关系最近的太平洋牡蛎BMPR1聚类,再与其他物种BMPⅠ型受体聚为一支(见图3)。

图2 BMPR1氨基酸序列多重比对Fig.2 Alignment of amino acid sequences of BMPR1s

图3 TGF-β超家族Ⅰ型受体系统进化分析Fig.3 Phylogenetic analysis of typeⅠ receptors for TGF- superfamily
2.3 栉孔扇贝BMPR1基因时空表达分析
利用qRT-PCR对cfBMPR1基因在栉孔扇贝胚胎、幼虫不同发育时期和成体组织中的表达进行了分析。在受精卵、4细胞胚胎、囊胚、原肠胚、担轮幼虫、D型幼虫和壳顶幼虫中均检测到了该基因的表达,其中,受精卵、4细胞期、囊胚和原肠胚等胚胎时期表达量显著高于幼虫期(P<0.05)。在囊胚期后表达量持续下降,到D型幼虫期表达量仅为囊胚期的1/32,壳顶幼虫期表达量显著上升(P<0.05)(见图4A)。cfBMPR1在栉孔扇贝成体组织外套膜、鳃、肾、横纹肌和消化腺中均有表达,其中性腺和横纹肌中表达量显著高于消化腺中表达量(P<0.05)(见图4B)。
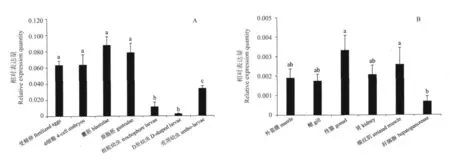
图4 BMPR1在栉孔扇贝的相对表达量Fig.4 Relative expression levels of BMPR1in C.farreri
3 讨论
本文采用RACE技术首次在栉孔扇贝中成功克隆了BMPR1基因的cDNA全长序列,蛋白比对结果表明该基因编码的氨基酸序列同其他I型受体一样含有以下特征性结构:富含半胱氨酸的胞外区、跨膜区和胞内丝氨酸/苏氨酸激酶区;胞外区有10个高度保守的半胱氨酸残基,其中3个在跨膜区附近形成CCX4-5C半胱氨酸节,对形成稳定的蛋白结构具有重要意义[18]。氨基酸序列比对结果表明,胞内区在物种间的保守性高于跨膜区和胞外区,其中GS区和L45loop几乎完全保守。有研究认为在TGF-β信号传导过程中,Ⅰ型受体GS区的磷酸化对受体的活化起关键作用[19]。L45loop则与受体调节型-Smad(R-Smad)C端L3 loop结合,决定了受体-Smad结合的特异性[20]。cfBMBR1中L45loop(ADIKGTGSW)序列与人类BMBR1B的L45loop序列完全一致,而BMBR1B在信号传导过程中与Smad5/8结合,这为进一步研究cfBMBR1与R-κSmad的结合提供了线索。与脊椎动物相比,贝类(牡蛎和扇贝)BMPR1氨基酸序列在胞外区和胞内区均有插入或缺失片段(见图2),这些插入缺失可能与脊椎动物和无脊椎动物中BMBR1功能的差异有关[10]。另外,序列变异较大的区域多位于BMPR1功能区激酶区之外,可能与其受到较低的选择压力有关。目前已知的TGF-β超家族Ⅰ型受体主要分为3类:BMP I型受体、TGF-βⅠ型受体和ActivinⅠ型受体,系统进化分析表明,本文获得的cfBMPR1与其他物种BMPR1聚为一支,进一步表明获得的基因为栉孔扇贝BMPR1。
在栉孔扇贝胚胎、幼虫中的表达分析显示,cfBMPR1在所测不同发育时期均有表达。其中,受精卵、4细胞期、囊胚期和原肠胚期表达量均较高,提示其在扇贝早期胚胎发育过程中可能有重要作用。刚受精的卵子中即检测到了cfBMPR1较高水平的表达,表明早期胚胎中的cfBMPR1mRNA为母源性的。担轮幼虫和D型幼虫中cfBMPR1表达量大幅下降,壳顶幼虫期表达有所恢复。这一表达模式提示了,与脊椎动物中TGF-β超家族信号在胚胎背腹模式形成中的重要作用类似,cfBMPR1在栉孔扇贝幼虫形态形成中可能也起一定作用[21-22]。太平洋牡蛎中BMPR1的表达模式与栉孔扇贝相似,早期胚胎中表达量较高,幼虫期表达量降低,可能与该基因在双壳贝类发育过程中功能的保守性有关[10]。
cfBMPR1在检测的外套膜、鳃、性腺、肾、横纹肌和消化腺等成体组织中广泛表达,与太平洋牡蛎中的同源基因的组织表达分布相似,表明该基因在软体动物中可能调节多种细胞的生物学过程[10]。其中,性腺和横纹肌中cfBMPR1表达量最高。性腺中高丰度的mRNA可能与卵细胞和受精卵中该基因的高水平表达有关,也提示了cfBMPR1可能参与扇贝的繁殖过程。哺乳动物中,BMPR1可与穆勒氏抑制物(MIS)结合,介导其在性腺发育过程中的作用[23-24]。BMPR1B 基因在绵羊繁殖有关的组织和器官中广泛表达,该基因编码区第746位置的A>G突变可造成母羊排卵数增加[25-26]。横纹肌中cfBMPR1的较高水平表达暗示该基因可能参与扇贝肌肉生长调控。在鸡胚胎发育过程中,BMPR1传导的BMP2/4信号既能通过上调胚胎中生肌基因的表达刺激胚胎肌肉生长,又能通过诱导细胞凋亡抑制肌肉生长,对鸡骨骼肌的形成及生长起重要的调控作用[27-28]。C2C12成肌细胞系中加入 Dorsomorphin、LDN-193189 等 BMPR1 抑 制 剂 会 下 调Myf5、MyoD等生肌调节因子的表达,从而抑制肌管的形成[29]。深入研究cfBMPR1基因在扇贝生殖周期及肌肉等组织以及发育过程中的表达及调控,对进一步阐明其生理功能有重要意义。
[1] Feng X,Derynck R.Specificity and versatility in TGF-βsignaling through Smads[J].The Annual Review of Cell and Developmental Biology,2005,21:659-693.
[2] Chin D,Boyle G M,Parsons P G,et al.What is transforming growth factor-beta(TGF-β)[J].The British Association of Plastic Surgeons,2004,57:215-221.
[3] Derynck R.TGF-β-receptor-mediated signaling[J].Trends in Biochemical Sciences,1994,19(12):548-553.
[4] Derynck R,Feng X.TGF-beta receptor signaling[J].Biochim Biophys Acta,1997,1333(2):105-150.
[5] Derynck R,Zhang Y,Feng X.Smads:transcriptional activators of TGF-beta responses[J].Cell,1998,95(6):737-740.
[6] MassaguéJ,Chen Y G.Controlling TGF-βsignaling[J].Genes and Development,2000,14:627-644.
[7] Herpin A,Favrel P,Cunningham C.Gene structure and expression of cg-ALR1,a type I activin-like receptor from the bivalve mollusc Crassostrea gigas [J].Gene,2002,301:21-30.
[8] Herpin A,Lelong C,Favrel P.Transforming growth factor-β-related proteins:an ancestral and widespread superfamily of cytokines in metazoans[J].Developmental and Comparative Immunology,2004,28:461-485.
[9] Herpin A,Lelong C,Becker T,et al.Structural and functional evidences for a type 1TGF-βsensu stricto receptor in the lophotrochozoan Crassostrea gigas suggest conserved molecular mechanisms controlling mesodermal patterning across bilateria [J].Mechanisms of Development,2005,122:695-705.
[10] Herpin A,Lelong C,Becker T,et al.Structural and functional evidence for a singular repertoire of BMP receptor signal transducing proteins in the lophotrochozoan Crassostrea gigas suggests a shared ancestral BMP/activin pathway[J].The FEBS Journal,2005,272:3424-3440.
[11] Le-QuéréH,Herpin A,Huvet A,et al.Structural and function-al characterizations of an Activin type II receptor orthologue from the Pacific oyster Crassostrea gigas[J].Gene,2009,436:101-107.
[12] Miyashita T,Hanashita T,Toriyama M,et al.Gene cloning and biochemical characterization of the BMP-2of Pinctada fucata[J].Bioscience Biotechnology and Biochemistry,2008,72:37-47.
[13] Zhou Y,He Z,Li Q,et al.Cloning and expression pattern of a Smad3homolog from the Pearl oyster,Pinctada fucata [J].Acta Biochimica et Biophysica Sinica,2008,40(3):244-252.
[14] Zhou Y,He Z,Huang J,et al.Cloning and characterization of the activin like receptor 1homolog(Pf-ALR1)in the Pearl oyster,Pinctada fucata [J].Comparative Biochemistry and Physiology,Part B,2010,156:158-167.
[15] Hu X,Guo H,He Y,et al.Molecular characterization of myostatingene from Zhikong scallop Chlamys farreri (Jones et Preston 1904)[J].Genes and Genetic Systems,2010,85:207-218.
[16] Kim H W,Mykles D L,Goetz F W,et al.Characterization of a myostatin-like gene from the bay scallop,Argopecten irradians[J].Biochimica et Biophysica Acta,2004,1679:174-179.
[17] Zhao S,Fernald R D.Comprehensive algorithm for quantitative real-time polymerase chain reaction[J].Journal of Computational Biology,2005,12:1047-1064.
[18] Wrana J,Tran H,Attisano L,et al.Two distinct transmembrane serine/threonine kinases from Drosophila melanogaster form an activin receptor complex[J].Molecular and Cellular Biology,1994,14(2):944-950.
[19] MassaguéJ.TGF-βsignal transduction[J].Annual Review of Biochemistry,1998,67:753-791.
[20] Chen Y G,Hata A,Lo R S,et al.Determinants of specificity in TGF-βsignal transduction[J].Genes and Development,1998,12:2144-2152.
[21] Roelen B A,Goumans M J,Zwijsen A,et al.Identification of two distinct functions for TGF-βin early mouse development[J].Differentiation,1998,64:19-31.
[22] Aoki T O,David N B,Minchiotti G,et al.Molecular integration of casanovain the Nodal signalling pathway controlling endoderm formation[J].Development,2002,129:275-286.
[23] Jamin S,Arango N,Mishina Y,et al.Genetic studies of the AMH/MIS signaling pathway for Müllerian duct regression[J].Molecular and cellular endocrinology,2003,211:15-19.
[24] Belville C,Jamin S,Picard J,et al.Role of type I receptors for anti-Mullerian hormone in the SMAT-1Ser-toli cell line[J].Oncogene,2005,24(31):4984-4992.
[25] C J Souza,MacDougall C,MacDougall C,et al.The Booroola(FecB)phenotype is associated with a mutation in the bone morphogenetic receptor type 1B(BMPR1B)gene[J].Journal of Endocrinology,2001,169(2):1-6.
[26] Mulsant P,Lecerf F,Fabre S,et al.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J].Proc Natl Acad Sci U S A,2001,98(9):5104-5109.
[27] Duprez D M,Coltey M,Amthor H,et al.Bone Morphogenetic Protein-2(BMP-2)Inhibits Muscle Development and Promotes Cartilage Formation in Chick Limb Bud Cultures[J].Develop-mental Biology,1996,174:448-452.
[28] Amthor H,Christ B,Weil M,et al.The importance of timing differentiation during limb muscle development[J].Current Biology,1998,8(11):642-652.
[29] Furutani Y,Umemoto T,Murakami M,et al.Role of endogenous TGF-βfamily in myogenic differentiation of C2C12cells[J].Journal of Cellular Biochemistry,2011,112(2):614-624.
