乌鸦果根甲醇提取物的抑真菌作用研究
李兴玉,李兴奎,林 鑫,李晓翔
(1.云南农业大学基础与信息工程学院,云南 昆明650201;2.云南农业大学后勤集团,云南 昆明650201)
乌鸦果(Vaccinium fragile Franch)为杜鹃花科(Ericaceae)越橘属(VacciniumL.)植物,俗名午饭果、毛叶午饭果、土千年健、千年矮、老鸦泡、老鸦果,在我国主要分布于贵州、四川、云南、西藏东南等地[1,2],为多年生常绿矮小灌木。全株药用,有舒筋活络、祛风湿、镇痛等作用[3],在彝族地区广泛用于治疗腰膝酸软、四肢无力、风湿关节痹痛、半身不遂等症[4,5]。全株水提物或醇提物具有杀菌或杀虫作用,同科的部分种曾作为土农药防治病虫害[6]。乌鸦果作为食用资源及园林植物资源开发利用均有报道,但其根部提取物对植物病原真菌的抑菌活性目前尚未见报道。
作者就乌鸦果根甲醇提取物对21种植物病原真菌的抑制作用进行了室内活性测定,拟为乌鸦果植物源农药的开发利用提供理论基础。
1 实验
1.1 供试材料
乌鸦果根,2010年2月采于云南大理白族自治州挖色镇,室温阴干。
1.2 供试菌种
三七根腐病菌(Fusarium solani)、玉米弯孢霉叶斑病菌(Curvularia lunata Boedijn)、水稻立枯丝核菌(Rhizoctonia solani)、玉 米 小 斑病 (Bipolaris maydis)、茶叶轮斑菌(Pestalotiopsis theae)、魔芋枯萎病菌(Fusarium solani Martius)、玉米茎腐病菌(Fusarium graminearum)、康乃馨枯萎病菌(Fusarium oxysporumf.sp.Dianthi)、烟草枯萎病菌(Fusarium oxysporumf.sp.Nicotianae)、棉花红腐病菌(Fusarium moniliforme)、小 麦 根 腐 病 菌 (Bipolaris sorokiniana)、小麦雪腐病菌(Gerlachia nivalis)、小麦纹枯病菌 (Rhizoctonia cerealis)、马铃薯晚疫病菌(Phytophthora infestans)、番茄灰霉病菌(Botrytis cinerea)、烟草立枯丝核病菌(Rhizoctonia solani)、甘蔗黑腐病菌(Ceratocystis adiposum)、苹果斑点病菌(Alternaria alternate f.sp.Mali)、烟草赤星病菌 (Alternaria alternate)、烟草疫霉病菌(Phytophthora parasitica)和辣椒疫霉病菌(Phytophthora capsici)。所有菌株均来自云南农业大学植物病理重点实验室。
1.3 乌鸦果根甲醇提取物的制备
取干燥乌鸦果根1000g,粉碎后用9BV 70% 甲醇在65℃下回流提取3次(第1次2h、第2次1h、第3次1h),合并提取液经真空旋转蒸发仪在65℃下蒸干[7],获得浸膏263g,提取率26.3%。将浸膏混悬于温水中,用等体积石油醚萃取3次,经预实验表明石油醚萃取物没有抑真菌活性。余下部分减压蒸干获得乌鸦果根甲醇提取物固体192g,取100g用无菌水溶解并定容到100mL,提取物浓度为1000mg·mL-1,保存于4℃冰箱备用。
1.4 病原真菌孢子悬浮液和断裂菌丝体的制备
用PDA培养基活化各病原真菌,培养72h后挑取菌落边缘菌丝块接种于PDB培养液中,装液量为50mL/250mL三角瓶,于26℃、170r·min-1摇床振荡培养72h。无菌纱布过滤除去大块菌丝体,得到分生孢子悬浮液或断裂菌丝体悬浮液,血球计数板计数,用灭菌的PDB液体培养基稀释浓度至1×108cfu·mL-1。
1.5 抑菌活性的测定
采用改进牛津杯法即牛津杯双层培养基法[8]测定乌鸦果根甲醇提取物对各病原真菌的抑菌活性。下层培养基为含1.2% 琼脂的15mL PDA,上层培养基为含0.5% 琼脂、1%病原真菌孢子悬浮液或断裂菌丝体的5mL PDA。在每个双层平板上放置2个内径为6mm的无菌牛津杯。其中一个加入80μL无菌PDB培养液作为对照,另一个加入80μL乌鸦果根甲醇提取物。置于26℃恒温培养箱中培养72h,测量抑菌圈直径(不含牛津杯直径),平行测定3次。
1.6 最小抑菌浓度的测定
采用两倍琼脂梯度稀释法[9]测定乌鸦果根甲醇提取物对各病原真菌的最小抑菌浓度。乌鸦果根甲醇提取物经梯度稀释后获得浓度(mg·mL-1)分别为500.0、250.0、125.0、62.5、31.2、15.6、7.8、3.9、1.9、0.98的系列工作溶液。依照1.5方法进行测定,以没有明显菌体生长的最低浓度作为最小抑菌浓度MIC(即产生明显抑菌圈的最小浓度)。MIC的判读和记录方法参照文献[10]。
1.7 最小杀菌浓度的测定
在MIC测定的基础上,选取MIC、2倍MIC和4倍MIC的培养皿继续培养72h,以完全无菌体生长的最低浓度为最小杀菌浓度MBC(即抑菌圈内72h后无菌体生长)[11]。
2 结果与讨论
2.1 乌鸦果根甲醇提取物对病原真菌的抑制活性(表1 )
由表1 可知,乌鸦果根甲醇提取物在1000mg·mL-1浓度下对供试菌株均表现出不同的抑制作用。这些植物病原真菌包括子囊菌亚门的长喙壳属(Ceratocystis)、担子菌亚门无性态的丝核菌属(Rhizoctonia)、鞭毛菌来门的疫霉属(Phytophthora)、半知菌亚门丝孢纲的葡萄孢属(Botrytis)。表明乌鸦果根甲醇提取物具有广谱抑制真菌作用,具有潜在的开发利用价值。

表1 乌鸦果根甲醇提取物对病原真菌的抑菌活性Tab.1 The antifungal activities of methanol extract from root of Vaccinium fragile Franch
2.2 乌鸦果根甲醇提取物的最小抑菌浓度和最小杀菌浓度(表2 )
由表2 可知,乌鸦果根甲醇提取物对各病原真菌MIC在31.2~250.0mg·mL-1之间。
三七根腐病菌、烟草枯萎病菌和辣椒疫霉病菌的MIC为31.2mg·mL-1,而前者的 MBC为31.2mg·mL-1,后两者的 MBC为62.5mg·mL-1。水稻立枯丝核菌、魔芋枯萎病菌、玉米茎腐病菌、小麦纹枯病菌和烟草立枯丝核病菌的 MIC为62.5mg·mL-1,其中前2种菌株的MBC为125.0mg·mL-1,后3种菌株的MBC为62.5mg·mL-1。玉米小斑病、茶叶轮斑菌、康乃馨枯萎病菌、棉花红腐病菌、小麦根腐病菌、小麦雪腐病菌、马铃薯晚疫病菌、甘蔗黑腐病菌、烟草赤星病菌和烟草疫霉病菌的MIC为125.0mg·mL-1,其中前4种菌株的 MBC为250.0mg·mL-1,后6种菌株的MBC为125.0mg·mL-1。玉米弯孢霉叶斑病菌、番茄灰霉病菌和苹果斑点病菌的MIC和MBC均为250mg·mL-1。
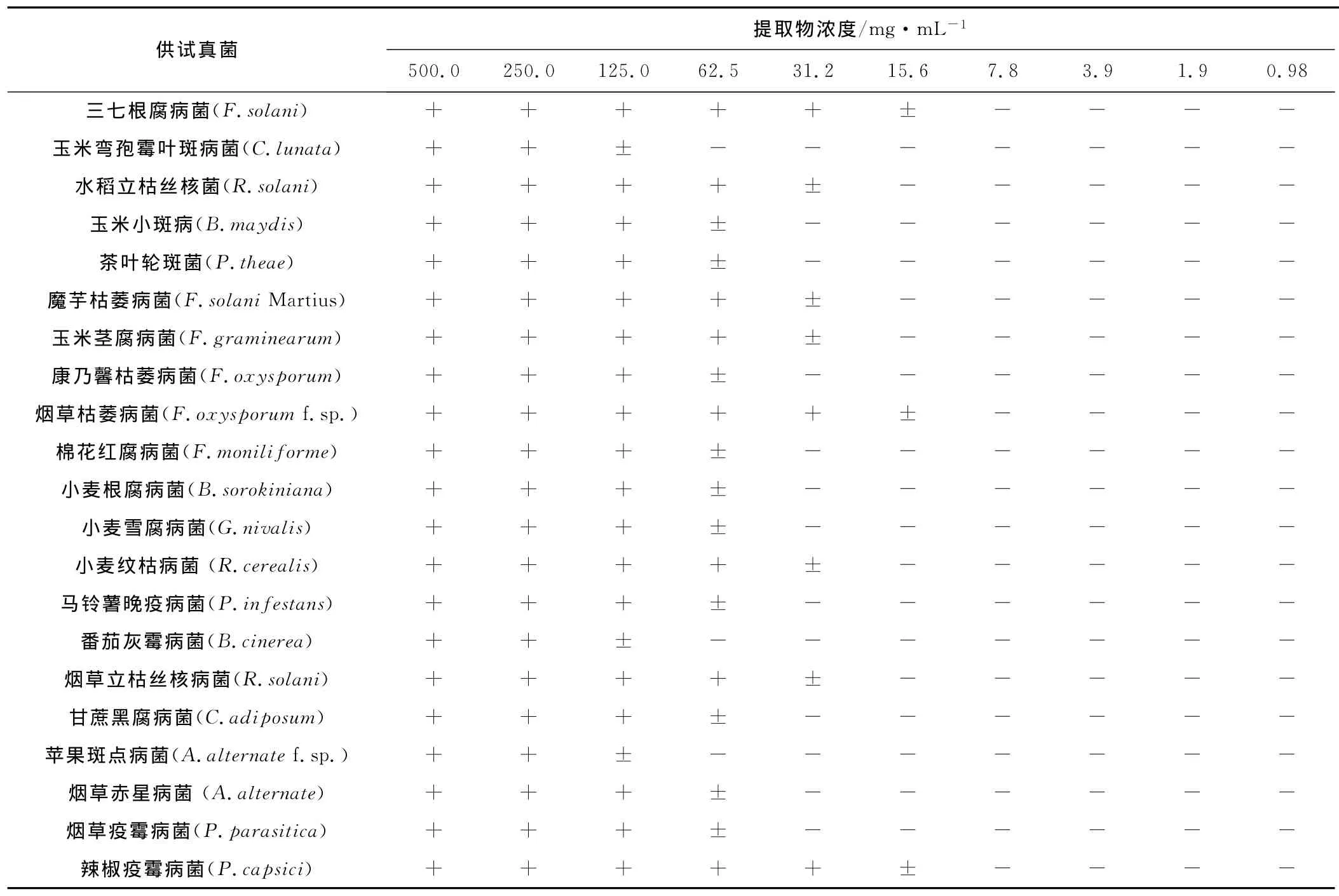
表2 乌鸦果根甲醇提取物对各病原真菌的MIC和MBCTab.2 MIC and MBC of methanol extract from root of Vaccinium fragile Franch for different plant pathogens
2.3 讨论
基于《中国有毒植物》和《中国土农药志》及民间调查发现,野生植物乌鸦果具有作为植物源农药开发的潜力。通过测试其甲醇粗提物对植物病原真菌的抑制活性测试,证明乌鸦果根甲醇提取物在室内条件下对各供试病原真菌确实有一定程度的抑制作用,且抑菌谱较广,最小抑菌浓度及最小杀菌浓度均为31.2~250.0mg·mL-1。但是由于粗提物成分复杂,很可能是多种成分的协同作用,或是由于高浓度下造成高渗透压导致真菌受损,因而本研究尚不能完全证明和解释乌鸦果根甲醇提取物对植物病原真菌的活性作用和活性机制。为了科学解释乌鸦果根甲醇提取物的抑真菌活性,为下一步综合开发利用提供科学依据,后续将从以下几方面开展研究工作:(1)选择活性最强的菌株三七根腐病菌作为指示对象,利用活性跟踪方法对乌鸦果根甲醇提取物进行系统分离纯化。(2)对活性化合物进行结构鉴定,研究构效关系及其活性机制。(3)研究活性化合物对其它植物病虫害的作用,扩大其使用范围。
3 结论
乌鸦果根经甲醇回流提取、石油醚脱脂得到乌鸦果根甲醇提取物,采用双层培养基法测定其抑真菌活性、琼脂梯度稀释法测定最小抑菌浓度和最小杀菌浓度。结果表明,乌鸦果根甲醇提取物(1000mg·mL-1)对供试的21种真菌均有不同程度的抑菌活性,最小抑菌浓度和最小杀菌浓度均为31.2~250.0mg·mL-1;且提取物抑菌能力与其浓度呈正相关关系。表明乌鸦果根甲醇提取物具有广谱抑制真菌作用,可以作为植物源农药进一步深入研究,具有潜在的开发利用价值。
[1]方瑞征.中国植物志[第57(3)卷][M].北京:科学出版社,1991:82-164.
[2]中国科学院昆明植物研究所.云南植物志(第五卷)[M].北京:科学出版社,1991:288-348.
[3]《滇南本草》整理组.滇南本草[M].昆明:云南人民出版社,1975:328-331.
[4]云南省彝族医药研究所.中国彝族药学[M].昆明:云南人民出版社,2004:216-217.
[5]张之道.彝药本草(第一卷)[M].昆明:云南人民出版社,2006:137.
[6]中国土农药志编缉委员会.中国土农药志[M].北京:科学出版社,1959:115-116.
[7]李兴玉,李立兵,李兴奎.乌鸦果提取工艺研究[J].国际中医中药杂志,2011,33(9):814-816.
[8]Ahmed K Z,Mesterhazy A,Sagi F.In vitro techniques for selecting wheat (Triticum aestivum L.)for fusarium-resistance.I.Double-layer culture technique[J].Euphytica,1991,57(3):251-257.
[9]Zhang Dao-jing,Liu Rong-feng,LI Yuan-guang,et al.Two new antifungal cyclic lipopeptides fromBacillus marinus B-9987 [J].Chem Pharm Bull,2010,58(12):1630-1634.
[10]Joshi S,Subedi Y P,Paudel S K.Antibacterial and antifungal activity of heartwood of Acacia catechu of Nepal[J].J Nepal Chem Soc,2011,27(1):94-99.
[11]Hirsch P R.Plasmid determined bacteriocin production by Rhizobium leguminosarum[J].J Gen Microbiol,1979,113(2):219-228.

