椰甲截脉姬小蜂室内外种群过氧化物酶和酯酶同工酶的比较
姜迎娅,龚声辉,朱 麟
(海南师范大学 生命科学学院,海南省热带动植物生态学重点实验室,海南 海口 571158)
室内稳定的环境条件下饲养出来的寄生蜂释放到野外多变的环境后,会对寄生蜂的生存造成很大的困难.经调查,椰甲截脉姬小蜂的野外种群寄生率低、种群数量小、不能成功定殖是防治过程中的一大难题[4].那么,在野外环境条件下,椰甲截脉姬小蜂是否会产生适应性,这是目前尚未涉及的问题.目前的研究主要是针对该蜂的生物学特性及基础生态学的研究,对该蜂体内各种适应性酶同工酶的研究还未见报道.
因此,为弄清这一问题,采用聚丙烯酰胺凝胶电泳技术,对椰甲截脉姬小蜂室内外种群的过氧化物酶(POD)和酯酶(EST)同工酶进行了比较研究,确定其同工酶酶谱,以部分理解该蜂是否适应了野外多变的环境条件,以期获得室内外种群在不同生存条件下的差异性证据,同时也为椰心叶甲的可持续生物防治提供基础.
1 材料与方法
1.1 虫源
椰甲截脉姬小蜂室内种群均由实验室室内饲养,种蜂由海南省儋州市森林植物防治检疫站提供.饲养方法如下:将新鲜椰树心叶与老叶裁剪为长短适中的长条,参杂混合,约30片为一捆,置于自主设计的养虫盒内,每个盒里放三捆,盒盖中央覆盖纱网以保证透气及防止成虫逃逸.每3d更换一次心叶,并用75%酒精擦拭消毒养虫盒.饲养多代后挑选健康活跃的椰心叶甲2~4龄幼虫,每盒200头,将寄生蜂成虫与椰心叶甲幼虫按3∶1的数量接入养虫盒内,并用10%蜂蜜水补充营养,将养虫盒置于室内温度25~26℃,相对湿度75%~80%,L∶D=12h∶12h的条件下饲养[4],7d后挑取被寄生的椰心叶甲僵虫2~3头装入一管口有脱脂棉的指形管内,在上述饲养过程的相同条件下让寄生蜂羽化.羽化的成虫立即置于-40℃冰箱中保存备用.
椰甲截脉姬小蜂野外种群由如下方法获得:将2011年5月至11月由海口市、儋州市、文昌市等地区采集到的椰心叶甲僵虫带回实验室,每2~3头装入一管口有脱脂棉的指形管内,将其放入与室内种群相同的条件下发育,待成虫羽化后立即将其置于-40℃冰箱中保存备用.
1.2 样品制备
分别秤取椰甲截脉姬小蜂室内种群和野外种群各0.03 g,放入冰冻的研钵内,加预冷的0.2 mol/L pH 7.0磷酸缓冲液1 mL和少许石英砂,冰浴迅速研磨,然后再以1 mL磷酸缓冲液分几次洗入2 mL离心管.4℃下10000 rpm离心10min,取上清液重复离心一次后的上清液即为酶的粗提液.按每管30 μL分装后将样品置于-20℃保存备用.
1.3 电泳及活性染色
采用垂直板聚丙烯酰胺凝胶电泳常规方法[5],胶厚约1mm,分离胶浓度为10%,pH8.9;浓缩胶浓度为4%,pH 6.8,电极缓冲液为Tris-Gly(pH8.3),上样量约为20 μL.在4℃条件下进行电泳,采用恒压60V电泳,当指示剂跑到浓缩胶与分离胶界线时,升压至100V,继续电泳,待指示剂迁移至凝胶底部时,停止电泳,电泳时间约为5~7h.电泳完毕后,过氧化物酶同工酶采用醋酸联苯胺法染色,酯酶同工酶采用坚牢蓝RR盐染色法染色.染色完毕经蒸馏水冲洗后于7%醋酸溶液中固定.
2 结果与分析
2.1 过氧化物酶同工酶酶谱的比较
椰甲截脉姬小蜂室内与野外种群POD同工酶电泳模式图见图1.按酶带颜色深浅及宽窄可分为强带、次强带和弱带.酶带颜色的深浅代表酶活性,颜色越深,活性越强;酶带宽窄代表酶的含量,酶带越宽,酶含量越高[6].两个种群共显示5种迁移率不同的POD同工酶带,迁移率在0.038~0.208之间,同一种酶带的迁移率基本相同(见表1).从阴极到阳极依次将酶带编号为P1、P2、P3、P4、P5.

图1 椰甲截脉姬小蜂室内外种群POD同工酶电泳模式图Fig.1 Peroxidase isozyme schematic diagram of laboratory and field populations of Asecodes hispinarum

表1 椰甲截脉姬小蜂室内外种群POD同工酶酶带相对迁移率Tab.1 Peroxidase isozyme mobility of laboratory and field populations of Asecodes hispinarum
由图1可知,椰甲截脉姬小蜂两个种群的POD同工酶酶带可以分为两个染色区段,第一区段包括迁移率为0.038和0.075的两条酶带,剩下3条同属于第二区段.第一区段两条酶带的颜色比第二区段浅,而且窄,均为弱带;第二区段的酶带较强.两个种群的酶谱存在较明显的差异,野外种群有5条同工酶带,比室内种群多了一条迁移率为0.038的P1酶带,其余4条酶带为两个种群共有,但野外种群酶带的颜色普遍比室内种群的深,表明其POD活性比室内种群强.另外室内种群的P2酶带比野外种群的P2酶带稍窄,表明此处野外种群的POD酶含量较室内种群高.
2.2 酯酶同工酶酶谱的比较
经多次重复试验比较,其特征酶谱稳定性和重复性较好,说明以酯酶同工酶作为椰甲截脉姬小蜂的生化比较指标具有一定的可靠性.室内外种群的EST同工酶电泳模式图见图2.其酶谱共显示6种迁移率不同的EST同工酶酶带,同一种酶带的迁移率基本相同(见表2).从阴极到阳极可将酶带分为A、B、C、D四个染色区,依次将酶带编号为A1、A2、B1、C1、C2、D1.

图2 椰甲截脉姬小蜂室内外种群EST同工酶电泳模式图Fig.2 Esterase isozyme schematic diagram of laboratory and field populations of Asecodes hispinarum
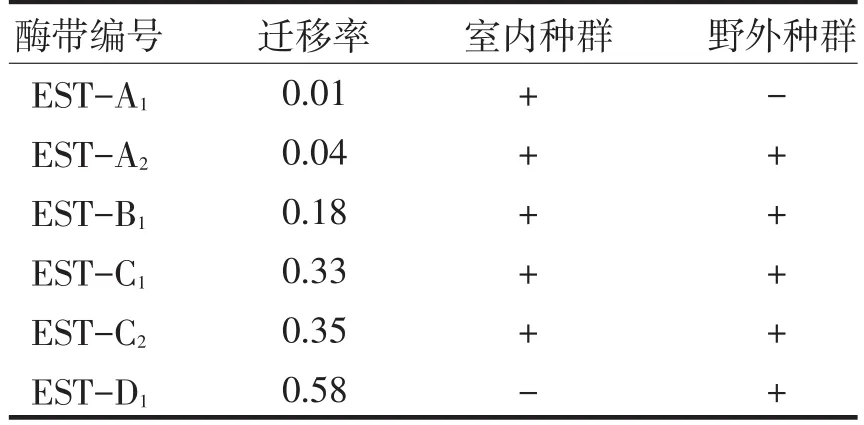
表2 椰甲截脉姬小蜂室内外种群EST同工酶酶带相对迁移率Tab.2 Esterase isozyme mobility of laboratory and field populations of Asecodes hispinarum
由图2可知,室内种群共显示5条酶带,而野外种群有6条酶带,A、B、C区两种群均有分布且有相同的的迁移率,但每条酶带的颜色深浅及宽窄存在差异.室内、野外种群的酶带A1宽窄与颜色深浅比较相似,均为极强带,室内种群相比于野外种群酶带A2、C1、C2的颜色要稍许深些,分别为强带、较弱带、极强带,而野外种群的分别为较强带、弱带、强带.室内种群相比于野外种群缺少D区Rf=0.58的D1酶带.
3 讨论
酶的变化可以反应生物的多种适应性变化.从实验的结果来看,椰甲截脉姬小蜂室内种群与野外种群过氧化物酶及酯酶同工酶的酶谱存在较明显的差异,说明该蜂为适应野外的环境已经发生了适应性的变化.
杨秀芬等[7]在对异色瓢虫10种色斑型的EST同工酶研究中表明,在不同生态环境下相同色斑型的异色瓢虫酶谱不同.椰甲截脉姬小蜂在室内和野外两种不同的生态环境下,POD和EST酶谱均存在差异,但两个种群的酶谱相似程度仍然比较高,因此,变化的程度仍需进一步详细的研究.
生物的遗传变异反映了生物群体内多态等位基因的存在,是生物进化的先决条件,也是同工酶技术在研究生物分类及系统进化中得以应用的理论基础[8].同工酶作为基因表达的直接或间接产物,它们的丰富程度直接影响生物体的机能和对环境的适应能力.同工酶多态性越高,越复杂,表明其遗传多样性越丰富,群体更能适应环境[9].通过对椰甲截脉姬小蜂室内外种群POD同工酶和EST同工酶酶谱的比较,可以看到野外种群比室内种群的POD多一条Rf=0.038的酶带,EST也多一条Rf=0.58的酶带,这也许就是该蜂为适应野外多变的环境微进化反应.
所有需氧生物的生理过程均有自由基的产生和消除,并且两者存在动态平衡,如果失去平衡,便会对机体造成损伤引起病变[10].同样,昆虫也有一套由过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)等抗氧化酶组成的抗氧化系统,用以减少氧化胁迫.有研究表明,昆虫的保护酶系统与昆虫的耐热性有关[11].从本实验结果来看,椰甲截脉姬小蜂野外种群POD活性比室内种群强,其原因可能就是该蜂的野外种群采自海南的5月至11月,这段时间的温度比室内的25℃左右的温度高,为了更好的适应相对较高温的环境,提高机体的耐热性,增加POD的活性,有利于清除过氧化氢,平衡体内的自由基.
孙蕊芬等[3]比较了椰甲截脉姬小蜂野外种群和室内种群的雌雄比、出蜂量、未出蜂量、怀卵量的差异,表明野外种群和室内种群已经出现了明显的分化,室内条件与野外条件确实能造成种群的分化.研究两个种群的过氧化物酶和酯酶,为两个种群的差异性提供了生化上的证据.但结果是初步的.仍有许多复杂的适应性问题需要进一步研究.现从生物学和生化的角度均证明,椰甲截脉姬小蜂释放到野外后发生了适应性的变化,如果能对这种变化加以人为的利用,建立起真正适应野外生存的种群,对椰心叶甲的防治将具有十分重要的意义.
[1]金化亮,陈青,金启安,等.热胁迫对椰甲截脉姬小蜂生长发育和繁殖的影响[J].热带作物学报,2010,31(4):631-635.
[2]李朝绪,覃伟权,黄山春,等.海南利用寄生蜂防治椰心叶甲效果分析[J].林业科技开发,2008,22(1):41-44.
[3]孙蕊芬,田小青,张先敏,等.椰甲截脉姬小蜂野外种群与实验种群差异性比较[J].应用昆虫学报,2011,48(4):934-940.
[4]孙蕊芬.温度对椰甲截脉姬小蜂适应性的影响[D].海口:海南师范大学,2011.
[5]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2006:42-84.
[6]赵莉,曲延英,岳不昌,等.新疆两种粉虱的酯酶和过氧化物酶同工酶的比较研究[J].植物保护,2002,28(4):17-18.
[7]杨秀芬,宗良炳.异色瓢虫不同色斑型酯酶同工酶研究[J].河北农业大学学报,1991,14(1):55-60.
[8]齐宝瑛,郑哲民.昆虫学研究中同工酶电泳及PCR-RAPD技术的应用[J].内蒙古师范大学学报:自然科学版,2002,31(3):252-261.
[9]高保全,刘萍,李健,等.三疣梭子蟹野生群体同工酶的遗传多态性分析[J].水产学报,2007,31(1):1-6.
[10]李毅平,龚和.昆虫体内抗氧化系统研究进展[J].生命科学,1998,10(5):240-243.
[11]李志明,陈青,唐超,等.高温对椰心叶甲啮小蜂保护酶系活性的影响[J].热带作物学报,2010,31(6):994-998.

