黏红酵母CCZU-G5选择性加氢柠檬醛合成香叶醇
朱 劼,汪 云,李晨旸,符梦婷,王利群,何玉财
(常州大学制药与生命科学学院,江苏 常州 213164)
催化加氢,尤其对α,β-不饱和醛的选择性催化加氢,是精细化学品合成工艺中一类非常重要的有机催化反应。由于其在香料化学[1]和药物合成[2]上的广泛应用,近年来,备受人们的关注。柠檬醛(citral)作为一种典型的α,β-不饱和醛,其分子结构中拥有3个加氢位点:碳氧双键(C=O),与碳氧双键共轭的碳碳双键(C=C)以及孤立的碳碳双键(C=C)。对柠檬醛进行加氢反应,随加氢位置和加氢程度的不同,分别可得到不饱和醇、饱和醛、饱和醇或烷烃等产物[3-5],反应路径如图1所示。柠檬醛的选择性加氢产物-香叶醇(geraniol)为合成维生素A、E的重要中间体;其本身入药亦具有抗菌和驱虫的功效;同时,其临床治疗慢性支气管炎效果也较好,不仅有改善肺通气功能和降低气道阻力的作用,而且对提高机体免疫功能也颇有裨益[6]。因此,对合成香叶醇的研究具有非常重要的学术意义及经济价值。

图1 柠檬醛加氢反应路线
香叶醇虽然用途广泛,但在自然界中存在较少,化学工业上主要通过选用合适的催化剂对柠檬醛加氢获取。由于柠檬醛分子中 C=C键的键能(615 kJ/mol)小于C=O键的键能(715 kJ/mol)[7],因此,从热力学角度看,加氢反应更易在C=C键上发生,对不饱和醇的选择性较差。目前,对香叶醇的合成普遍采用贵金属催化剂,通过改变载体结构、活性中心、溶剂等因素提高对中间产物的选择性[8-11]。例如,Malathi等[11]以 TiO2为载体,制备5%Pt/TiO2,考察柠檬醛催化加氢制备香叶醇的性能,结果表明,以95%乙醇为溶剂,45 ℃及常压条件下,反应5 h后,底物转化率为29%,而对香叶醇的选择性则接近 100%。此类催化剂虽然具有较高的催化性能,但贵金属(Ru、Rh、Pd、Pt、Ir、Au等)作为一类重要的战略资源,其储量相对稀少,开采、提炼成本高,导致其价格昂贵且供应量少;而大量研究表明,廉价的非贵金属催化剂如Ni对催化生成不饱和醇的选择性较差[12]。如何开发绿色经济的催化体系,提高不饱和醇的选择性,是研究者面临的一大难题。
与传统的化学催化体系相比,生物催化具有催化效率高、产物专一性强、反应条件温和等明显的优势。生物催化剂日益被人们看作是相对廉价绿色的手性催化剂,在一定程度上能够满足特殊的需求。近年来,利用微生物的羰基还原酶对不饱和羰基化合物进行催化加氢反应的研究已有报道。Müller等[13]采用两相发酵法考察了不同菌种对柠檬醛催化加氢的能力。结果表明,Z. mobilis和Citrobacter freundii两种细菌在辅酶NADPH存在的前提下,显示出较高的柠檬醛还原酶催化活性。梅乐和等[14]使用面包酵母、XST-KO酵母和假丝酵母催化加氢香叶醇,部分得到香茅醇,为菌株的进一步筛选打下基础。马丽等[15]将Mucorsp. JX23的发酵液直接用于生物催化肉桂醛选择加氢制肉桂醇的反应,取得较好的效果,肉桂醛的转化率为 82.9%,肉桂醇的选择性为90.4%。
本文作者利用课题组筛选的具有较高羰基还原酶活性的黏红酵母CCZU-G5,在水相中对柠檬醛进行选择性加氢,考察底物及辅底物浓度、反应时间对柠檬醛转化率与香叶醇选择性的影响,为生物催化合成香叶醇的工业化提供参考。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
GC-950气相色谱仪,上海海欣色谱仪器有限公司;S53紫外可见光分光光度计,上海棱光技术优先公司;R2ID旋转蒸发器,巩义市予化仪器制造有限公司;THZ-072 HT恒温摇床,上海博彩生物科技有限公司。
柠檬醛,国药上海化学试剂公司;香叶醇,Sigma公司;苯酚,上海凌峰化学试剂有限公司;浓硫酸,国药上海化学试剂公司;葡萄糖,国药上海化学试剂公司。试剂均为国产色谱纯或分析纯。
1.1.2 菌株
黏红酵母:Rhodotorula mucilaginosaCCZUG5,本文作者课题组筛选并保存。
1.1.2 培养基
马铃薯葡萄糖培养基:马铃薯20 g/L,葡萄糖2 g/L,pH 值为6。
1.2 方法
1.2.1 菌体培养
从斜面上生长良好的菌体中挑取少许于液体培养基中,30 ℃、180 r/min条件下振荡培养60 h,每隔一段时间取样,通过对样品吸光度(OD600)的测定,绘制菌体浓度-吸光度标准曲线及菌体生长曲线,确定其对数生长期。
1.2.2 加氢反应
将培养至对数生长期末期的菌体于4 ℃、8000 r/min离心10 min,弃上清液,然后用PBS溶液(0.1 mol/L,pH值为7.0)洗涤两次后,转移至厌氧瓶中进行催化反应。反应体系包括:菌体浓度 0.2~0.5 g/mL PBS,辅底物葡萄糖添加量10~60 g/L,底物柠檬醛添加量1~8 g/L,反应时间1~26 h。
1.2.3 产物分析
反应液离心除去菌体后,上清液用乙醚萃取,采用气相色谱法分析柠檬醛转化率及香叶醇选择性。色谱条件为:检测温度250 ℃;汽化温度250℃;柱温由 80 ℃升温至 250 ℃,升温速率 5℃/min;载气为氮气,流量45 mL/min。
反应物柠檬醛的转化率(X)及产物香叶醇的选择性(Sgeraniol)分别表示为式(1)、式(2)。

式中,n为反应过程中的反应物或产物瞬时浓度;n0为反应的初始浓度;i为产物。
2 结果与讨论
2.1 菌体生长曲线的测定
利用微生物菌体进行的催化反应,本质上是微生物体内所发生的酶反应;而酶含量的多少及酶活的高低直接决定着生物催化反应效率。由微生物的生长周期可知,当处于对数生长期末期时,微生物的数量及活力均处于相对较高的程度;而利用此时的菌体进行催化反应,可大大提高其反应效率。本实验测定了黏红酵母CCZU-G5在30 ℃条件下60 h内的菌体生长曲线,如图2所示。

图2 黏红酵母CCZU-G5生长曲线
由图2可以看出,黏红酵母CCZU-G5在24 h前后开始进入对数生长期,28 h时达到对数生长期末期,此时的菌体数量达到最大,而菌体活力也相对较高,有利于提高之后所进行的加氢反应效率。因此,本文第二阶段的加氢反应使用培养 28 h的菌体。
2.2 辅底物浓度对柠檬醛选择性加氢反应的影响
绝大多数全细胞的不对称催化需要有辅酶再生体系与还原反应耦合,以维持反应的进行[16]。本实验考察了菌体浓度0.3 g/mL、柠檬醛浓度3 g/L、反应时间24 h条件下,辅底物葡萄糖浓度的变化对柠檬醛转化率及香叶醇选择性的影响,结果如图3所示。
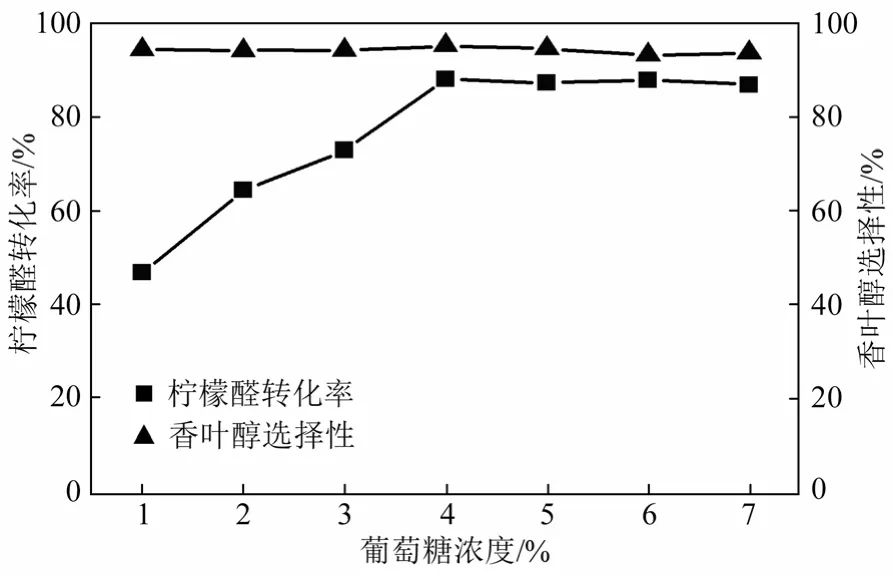
图3 葡萄糖浓度对柠檬醛选择性加氢反应的影响
由图3可知,随着葡萄糖浓度的增加,柠檬醛转化率逐渐上升;当葡萄糖含量达到40 g/L时达到最高,约为88%;当继续增加葡萄糖浓度时,转化率变化趋缓。然而,葡萄糖浓度对产物香叶醇的选择性影响不大,均保持在95%左右。因此,综合考虑成本与来源因素,选择40 g/L 葡萄糖辅作为辅底物用于后续实验的研究。
2.3 柠檬醛初始浓度对柠檬醛选择性加氢反应的影响
对生物催化而言,反应体系中不同初始浓度的底物对微生物催化的还原反应具有一定影响[17];初始阶段过多的柠檬醛将对酶活力产生较大抑制作用,不利于还原反应的发生。本实验通过对不同初始底物浓度下转化率和选择性的考察,探讨其对选择性加氢反应的影响。反应体系中,菌体浓度、辅底物葡萄糖添加量及反应时间分别维持0.3 g/mL、40 g/L及24 h,底物柠檬醛添加量1~8 g/L。结果如图4所示。
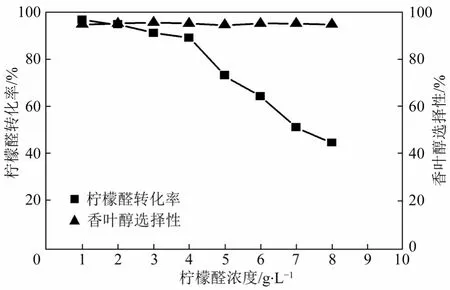
图4 底物浓度对柠檬醛选择性加氢反应的影响
由图4可知,随底物浓度的增加,柠檬醛转化率逐渐降低,证明了柠檬醛对黏红酵母 CCZU-G5具有一定的抑制作用;同时,当底物浓度从 1 g/L增加至4 g/L时,转化率变化较为缓慢,从96%下降至89%,计算可知,活力下降仅为7.3%;而当底物浓度超过4 g/L,转化率急剧下降。当柠檬醛浓度为 8 g/L时,转化率下降至 44%,活力下降高达54.2%。因此,4 g/L成为柠檬醛选择性加氢反应的转折点。但值得注意的是,柠檬醛的初始浓度对产物香叶醇的选择性并未产生很大影响,其始终维持在95%左右。综合柠檬醛转化率、香叶醇选择性及香叶醇产量等因素,柠檬醛初始浓度确定为4 g/L。
2.4 菌体浓度对柠檬醛选择性加氢反应的影响
生物催化体系中,催化剂用量对还原反应有着直接的影响[18]。本实验考察了40 g/L柠檬醛初始浓度,40 g/L辅底物葡萄糖浓度条件下,不同用量的菌体(0.1~0.5 g/mL)对选择性加氢反应的影响。结果如图5所示。
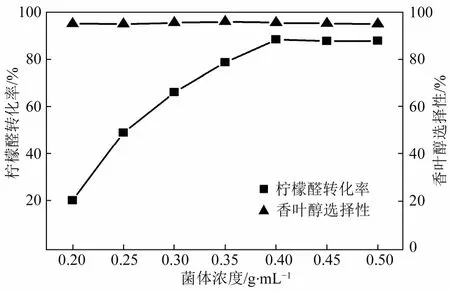
图5 菌体浓度对柠檬醛选择性加氢反应的影响
从图5可以看出,随着菌体用量的增加,柠檬醛转化率不断增加,0.4 g/mL菌体作用下转化率达到 88.6%;继续提高菌体用量,转化率不再增加。表明0.4 g/mL的菌体浓度对柠檬醛的选择性加氢反应已达到饱和。而菌体用量的改变对产物香叶醇的选择性影响不大,维持在95%左右。因此,最佳菌体浓度为0.4 g/mL。
2.4 反应时间对柠檬醛选择性加氢反应的影响
本实验在确定辅底物及底物浓度,菌体用量等最佳条件后,最后考察反应时间对柠檬醛选择性加氢反应的影响。反应体系中菌体浓度、葡萄糖及柠檬醛添加量分别维持0.4 g/mL、40 g/L及4 g/L。结果如图6所示。
从图中可以看出,随反应时间的延长,柠檬醛转化率不断增加,反应 22 h后,转化率达到最大(88.6%),此时对香叶醇的选择性为95.2%。之后,反应基本趋于停滞。由此推测,反应22 h后,由于底物柠檬醛的不断消耗及香叶醇的持续产生,对菌体中羰基还原酶的活力产生较大抑制,导致反应趋于停滞。因此,反应时间确定为22 h。
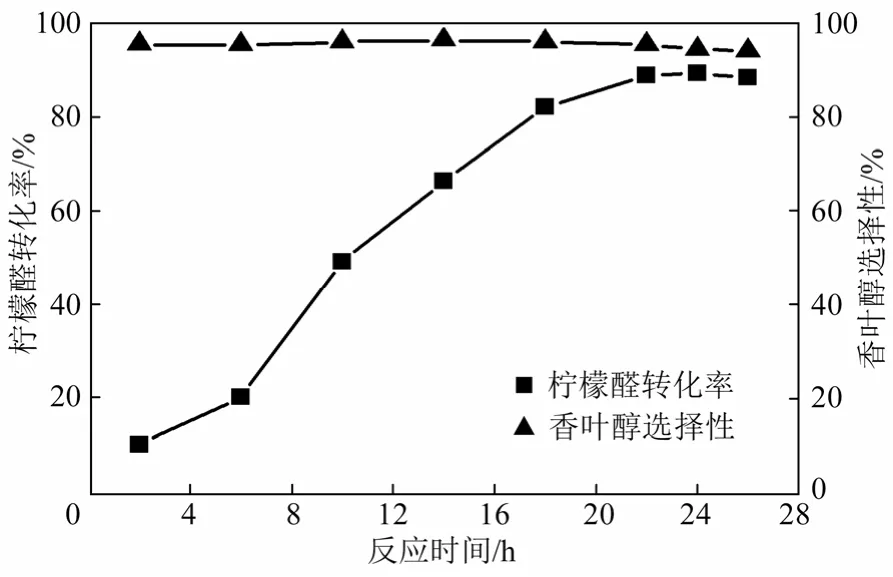
图6 反应时间对柠檬醛选择性加氢反应的影响
3 结 论
利用本文作者课题组筛选的黏红酵母 CCZUG5,对柠檬醛进行选择性加氢反应。辅底物葡萄糖、底物柠檬醛及菌体浓度分别为40 g/L、4 g/L及0.4 g/mL时,反应22 h后,柠檬醛转化率达到最大,为 88.6%;对香叶醇的选择性达到 95.2%。黏红酵母CCZU-G5对选择性加氢柠檬醛合成香叶醇具有较大的优势。
[1] 刘树文. 合成香料技术手册[M]. 北京:中国轻工业出版社,2000:13-107,160-243.
[2] 许关煜. 医药中间体手册(上册)[M]. 北京:化学工业出版社,2000:53,202,250.
[3] Gallezot P,Richard D. Selective hydrogenation of alpha,beta-unsaturated aldehydes[J].Catal. Rev.:Sci. Eng.,1998,40(1-2):81-126.
[4] Boudart M. Catalysis-fine tuning metal clusters[J].Nature,1994,372(6504):320-320.
[5] Mäki-Arvela P,Hájek J,Salmi T,et al. Chemoselective hydrogenation of carbonyl compounds over heterogeneous catalysts[J].Appl. Catal. A:Gen.,2005,292:1-49.
[6] 徐克勋. 精细有机化工原料及中间体手册(3)[M].北京:化学工业出
[7] Müller A,Hauer B,Rosche B. Enzymatic reduction of the α,β-unsaturated carbon bon版社,1998:151-161.
[8] Noller H,Lin W M. Activity and selectivity of Ni-Cu/Al2O3catalysts for hydrogenation of crotonaldehyde and mechanism of hydrogenation[J].J. Catal.,1984,85(1):25-30.
[9] Matthey D,Wang J G,Wendt S,et al. Enhanced bonding of gold nanoparticles on oxidized TiO2(110)[J].Science,2007,315:1692-1696.
[10] Liu H,Jiang T,Han B,et al. Selective phenol hydrogenation to cyclohexanone over a dual supported Pd–Lewis acid catalyst[J].Science,2009,326:1250-1252.
[11] Kovtunov K V,Beck I E,Bukhtiyarov V I,et al. Observation of parahydrogen-induced polarization in heterogeneous hydrogenation on supported metal catalysts[J].Angew. Chem. Int. Ed.,2008,47(8):1492-1495.
[12] Malathi R,Viswanath R P. Citral hydrogenation on supported platinum catalysts[J].Appl. Catal. A:Gen.,2001,208(1-2):323-327.
[13] 李新.α,β-不饱和醛选择性加氢研究进展[J]. 江苏化工,2004,32(6):13-15.
[14] d in citral[J].J.Mol. Catal. B:Enzym.,2006,38(3-6):126-130.
[15] 梅乐和,洪骏,姚善泾. 有选择性催化加氢作用的酵母菌株的初步筛选[J]. 化工学报,2000,51 (S1):203-206.
[16] 马丽,刘雄民,韦一萍.Mucorsp. JX23发酵液生物催化肉桂醛选择加氢制肉桂醇[J]. 化工进展,2009,28(8):1431-1434.
[17] Kataoka M,Bohani L P S,Wada M,et al.Escherichia colitransformant expressing the glucose dehydrogenase gene fromBacillus megateriumas a cofactor regenerator in a chiral alcohol production system[J].Biosci. Biotechuol. Biochem.,1998,62(1):167- 169.
[18] Nakamura K,Kawai Y,Nakajima N,et al. Stereochemical control of microbial reduction 17:A method for controlling the enantioselectivity of reductions with Baker’s yeast[J].J. Org. Chem.,1991,56(15):4778-4783.
[19] 杨锦,方世银,石贤爱. 水相中酿酒酵母催化3-氯-1-苯丙酮的不对称还原反应[J]. 过程工程学报,2011,11(2):324-328.

