短乳杆菌产胸苷磷酸化酶发酵培养基的优化
王伟洁,李红梅,薛 芳,陈宝珍,高露娇
(1上海理工大学医疗器械与食品学院,上海 200093;2东海水产研究所,上海 200090)
胸苷磷酸化酶广泛存在于动植物及微生物中,并参与细胞核酸代谢途径,在“补救途径(salvage path)”中可催化脱氧胸苷可逆磷酸化反应,提供脱氧核糖-1-磷酸,释放碱基胸腺嘧啶,加入另一种碱基形成新的核苷。在生物合成核苷药物中具有重要作用[1-2]。
核苷磷酸化酶产生菌主要有大肠杆菌、乙酰短杆菌、欧文杆菌、干燥棒杆菌以及佐氏库特氏菌等[1]。关于酶法合成核苷类药物的报道很多。如沈荣坤等[3]以大肠杆菌为酶源,利用胸腺嘧啶和2'-脱氧核苷合成胸苷;李喻等[4]利用乙酰短杆菌为酶源,胸苷和鸟苷酸为底物,2'-脱氧鸟苷的转化率高达56.4%;洪云海等[5]利用乙酰短杆菌为酶源,胸苷和腺嘌呤为底物,2'-脱氧腺苷的转化率可达 65.6%。目前利用含有核苷磷酸化酶的菌株合成核苷类药物的转化率均较低,其关键问题在于菌株含酶量很少,因此如何提高菌体含酶量从而提高单位菌体酶活以提高生物催化转化的效率是全细胞催化研究的重点。
从文献调研看,提高含酶量最有效最快捷方法主要是通过改良微生物产酶培养基。以正交试验、均匀设计、响应面方法、神经网络等方法为代表的数学统计优化方法广泛地应用于微生物发酵培养基的优化工作中,取得了显著的成果[6]。本研究将首次以实验室筛选获得的短乳杆菌作为产胸苷磷酸化酶菌种,将Placket-Burman设计、最陡爬坡法逼近最大响应区域以及采用响应面中心组合设计相结合对短乳杆菌产胸苷磷酸化酶能力进行优化,为后续发酵生产核苷及其衍生物提供实验基础[7]。
1 材料和方法
1.1 材料
1.1.1 菌种
短乳杆菌为实验室保存。
1.1.2 培养基
(1)斜面培养基 葡萄糖20.0 g/L,酵母膏10.0 g/L,氯化钠5.0 g/L,琼脂20.0 g/L,pH值7.0~7.2。
(2)活化液 酵母膏10.0 g/L,自然pH值。
(3)初始发酵培养基 葡萄糖20.0 g/L,酵母膏10.0 g/L,氯化钠5.0 g/L,pH值7.0~7.2。
1.2 培养条件
将短乳杆菌接种在固体斜面培养基上培养,在4 ℃冰箱中保存备用。在无菌环境下从斜面培养基上挑取两环菌体接种到装液量为50 mL的250 mL锥形瓶活化液中,在36 ℃摇床转速为110 r/min条件下活化10~12 h。然后以一定的接种量接种到初始发酵培养基中,在摇床转速为 110 r/min、36 ℃条件下继续培养12 h。
1.3 分析方法
1.3.1 湿菌体的制备
将培养好的菌体4000 r/min离心15 min,去除上清液后,再用pH值为7.3的无菌磷酸缓冲液冲洗两次,离心,得到湿菌体冷藏备用。
1.3.2 胸苷磷酸化酶活测定方法——紫外分光光度法
据Saunders等报道[8],采用分光光度法测定反应生成的胸腺嘧啶来表征产酶量。标准酶反应混合液包含一定浓度的湿菌体,25 mmol/L的胸苷,1 mmol/L的EDTA,pH值为7.3、50 mmol/L的磷酸钾缓冲溶液。55 ℃条件下反应一段时间,反应结束后,反应液在沸水中煮沸5 min终止反应,离心去除沉淀。上清液用pH值为12的NaOH溶液稀释100倍,然后测定290 nm的紫外吸光度OD290nm的增值[9]。胸苷磷酸化酶酶活单位定义为:在上述条件下,1 min内OD290nm变化0.01所需的湿菌体量定义为短乳杆菌的一个酶活力单位[12]。
1.4 实验设计方法
1.4.1 PB设计
选取发酵温度、发酵时间、摇床转速、初始pH值、接种量、葡萄糖、酵母膏、NaCl、蛋白胨和胸苷作为PB设计的10个因子,具体设计和分析方法参照文献[10]进行。根据实验数据拟合的一次多项式确定最陡爬坡方向,以此逼近最大响应区域。
1.4.2 CCD实验
根据PB设计以及最陡爬坡试验确定实验因素和水平,进行了三因素三水平的中心组合实验,通过 Design Expert 8.0完成试验设计并分析实验数据。
1.4.3 SDS-PAGE电泳分析
按照优化前和优化后的培养基及培养条件培养发酵并收集湿菌体,采用酶解-超声耦合法破碎湿菌体制备胸苷磷酸化酶液,具体方法如下:将湿菌体按照一定浓度稀释,在300 μg/mL的溶菌酶液下37℃酶解1.5 h,随后将酶解液在450 W功率下超声破碎处理12次(超声40 s/间歇20 s),最后将破壁后的菌液在转速为 13 000 r/min,4 ℃低温离心 30 min,收集上清液进行SDS-PAGE电泳。
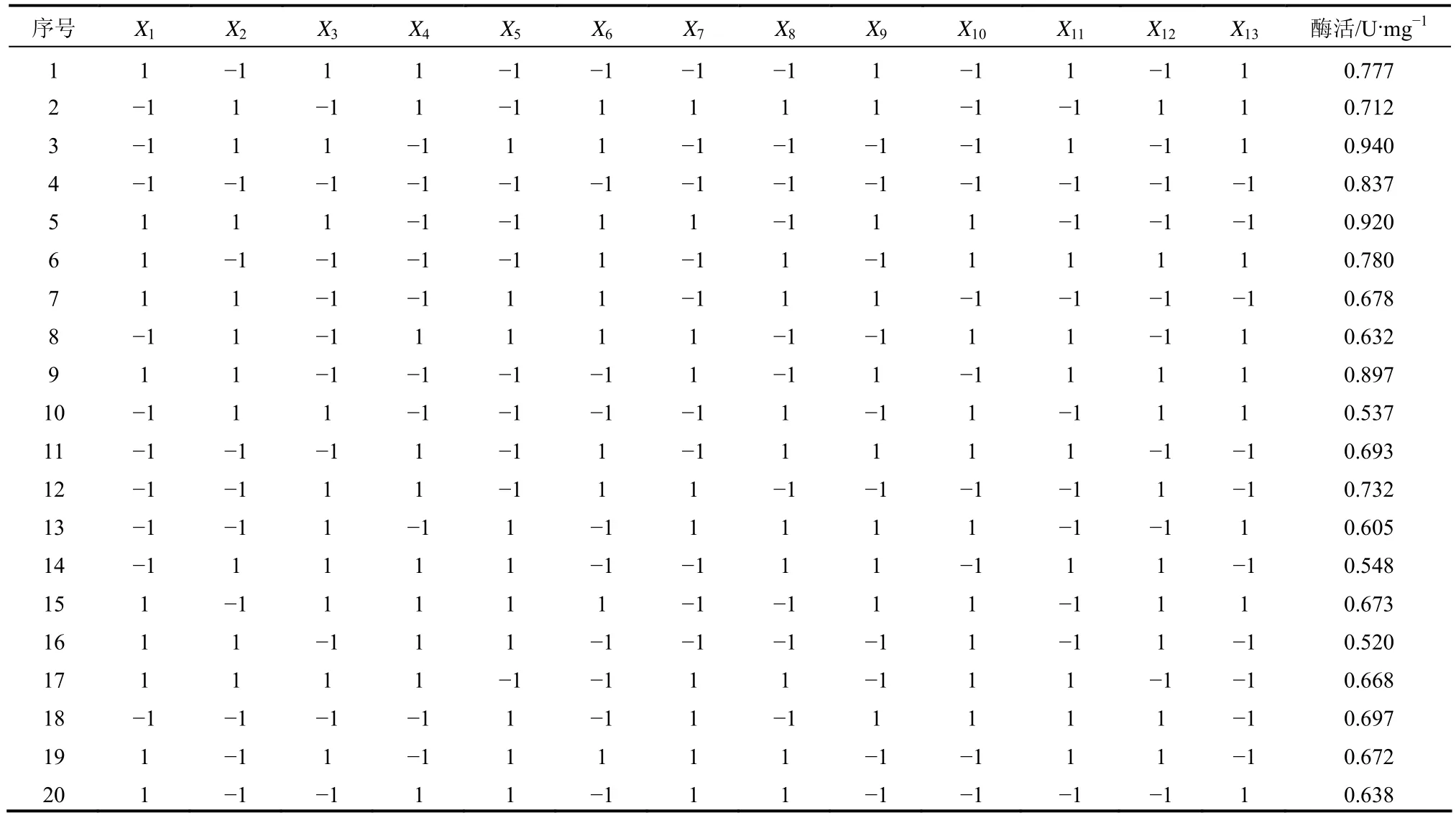
表1 Plackett-Burman实验设计及结果
2 结果与讨论
2.1 Plackett—Burrman 设计筛选影响产酶的重要因素
在预试验中发现发酵培养基中添加蛋白胨和底物胸苷对胸苷磷酸化酶酶活有一定的促进作用,因此结合文献资料,选取初始葡萄糖、酵母膏、NaCl、蛋白胨、胸苷、pH值、摇床转速、培养时间、接种量、发酵温度作为PB设计的10个因素(X1、X2、X4、X5、X7、X8、X9、X11、X12、X13),具体实验设计见表1,使用minitab15.0软件对实验结果进行回归方差分析其结果见表2。
从变量的效应可看出初始pH值、发酵温度、酵母膏、NaCl和胸苷对短乳杆菌产胸苷磷酸化酶有正效应,转速、发酵时间、接种量、葡萄糖和蛋白胨显示出负效应。在置信区间95%之中,接种量、发酵时间和葡萄糖浓度相比其它因素而言对系统的响应值影响较为显著,因此确定选择发酵时间、接种量和葡萄糖浓度 3个因素进行后续的响应面优化,以确定最佳培养基组成和发酵条件。
2.3 最陡爬坡实验
PB设计实验结果表明,接种量、发酵时间和葡萄糖具有负效应,因此可通过降低接种量、发酵时间和葡萄糖浓度来提高产胸苷磷酸化酶能力。其它因素的取值则根据正效应的因素取较高值,负效应的因素取较低值。结合实际需要,对影响显著的 3个重要因素的步长进行相应的设计,具体取值及实验结果见表3。由表3可知,2号培养基的胸苷磷酸化酶活最高1.008 U/mg,从3号开始,胸苷磷酸化酶活明显降低,因而选用2号所对应的因素水平作为后续中心组合设计的中心点。
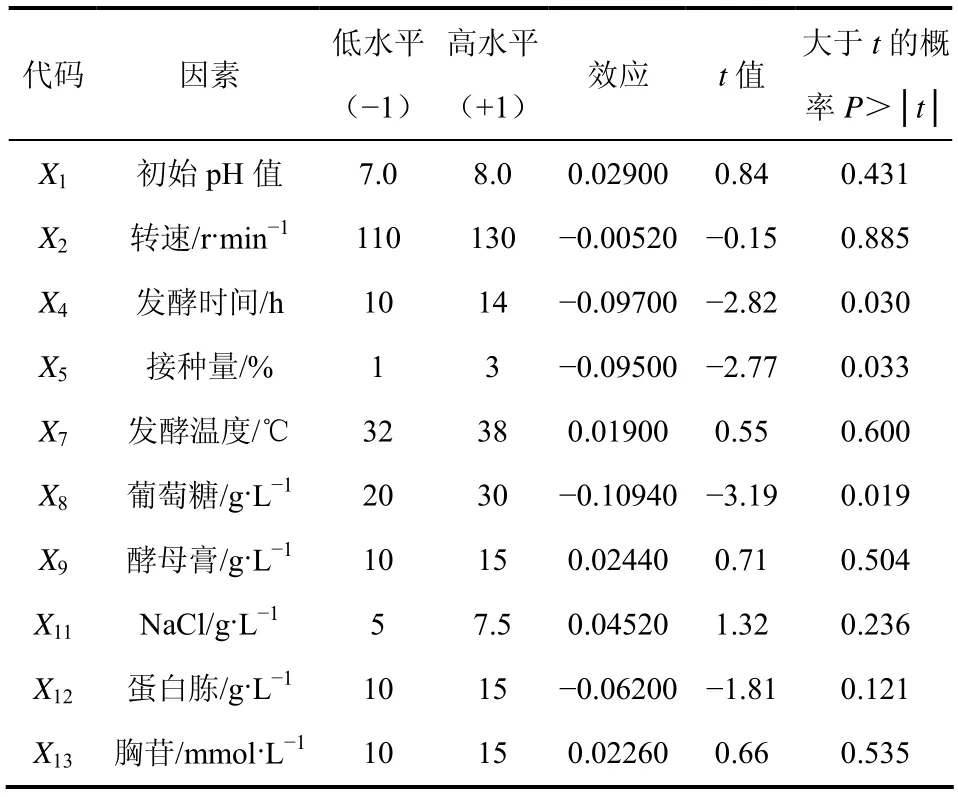
表2 Plackett-Burman实验结果的方差分析
2.4 响应面拟合及最优条件的确定
根据PB设计及最陡爬坡实验确定的实验因素及水平,采用“Design Expert 8.0”的中心组合设计法设计3因素的CCD实验,以胸苷磷酸化酶活为响应值,取5个水平,以(−1.682,−1,0,1,1.682)编码,中心点实验重复数为6,设计20组实验[11],实验水平及编码值见表4,实验设计及结果见表5。
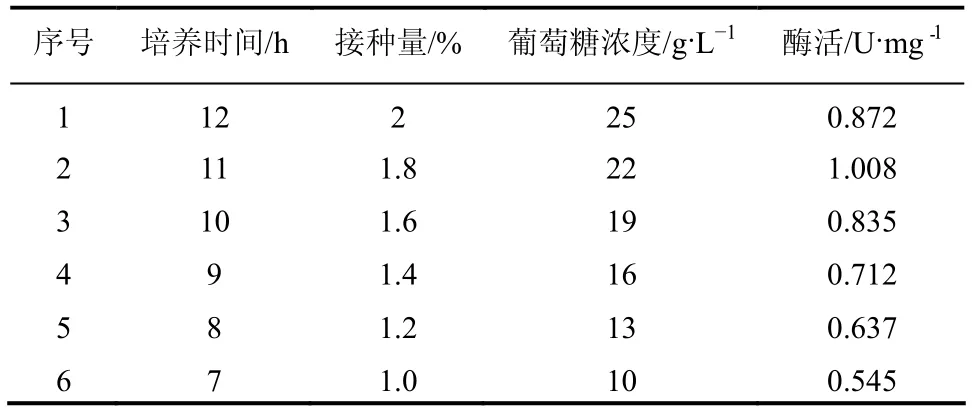
表3 最陡爬坡实验设计及结果
对表5中的实验结果进行二次多项式回归拟合,得到胸苷磷酸化酶活对培养时间、接种量和葡萄糖浓度的拟合线性回归方程如式(1)。

Y为短乳杆菌湿菌体胸苷磷酸化酶酶活的预测值;A、B、C分别为培养时间、接种量和葡萄糖浓度的编码值。由表6可知,该模型极显著(p=0.0004),在研究的整个回归区域拟合较好,并能作出较准确的预测[10]。求回归方程式(1)得模型极值点坐标:A=10.57 h,B=1.54%,C=18.00 g/L,此时模型预测的最大值为1.152 U/mg。由图1可直观地看出各因子对响应值的影响变化趋势,每个响应图分别代表着两个独立变量之间的相互作用,此时第3个变量保持在0水平。
2.5 回归模型验证试验
为了检验模型预测的准确性,在最佳培养条件下,做5次重复实验,得到胸苷磷酸化酶活为1.172 U/mg,基本与响应面预测的最大1.152 U/mg符合,说明响应面法优化得到的数学模型与实验数据拟合的较好。在初始发酵条件,短乳杆菌湿菌体胸苷磷酸化酶活为0.400 U/mg,优化后提高了2.93倍。
2.6 SDS-PAGE分析
将优化前和优化后获得的湿菌体破胞离心获得的酶液进行SDS-PAGE分析,每个实验平行进行3次,优化前后胸苷磷酸化酶浓度如图2所示。文献资料显示,微生物体内含有三类核苷磷酸化酶,分别是嘌呤磷酸化酶(2.582×104)、尿苷磷酸化酶(2.8×104左右)及胸苷磷酸化酶(4.3×104左右)[12]。从图中可以看出,在三类核苷磷酸化酶中只有胸苷磷酸化酶分子量条带(胸苷磷酸化酶相对分子质量4.3×104)高于优化前,其它两种核苷磷酸化酶的生产情况却未得到改善,因此可以避免在全细胞生物催化转化的过程中由于嘌呤磷酸酶和尿苷磷酸化酶利用内源性底物合成非目标核苷类物质,从而影响胸苷磷酸化酶合成的目标产物的分离。
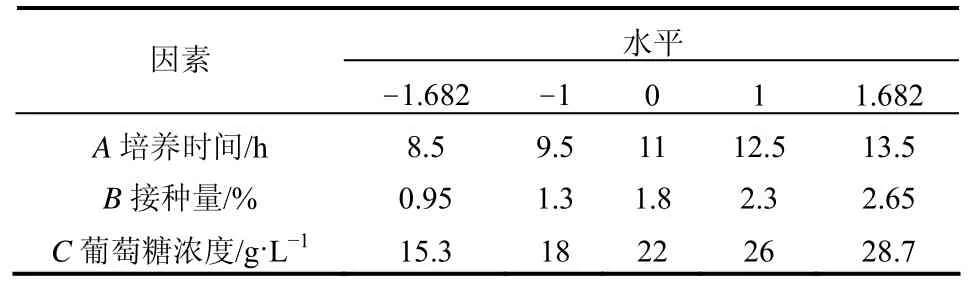
表4 CCD实验设计因素水平及编码值
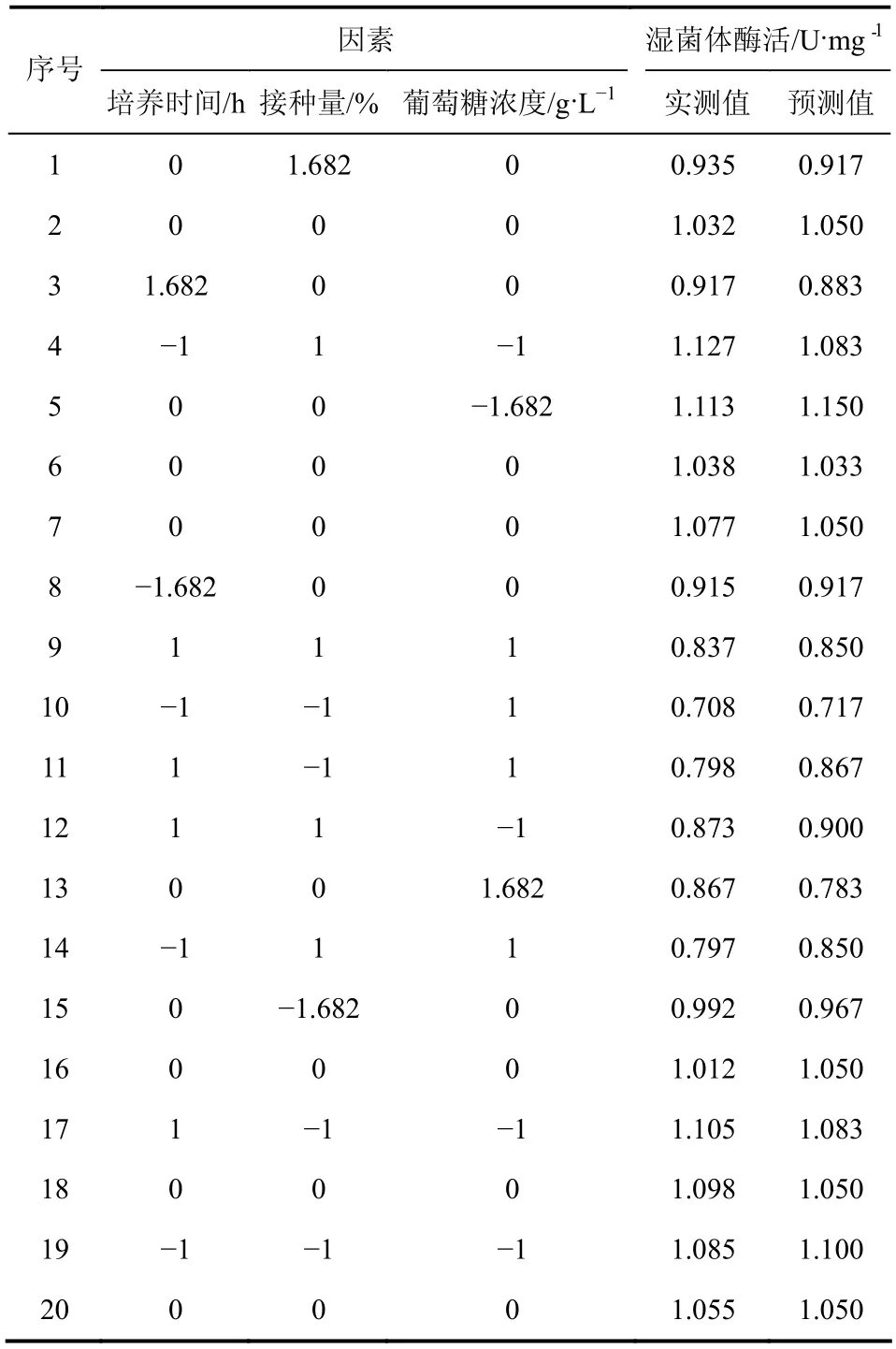
表5 CCD实验设计及结果
3 结 论
微生物发酵培养基的种类、各组分浓度及培养条件均会影响微生物代谢过程中产酶量。从文献调研看,尽管胸苷磷酸化酶存在于许多微生物体内,但目前关于短乳杆菌产胸苷磷酸化酶的研究鲜有报道。本研究采用响应面法优化产胸苷磷酸化酶短乳杆菌发酵培养基及发酵条件得出以下结论。
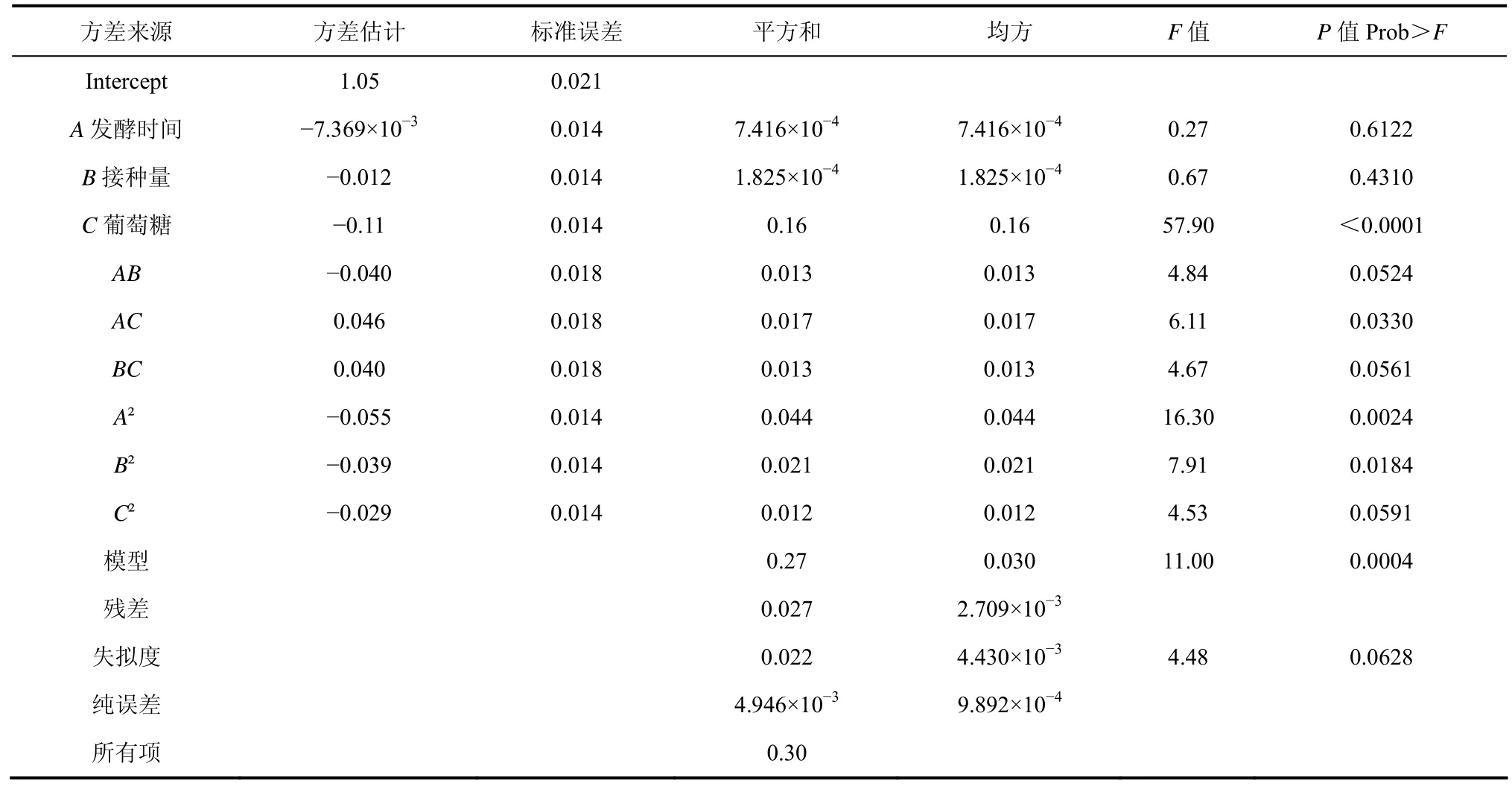
表6 响应面二次模型的方差分析
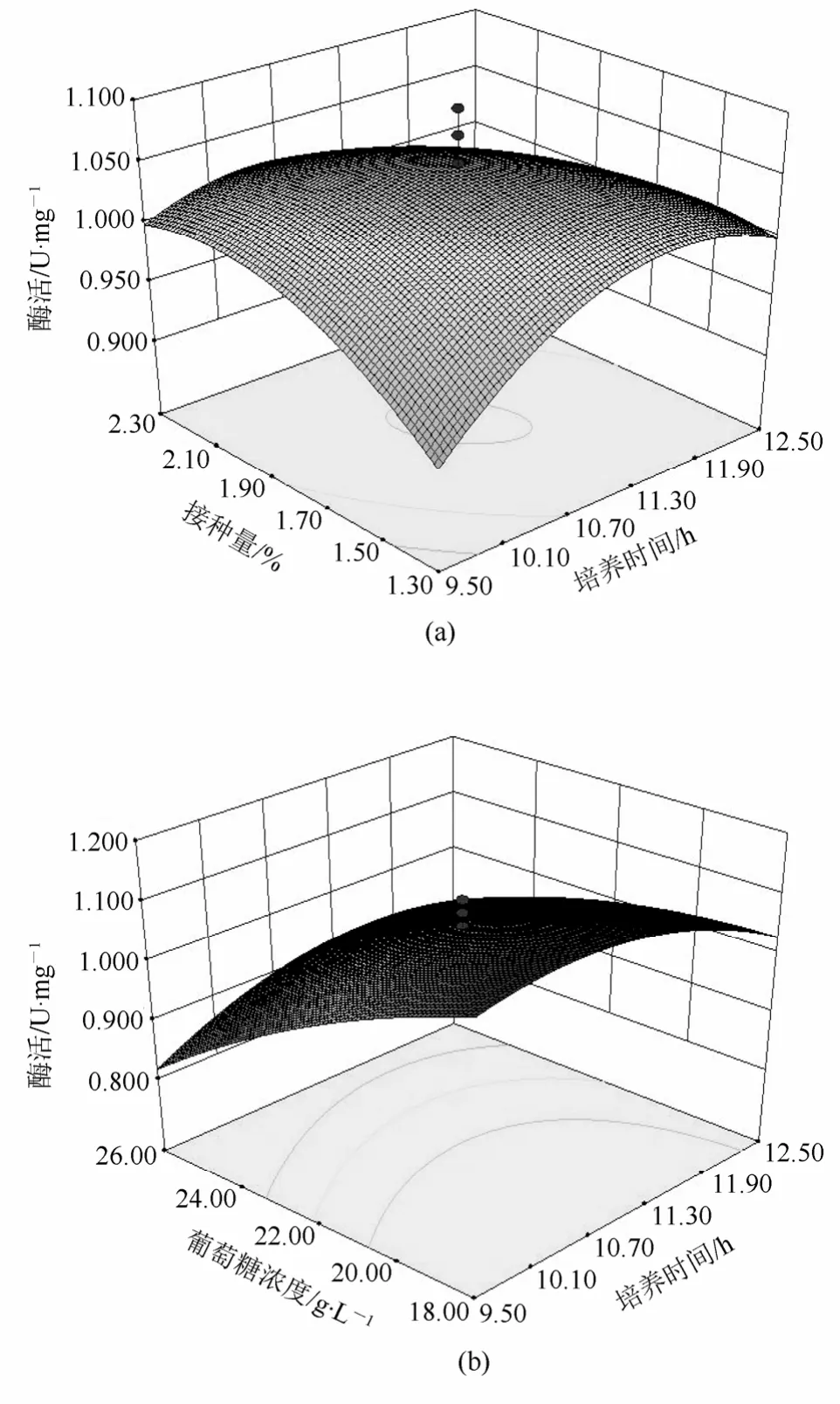
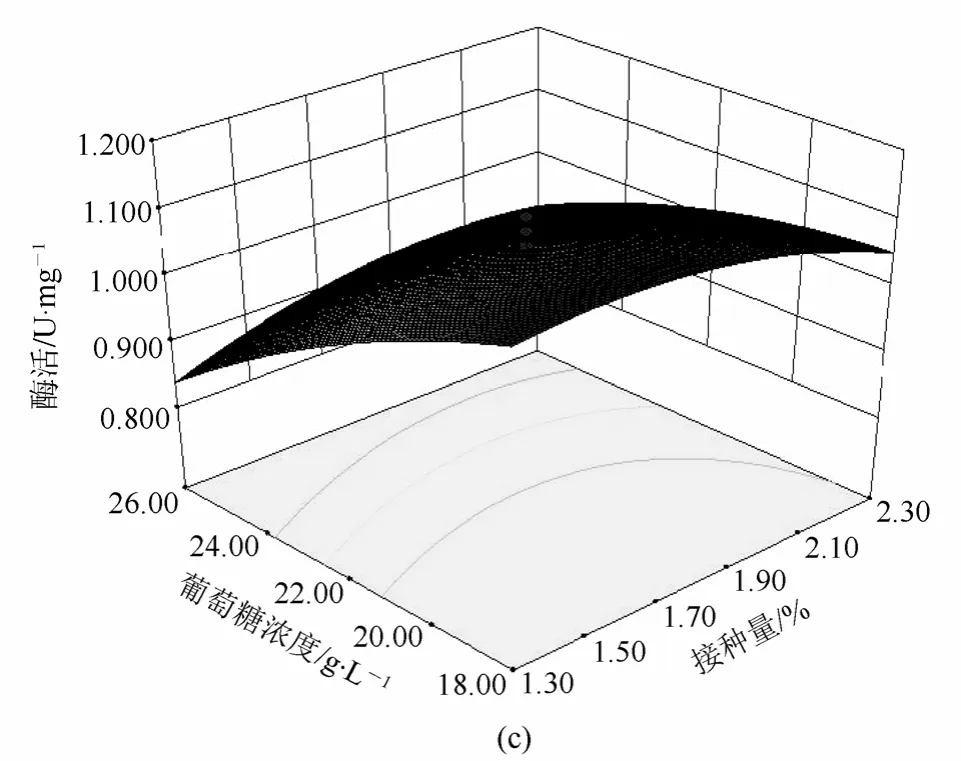
图1 培养时间、接种量、葡萄糖浓度影响胸苷磷酸化酶活的响应面图
(1)在传统的以酵母膏,葡萄糖以及氯化钠培养基基础上添加一定浓度的蛋白胨和胸苷能有效促进短乳杆菌分泌胸苷磷酸化酶。
(2)在发酵培养条件方面,通过优化后发现,提高发酵温度和采用偏碱性的pH值等(未优化前采用32 ℃,pH 值为7.0)更有利于提高短乳杆菌产胸苷磷酸化酶。
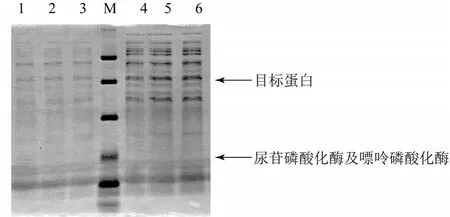
图2 SDS-PAGE分析短乳杆菌产胸苷磷酸化酶能力
(3)优化后确定最佳培养基配方为:酵母膏15 g/L,NaCl 7.5 g/L,蛋白胨10 g/L,胸苷15mmol/L,葡萄糖18 g /L。发酵条件为:pH值8.0,摇床转速110 r/min,发酵温度38 ℃,培养时间10.57 h,接种量 1.54%。在上述优化条件下,胸苷磷酸化酶活试验验证值达到1.172 U/mg,与优化前相比,酶活提高了2.93倍。
(4)采用蛋白质凝胶电泳进行验证,结果表明:本实验优化方案仅能提高单位湿菌体中胸苷磷酸化酶的含量。
总之,实验结果显示通过数学统计学方法优化短乳杆菌产胸苷磷酸化酶发酵培养基以及发酵条件是一种可行有效的方法。要进一步提高胸苷磷酸化酶活,还需在菌种选育(物理化学诱变、基因组重排技术等)、代谢调控以及扩大化培养条件等方面继续研究。
[1] 邱蔚然,丁庆豹. 酶法合成核苷类抗病毒药物[J]. 中国医药工业杂志,1999,30(10):474-478.
[2] 徐渊,应国清. 通过大肠杆菌的核苷磷酸化酶合成核苷的研究[J].科技创新导报,2008(08):23.
[3] 沈荣坤,邱蔚然,孙南翔. 应用大肠杆菌的核苷磷酸化酶合成胸苷[J]. 华东理工大学学报,1996,22(6):701-706.
[4] 李喻,窦洁,曹静,等. 乙酰短杆菌酶法合成2’-脱氧鸟苷[J]. 药物生物技术,2011,18(2):119-123.
[5] 洪云海,丁庆豹,欧伶,等. 应用乙酰短杆菌酶法合成2'-脱氧腺苷[J]. 工业微生物,2006,36(1):30-33.
[6] 张广臣,雷虹,何欣,等. 微生物发酵培养基优化中的现代数学统计学方法[J]. 食品与发酵工业,2010,36(5):110-113.
[7] 何美儒,金志华,胡生,等. 响应面法优化达托霉素发酵培养基[J]. 化工进展,2012,31(4):873-877
[8] Saunders P P,Wilson A B,Saunders G F,et al. Purifieation and comparative properties of a pyrimidine nueleostde phosphorylase fromBacillus stearothermophilus[J].The Journal of Biological Chemistry,1969,244(13):3691-3697.
[9] 魏晓琨,张春艳,丁庆豹,等. 产气肠杆菌菌体内核苷磷酸化酶酶活测定条件的分析[J]. 中国临床志,2007,175(12):4-7.
[10] Plackett R L,Burman J P. The design of optimum multifactorial experiments[J].Biometrika,1946,33(4):305-325.
[11] Williams K R. Screening designs[J].Industrial and Engineering Chemistry,1963,55(6):29-32.
[12] 谭黎,欧阳立阳,丁庆豹. 大肠杆菌核苷磷酸化酶的重组表达和活性[J]. 华东理工大学学报,2008,24(5):660-664.

