铁氰化铈薄膜固载血红蛋白修饰的过氧化氢生物传感器的制备及性能
郝 瑶,刘晓芹,蔡志芳,郭满栋
(山西师范大学 化学与材料科学学院,山西 临汾041004)
生物传感器具有分析速度快、选择性高及制备成本低等优点,成为世界科技发展的新热点[1-2].目前国内外对血红蛋白的研究主要集中于血红蛋白的聚合[3]、电化学中的应用[4-5]及对血红蛋白结构[6]、输氧功能[7]和在电子转移机理方面[8]的探讨.在电化学方面,血红蛋白常被用作修饰物来制备生物传感器,并以制作简单、廉价易得等优点得到了大力发展[9-11].
铁氰化铈(CeHCF)膜修饰电极具有良好的电化学活性、高度稳定性及制备简便等优点[12].实验中铁氰化铈膜为血红蛋白提供了一个新的固载体,从而实现了血红蛋白在电极表面的直接电子转移,并对过氧化氢产生催化氧化作用.目前,国内外已有文献报道有关该电极的制备及应用[13-14],但是尚未见到铁氰化铈膜固载血红蛋白用作生物传感器的报道.实验采用电化学沉积法制备CeHCF/GCE,然后将血红蛋白固载于CeHCF修饰电极上,制备出一种新型过氧化氢生物传感器.研究表明,该传感器对H2O2有较好的电化学响应,且灵敏度较高,具有创新性和实用性.
1 实验部分
1.1 仪器与试剂
LK2005A型电化学工作站(天津市兰力科化学电子高技术有限公司),KQ-250B超声波清洗仪(昆山市超声仪器有限公司),JSM-7500F扫描电子显微镜(日本电子),BS124S电子天平(北京赛多利斯仪器系统有限公司),W-103微量进样器5.0μL(上海医用微量仪器厂),PXSJ-216型离子计(雷磁,上海精密科学仪器有限公司).实验采用三电极系统:铂丝电极为辅助电极,Ag/AgCl(KCl,饱和)为参比电极,血红蛋白/铁氰化铈修饰玻碳电极和裸玻碳电极(d=2mm)为工作电极.
牛血红蛋白(国药集团化学试剂有限公司),配置浓度为5.0g/L,置于冰箱(4℃)储存.Ce(NO3)3·6H2O(北京刘李店福利化工厂),使用时配置浓度为1.5×10-2mol/L,4℃避光保存.KCl(天津市风船化学试剂科技有限公司),K3[Fe(CN)6](天津市光复科技发展有限公司),使用时分别配置浓度为1.5×10-2mol/L.过氧化氢(30%,洛阳市化学试剂厂),实验所用试剂均为分析纯,实验用水均为二次蒸馏水,所有实验均在室温下进行.
1.2 修饰电极的制备过程
1.2.1 基体玻碳电极的预处理
将玻碳电极用Al2O3粉打磨,依次用二次蒸馏水、HNO3(体积比是1∶1)、丙酮、二次蒸馏水分别超声清洗,晾干.在0.5mol/L的H2SO4溶液中对玻碳电极进行电化学活化,活化后取出电极用二次水冲洗,室温晾干.
1.2.2 储备液的制备
血红蛋白(Hemoglobin from bovine blood,Hb)储备液:称取50mg牛血红蛋白,用二次水溶解,并定容至10mL容量瓶中,4℃下避光保存.
Ce(NO3)3(1.5×10-2mol/L)储备液:称取0.325 7g Ce(NO3)3·6H2O,用二次水溶解,并定容至50 mL容量瓶中,4℃下避光保存.
K3[Fe(CN)6](1.5×10-2mol/L)储备液:称取0.246 9g K3[Fe(CN)6],溶解并稀释定容至50mL容量瓶中,4℃下避光保存.
KCl(1.5mol/L)储备液:称取5.591 3g KCl,溶解并稀释定容至50mL容量瓶中,4℃下避光保存.
1.2.3 CeHCF/GCE电极的制备
将经预处理活化后的基体玻碳电极浸入到盛有电解液2mL 1.5×10-2mol/L Ce(NO3)3、2mL 1.5×10-2mol/L K3[Fe(CN)6]和2mL 1.5mol/L KCl的电解池中,通入氮气,在-0.1V~1.0V电位范围内,以100mV/s的扫描速率进行循环伏安扫描40圈.从图1的扫描中,观察到当电极电位从-0.1V向+1.0 V扫描时,于605mV处出现一个氧化峰,对应溶液中的Fe(CN被氧化生成Fe(CN;电极电位向负方向扫描时,于305mV处出现还原峰,对应溶液中的Fe(CN被还原生成Fe(CN.随着扫描次数的增加,氧化还原峰的峰电流逐渐减小,说明在玻碳电极表面已经形成了CeHCF膜.CeHCF膜电化学形成机理如下:由于Fe(CN得到电子形成Fe(CN-,同时溶液中Ce3+迅速与Fe(CN结合形成CeHCF,并沉积到玻碳电极表面,形成了CeHCF膜修饰电极.扫描完成后,将电极取出,可以观察到在电极表面形成了一层不透明的膜.将其用二次蒸馏水冲洗,室温晾干备用.实验前,在加入电解液的电解池中,先通氮气10 min.且整个实验过程一直保持氮气氛围.其电极表面的成膜机理可能为:
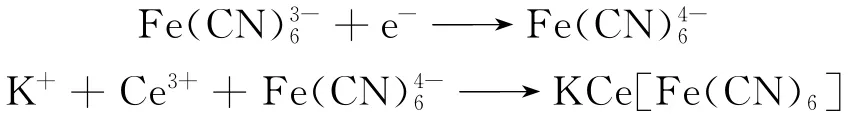
1.2.4 Hb/CeHCF/GCE电极的制备
用微量进样器量取2μL 5.0g/L Hb溶液,将其均匀滴涂于已修饰好的CeHCF/GCE电极表面,室温下晾干,12h后使用.电极不用时储存于4℃冰箱中.
1.3 实验方法
实验采用三电极系统,以裸玻碳电极、CeHCF/GCE及 Hb/CeHCF/GCE为工作电极,Ag/AgCl(饱和 KCl)为参比电极,铂丝电极为辅助电极.以pH=6.4的Na2HPO4-NaH2PO4溶液为缓冲溶液,在-0.8~1.0V的电位范围内以100mV/s的扫速对H2O2进行循环伏安、线性伏安及交流阻抗测定.
图1 CeHCF膜的电沉积循环伏安曲线Fig.1 CeHCF film electrochemical polymerization of cyclic voltammetry curves
2 结果与讨论
2.1 修饰电极的表征
图2a是铁氰化铈膜修饰电极的扫描电镜图.从图可知,铁氰化铈呈晶状成功的沉积在了玻碳电极表面.从Hb/CeHCF/GCE修饰电极的扫描电镜图(图2b)可知,铁氰化铈很好的将血红蛋白固载在了电极表面,图中颗粒细致均匀、排布紧密,并且存在明显的空穴现象,说明铁氰化铈是一种很好的血红蛋白吸附固定化材料.

图2 CeHCF/GCE(a)和 Hb/CeHCF/GCE(b)的SEM 图Fig.2 SEM image of CeHCF/GCE(a)and Hb/CeHCF/GCE(b)
实验运用交流阻抗法对电极表面的修饰过程进一步表征.图3所示曲线a为裸玻碳电极在被测溶液中的阻抗图,近似一条直线,电极表面没有阻碍电子传递的物质.曲线b为铁氰化铈膜修饰玻碳电极,其表面电阻明显大于裸玻碳电极.当CeHCF/GCE表面吸附血红蛋白后,其表面电阻又迅速减小(曲线c),说明血红蛋白成功的固载到了电极表面.
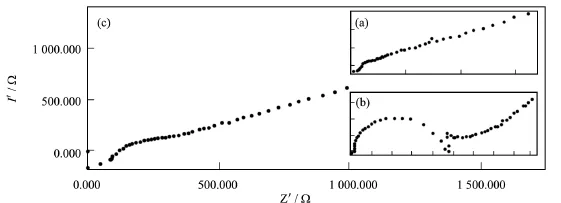
图3 裸玻碳电极(a),CeHCF/GCE(b),Hb/CeHCF/GCE(c)的电化学阻抗图Fig.3 Electrochemical impedance diagram of glassy carbon electrode(a),CeHCF/GCE(b),Hb/CeHCF/GCE(c)
2.2 Hb/CeHCF/GCE电极的电化学响应
图4为裸玻碳电极(a)、CeHCF/GCE电极(b)、Hb/CeHCF/GCE电极(c)在含有1.0×10-6mol/L H2O2的pH=6.4的Na2HPO4-NaH2PO4缓冲溶液中的循环伏安图.从曲线a可知,H2O2在裸玻碳电极上未出现氧化还原峰,说明裸玻碳电极对其没有电化学响应.从曲线b、c观察到,CeHCF/GCE电极在0.187 V处出现了一电化学响应较低的还原峰Ipc=24.226μA,氧化峰电流很小到几乎看不出;而Hb/CeHCF/GCE电极在0.049V处出现了一较高的还原峰Ipc=48.245μA,在0.447V处出现了一较明显的氧化峰Ipa=-29.682μA.由图可知,H2O2生物传感器在Hb/CeHCF/GCE电极上的还原峰电流要比在CeHCF/GCE电极上的还原峰电流增加1.99倍.说明铁氰化铈固载血红蛋白能够很好地增强H2O2生物传感器的电化学响应.
由图5可知,Hb/CeHCF/GCE电极在空白缓冲溶液中未出现氧化还原峰,而在含有1.0×10-6mol/L H2O2的缓冲溶液中出现了灵敏度较高的氧化还原峰.这说明过氧化氢生物传感器在Hb/CeHCF/GCE电极上发生了氧化还原反应,Hb/CeHCF/GCE电极对过氧化氢产生了催化作用.其氧化峰电位Epa=0.444 V,还原峰电位Epc=0.037V,峰间距为ΔE=Epa-Epc=0.407V,Ipc/Ipa=1.625≠1,由此可知,H2O2生物传感器在Hb/CeHCF/GCE电极上的反应过程是不可逆过程.
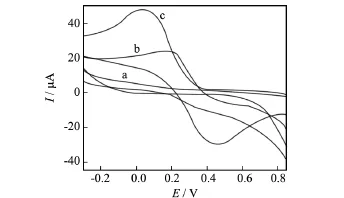
图4 电极在缓冲溶液中的循环伏安图Fig.4 Cyclic voltammograms of the electrodes in buffer solution
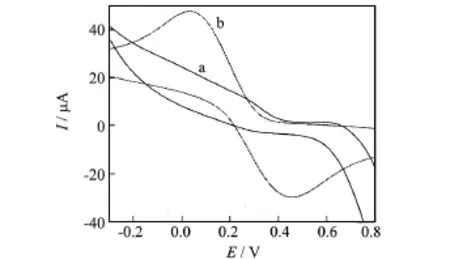
图5 Hb/CeHCF/GCE电极在缓冲溶液中的循环伏安图Fig.5 Cyclic voltammograms of Hb/CeHCF/GCE in buffer solution
2.3 Hb/CeHCF/GCE电极测试最佳条件的选择
2.3.1 缓冲溶液的选择
实验研究了 H2O2分别在 KCl-HCl(pH=1.6)、NaAc-HAc(pH=5.0)、KH2PO4-硼砂(pH=6.4)、Na2HPO4-NaH2PO4(pH=6.4)、硼砂-HCl(pH=8.8)、硼砂-NaOH(pH=10.0)缓冲溶液中的电化学行为.研究表明,H2O2在Na2HPO4-NaH2PO4缓冲溶液中的峰电流最高,所以选择Na2HPO4-NaH2PO4缓冲液作为实验的底液.
2.3.2 pH 的选择
研究了H2O2生物传感器在Hb/CeHCF/GCE电极上不同酸度对响应电流的影响.如图6所示,当5.8≤pH≤6.4时,响应电流随着pH值的增大而呈线性上升趋势;当pH在6.4~7.4范围之内时,溶液的酸度对响应电流影响不大,峰电流较稳定,表明在此范围内Hb能够保持较好、较稳定的电化学活性;当pH≥7.4时,峰电流随着pH值的增大而上升.为了保持血红蛋白较好的活性,且考虑到人体血液中血红蛋白的生理条件(pH=6.0~8.5),因此,选择pH=6.4的Na2HPO4-NaH2PO4缓冲液作为本实验最适pH.
2.3.3 pH对峰电位的影响
采用循环伏安法研究了不同pH的Na2HPO4-NaH2PO4缓冲溶液对峰电位的影响.在pH=5.8~7.8的缓冲溶液中,随着pH的增加,还原峰电位逐渐向负方向移动,表明有质子参与反应过程.还原峰电位E0′与pH呈良好的线性关系,其线性回归方程为:
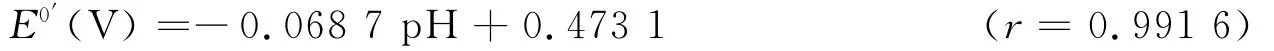
E0′-pH直线的斜率为-68.7mV/pH,接近该条件下(25℃)理论能斯特斜率-59.0mV/pH,故Hb/CeHCF/GCE电极反应过程是等电子伴随等质子参加的不可逆过程.
2.3.4 扫描速率的影响
图7是H2O2在生物传感器Hb/CeHCF/GCE电极上的不同扫描速率下的循环伏安图.如图所示,随着扫描速率v的增加,还原峰电流和氧化峰电流均不断增大,还原峰P1逐渐负移,氧化峰P2逐渐正移.扫速在40~160mV/s范围内,氧化还原峰电流均与扫速v成正比,说明H2O2生物传感器在Hb/CeHCF/GCE上的电极反应过程主要受表面吸附控制.其线性方程分别为:

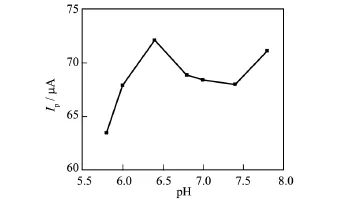
图6 Hb/CeHCF/GCE电极上峰电流与pH的关系图Fig.6 The plot of redox peak currents vs pH on Hb/CeHCF/GCE
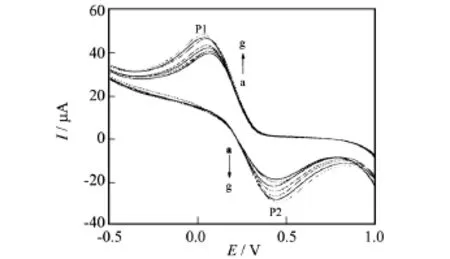
图7 Hb/CeHCF/GCE电极在不同扫速下的循环伏安图Fig.7 Cyclic voltammograms of Hb/CeHCF/GCE
2.3.5 电极反应中电子数的测定
扫描速率在40~160mV/s的范围内,氧化峰电位与扫速对数值呈良好的线性关系,E-lgv的线性方程为:

E-lgv直线斜率为0.030 6,截距为0.561 2.从E-lgv直线斜率[0.5×2.303RT×(anF)-1]可得,an=0.987,取a=0.5,即可计算出n≈2;由此可知,H2O2在生物传感器 Hb/CeHCF/GCE电极上发生了两电子交换的氧化反应.
还原峰在扫描速率40~160mV/s的范围内,E-lgv的线性方程为:

同上根据E-lgv直线斜率[0.5×2.303RT×(anF)-1]可得,an=1.052,取a=0.5,即可计算出n≈2;由此可知,H2O2在生物传感器Hb/CeHCF/GCE电极上发生了两电子交换的还原反应.
2.3.6 电极反应机理的探讨
CeHCF薄膜为血红蛋白提供了一个具有亲和性的温和的吸附固载环境,并高度保持了血红蛋白的生物活性,使血红蛋白能够渗透进入到CeHCF薄膜中,而且Hb/CeHCF/GC修饰电极表观形貌的空穴现象清晰可见,更加有利于离子的进出,并使电活性中心更加靠近电极表面,从而很好的实现了血红蛋白在电极上的直接电子转移.血红蛋白对过氧化氢有催化氧化的作用,电极在进行阳极化扫描时,溶液中过氧化氢因失电子而产生氧气,同时伴随着质子的产生;进行阴极化扫描时,氧气因得到电子而转化为氢氧根离子,其反应机理如下:
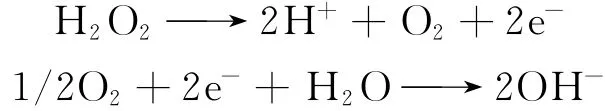
2.4 Hb/CeHCF/GCE电极的响应性能
2.4.1 线性范围
实验配置了一系列不同浓度的H2O2标准溶液,采用循环伏安扫描法对其进行测定.如图8所示,随着H2O2浓度不断增大,氧化峰电流逐渐增大.H2O2的氧化峰电流与 H2O2浓度在1.5×10-3mol/L~4.5×10-6mol/L范围内呈线性关系,其线性方程为:
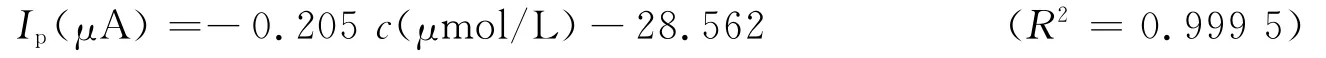
检出限为2.5×10-7mol/L(S/N=3),说明此方法对 H2O2的检测灵敏度较高.
2.4.2 共存离子干扰实验
实验对共存时可能会产生干扰的离子进行了测定.在上述最优的实验条件下,当 H2O2浓度为5.0×10-5mol/L时,分别加入以下物质:10倍的抗坏血酸、亮氨酸、赖氨酸、尿酸,20倍的葡萄糖、乙酸、甲酸、L-半胱氨酸、天冬氨酸,测定它们对H2O2生物传感器响应信号的干扰.结果表明,上述离子对H2O2的测定无明显干扰.
2.4.3 Hb/CeHCF/GCE修饰电极的稳定性和重现性
将所制得的Hb/CeHCF/GCE修饰电极储存在4℃下,放置两个星期后,再对H2O2进行测定,发现峰电流和峰电位基本保持不变.放置一个月后,再次测定,电极响应性能能够保持在初始电极响应性能的85%左右,说明Hb/CeHCF/GCE具有较好的稳定性和电化学活性.
在最佳的实验条件下,制备4根Hb/CeHCF/GCE电极,对1.5×10-6mol/L H2O2溶液进行测定,结果发现,峰电流的相对标准偏差(RSD)为4.73%,说明Hb/CeHCF/GCE电极有较好的重现性.
2.4.4 米式常数(Km)的计算
米式常数是表征酶促反应的一个重要的动力学参数,是衡量酶对底物亲和力大小的一个标准.以H2O2浓度的倒数和稳态电流的倒数作图,得一直线可知其截距和斜率,即可求得米式常数.根据Lineweaver-Burk方程:
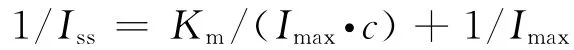
式中Iss为稳态电流(μA),Imax为测定底物时的最大电流(μA);c为相应底物的浓度(mol/L).作Lineweaver-Burk图,得线性方程为:1/Iss=0.003 9/c+0.083 0,r=0.993 7;斜率为0.003 9,截距为0.083 0,从而求得最大电流Imax为12.048μA,Km为0.047mmol·L-1.Km越小,酶与底物之间亲和力越大,此值表明血红蛋白对H2O2有较高的生物活性.
2.4.5 回收率的测定
选取pH=6.4的Na2HPO4-NaH2PO4缓冲液为测试底液,分别向底液中加入4种不同浓度的H2O2溶液,并将H2O2传感器置于含有H2O2的样品溶液中,测定其响应电流的变化值.结果表明,H2O2传感器有较好的回收率(99.7%~105.9%),如下表所示.
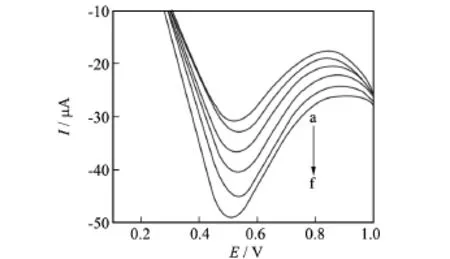
图8 不同浓度的H2O2的线性扫描伏安图Fig.8 Linear sweep voltammograms of Hb/CeHCF/GCE
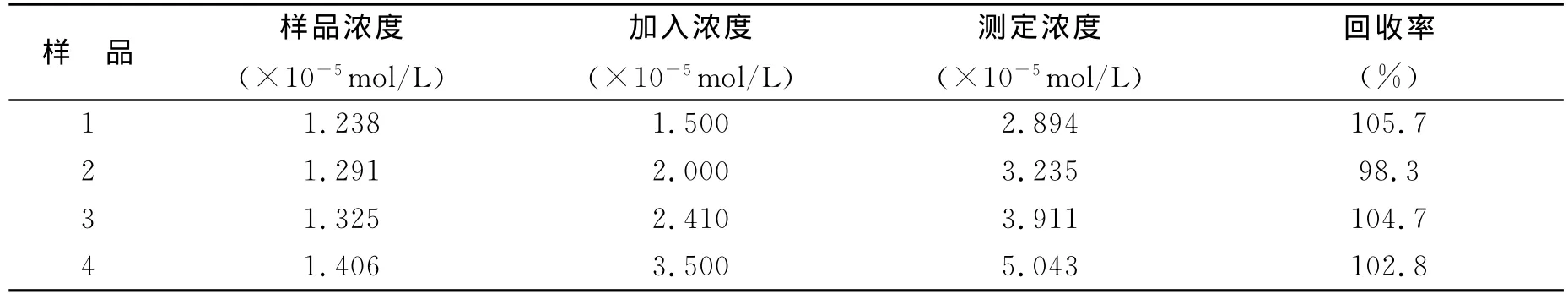
表1 H2O2传感器回收率的测定Table 1 The determination of H2O2sensor recovery
3 结论
实验采用电沉积法制备了一种新型的过氧化氢生物传感器,并对电极反应机理进行了探讨,结果表明铁氰化铈膜不仅能保持血红蛋白的生物活性,且铁氰化物具有良好的离子交换性能,通过其空穴效应实现了血红蛋白与电极之间的直接电子转移.实验对Hb/CeHCF/GCE修饰电极制备过程中的条件进行了优化,表明该修饰电极具有制备方法简便,电流响应快,线性范围宽,检测下限低等优点,对生物医学和临床检验具有重要意义.
[1]PARK B W,YOON D Y,KIM D S.Recent progress in bio-sensing techniques with encapsulated enzymes[J].Biosens Bioelectr,2010,26(1):1-10.
[2]JOHN H T L,KEITH B M,JEREMY D G.Biosensor technology:technology push versus market pull[J].Biotechn Adv,2008,26(5):492-500.
[3]SERENA F,STEFANO B,LUCA R.Modulation of expression and polymerization of hemoglobin polytaur,apotential blood substitute[J].Arch Biochem Biophys,2011,505(1):42-47.
[4]WANG Quan Lin,LU Gong Xuan,YANG Bao Jun.Direct electrochemistry and electrocatalysis of hemoglobin immobilized on carbon paste electrode by silica sol-gel film[J].Biosens Bioelectr,2004,19(10):1269-1275.
[5]SUN Wei,ZHAI Zi Qin,WANG Dan Dan.Electrochemistry of hemoglobin entrapped in a nafion/nano-zno film on carbon ionic liquid electrode[J].Bioelectrochemistry,2009,74(2):295-300.
[6]GHOSIA L,SYED A A,ATIYA A.Molecular mechanism of high altitude respiration:primary structure of a minor hemoglobin component from tufted duck(aythya fuligula,anseriformes)[J].Biochem Biophys Res Commun,2004,326(1):123-130.
[7]HARRY A S.pH effects on the binding of oxygen to non-vertebrate monomeric hemoglobins,a linked function model[J].J Theoret Biology,2004,229(1):113-118.
[8]DAI Zhi Hui,LIU Song Qin,JU Huang Xian.Direct electron transfer and enzymatic activity of hemoglobin in a hexagonal mesoporous silica matrix[J].Biosens Bioelectr,2004,19(8):861-867.
[9]史传国,衡姝婧,徐静娟,等.基于血红蛋白/硒化镉量子点多层膜的H2O2生物传感器[J].无机化学,2009,25(9):1526-1531.
[10]SHEETAL C,CHANDRA S P.An amperometric hemoglobin biosensor based on immobilization of fructosyl amino acid oxidase onto zinc oxide nanoparticles-polypyrrole film[J].Anal Biochem,2012,430(2):156-162.
[11]XU Yan Xia,HU Cheng Guo,HU Sheng Shui.A reagentless nitric oxide biosensor based on the direct electrochemistry of hemoglobin adsorbed on the gold colloids modified carbon paste electrode[J].Sens Actuat B:Chem,2010,148(1):253-258.
[12]卢先春,黄克靖,吴志伟,等.氧化石墨烯/铁氰化铈修饰玻碳电极同时测定扑热息痛和咖啡因[J].分析化学,2012,40(3):452-456.
[13]YANG Hai Jing,LU Bao Ping,GUO Li Ping.Cerium hexacyanoferrate/ordered mesoporous carbon electrode and its application in electrochemical determination of hydrous hydrazine[J].J Electroanal Chem,2011,650(2):171-175.
[14]FANG Bin,WEI Yan,LI Mao Guo.Study on electrochemical behavior of tryptophan at a glassy carbon electrode modified with multi-walled carbon nanotubes embedded cerium exacyanoferrate[J].Talanta,2007,72(4):1302-1306.

