Na3PO4·12H2O选择性催化脱去芳香性叔丁基二甲基硅醚
孔 军,陈寅生,严 琳*
(1.河南大学学生处,河南 开封475001; 2.河南大学 药学院,河南 开封475004)
羟基广泛存在于许多在生理上和合成上有意义的化合物中,如核苷、碳水化合物、甾族化合物、大环内酯类化合物、聚醚以及某些氨基酸的侧链.另外,羟基也是有机合成中一个很重要的功能基,其可转变为卤素、氨基、羰基、羧基等多种官能团.在化合物的氧化、酰基化、卤化、脱水反应或许多官能团的转化过程中,我们常常需要将羟基保护起来.在含有多官能团复杂分子的合成中,如何选择性地对羟基进行保护和脱保护往往是许多新化合物开发时的关键所在.
羟基保护主要是将其转变为相应的醚或酯,以醚更为常见.其中叔丁基二甲基硅醚(TBDMS)是使用频率较高的保护醚,其特点是在温和的条件下易与保护基团反应,而且在碱性和弱酸性条件下相对稳定[1-2].另外,好的保护基还应该在温和条件下较易除去.尽管四丁基氟化铵(TBAF)是常用的脱去TBDMS的试剂,但是由于其较强的碱性以及亲核性氟离子的存在,导致其脱TBDMS的反应选择性不高且副产物较多[3-4].因此需要寻找一些更温和、方便的方法以脱去TBDMS保护醚.由于电子效应影响,烷基TBDMS醚易去保护,目前已经开发出很多成功脱去烷基TBDMS醚的方法[1-2],而成功脱去芳基TBDMS醚的方法却很少.已经报道的在酸性条件下脱去芳基TBDMS醚的方法仅有两例.1997年ANGLE和WADA报道了使用樟脑磺酸成功脱去了仲醇的TBDMS醚[5];2006年BHATT和NAYAK报道了使用铜(Ⅱ)的溴化物催化脱TBDMS醚的反应[6],但是选择性不高.在碱性条件下脱去芳基TBDMS醚的方法相对较多,氟化物(TBAF,KF)[2,7-9],强 碱 (KOH,NaOH,LiOH)[10-12],碳 酸 盐 (K2CO3、Cs2CO3)[13-15],醋 酸 盐 (LiOAc)[16]和一些有机碱(四甲基胍[17],三乙胺,N-氧化物[18])都可用来催化此反应.本文作者报道了在温和的室温条件下,采用廉价易得的磷酸盐(Na3PO4·12H2O)选择性脱去芳基TBDMS醚的方法,这是第一次使用磷酸盐脱去芳基TBDMS醚的报道(图1).同时将我们建立的方法应用于TBDMS醚保护的足叶草毒素类似物(1)的脱保护,以67%的收率成功地得到相应的酚(2)(图2).
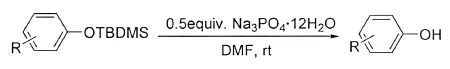
图1 Na3PO4·12H2O催化的脱芳基TBDMS醚反应Fig.1 Deprotection of aryl TBDMS ethers to phenols using Na3PO4·12H2O
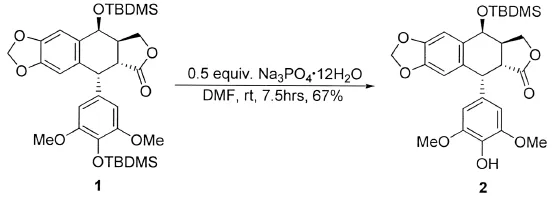
图2 Na3PO4·12H2O催化的选择性脱TBDMS醚反应Fig.2 Selective deprotected of TBDMS-protected 4′-desmethylepipodophyllotoxin in the presence of 0.5 equivalent of Na3PO4·12H2O in DMF at room temperature
1 实验部分
1.1 仪器与试剂
核磁共振波谱由Bruker DPX-500型超导核磁共振仪测定;IR谱使用Nicolet IR 200红外光谱仪测定,KBr压片;质谱数据由Bruker Esquire 3000(ESI)型质谱仪测定;薄层层析采用GF254高效硅胶板,柱层析色谱使用200~300目柱层析硅胶,其他试剂均为市售分析纯.
1.2 实验方法
脱芳基TBDMS醚反应的方法:以化合物1为底物的反应为例.将化合物1(0.5mmol)(实验室自制)溶于DMF(2.0mL)溶液中,加入适量 Na3PO4·12H2O (0.25mmol),室温下搅拌,TLC监测原料消失时停止反应.用饱和食盐水洗涤,乙酸乙酯萃取,合并有机相并用无水硫酸钠干燥,旋转蒸发除去溶剂后,快速柱层析(V正己烷∶V乙酸乙酯=5∶1)得化合物2,收率67%.
1.3 化合物光谱数据
所有化合物都通过结构表征进行了确证,本文只显示特征化合物1和2的光谱数据.
化合物1.白色固体;mp 161.8~163.5℃;1H NMR(500MHz,CDCl3)δ:0.04(s,6H),0.09(s,6H),0.87(s,9H),0.94(s,9H),2.84(m,1H),3.38(dd,1H,J=5.3,27.5Hz),3.66(s,6H),4.24(d,2H,J=4.9Hz),4.57(t,1H,J=5.3Hz),4.86(d,2H,J=2.9Hz),5.96(d,2H,J=1.5Hz),6.20(s,2H),6.51(s,1H),6.75(s,1H).13C NMR (125MHz,CDCl3)δ:-4.3(two peaks),-3.8,-3.1,0.2,1.3,18.5,18.9,26.1,26.2,39.5,40.8,44.1,56.3,68.0,68.1,101.6,108.9,109.6,110.9,132.1,132.6,132.7,134.1,147.0,148.2,151.2,175.5.LRMS(ESI):651.2(M+Na+).IR(KBr):2 955,2 929,2 895,2 857,1 778,1 586,1 512,1 484,1 335,1 253,1 129,837,780cm-1.
化合物2.白色固体;mp 213.9~215.1℃;1H NMR(500MHz,CDCl3)δ:0.13(s,6H),0.87(s,9H),2.85(m,1H),3.40(dd,1H,J=5.3,27.5Hz),3.76(s,6H),4.25(t,1H,J=4.6Hz),4.59(d,1H,J=5.3Hz),4.87(d,2H,J=2.9Hz),5.97(d,2H,J=3.2Hz),6.26(s,2H),6.51(s,1H),6.76(s,1H).13C NMR (125MHz,CDCl3)δ:-3.9,-3.1,0.2,18.5,26.2,39.5,40.6,44.1,56.8,68.0,68.1,101.6,108.4,109.7,110.8,131.3,132.1,132.4,146.6,147.0,148.3,175.6.LRMS(EI,m/z):514(M+,15.68%).IR (KBr):3 534,2 928,2 856,1 782,1 582,1 510,1 484,1 328,1 249,1 126,838,783cm-1.
2 结果和讨论
首先我们以4-甲基苯TBDMS醚为模版,进行反应条件的优化.先以0.5equiv.的Na3PO4·12H2O为脱TBDMS醚试剂在室温条件下进行研究(表1,Entries 1-4),但是反应没有进行.当溶剂变为质子性溶剂乙醇时,经核磁和质谱验证我们得到了相应的脱TBDMS醚产物4-甲基苯酚(表1,Entry 5),收率为41%.当溶剂换成水时,反应仍能进行,但是收率有所下降(表1,Entry 6).在相同条件下得到的最优溶剂是高极性质子惰性的溶剂DMF,反应1.8h,收率97%(表1,Entry 7).Na3PO4·12H2O的用量降至0.1equiv.时,依然具有很好的催化效率(表1,Entry 8).使用混合溶剂,并改变DMF和H2O的比例,均对反应没有很好的促进作用(表1,Entry 9,10).综合考虑效率和溶剂体系对反应的影响后,该脱TBDMS醚反应最优化条件定为:0.5equiv.Na3PO4·12H2O为催化剂,溶剂为DMF(表1).
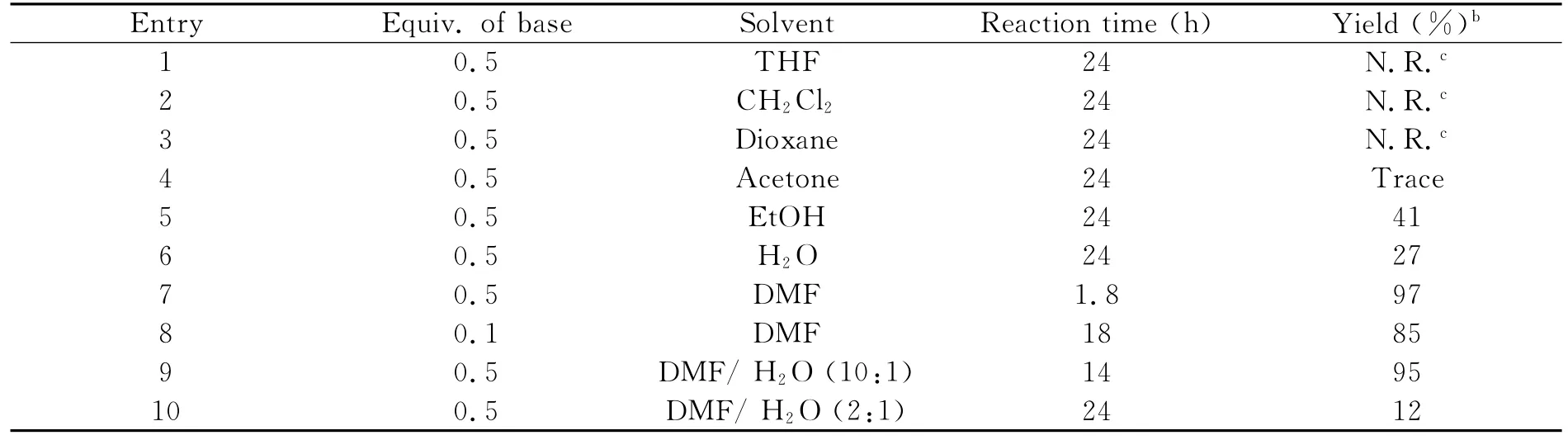
表1 Na3PO4·12H2O催化4-甲基苯TBDMS醚脱TBDMS醚反应的反应条件筛选aTable 1 Solvent effect investigations on deprotection of p-methylbenzyl TBDMS ether using Na3PO4·12H2Oa
随后,我们在优化的反应条件下对底物的适用范围进行了考察 (表2).如表2所示,所有的芳基TBDMS醚都能以较高的产率转化成相应的酚.芳环上具有吸电子取代基底物(表2,Entries 1-3)的反应速率明显高于芳环上具有给电子取代基的底物(表2,Entries 7-8).但是该催化体系对烷基TBDMS醚无效(表2,Entries 10-13).
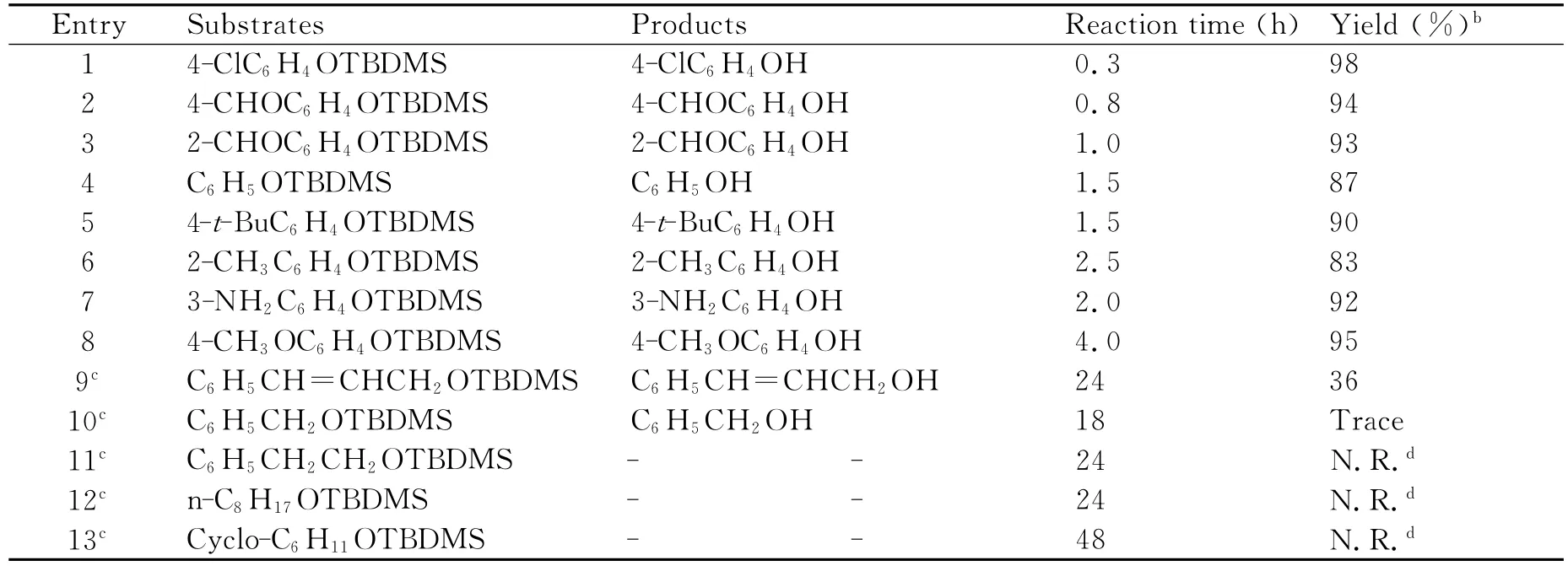
表2 Na3PO4·12H2O催化的脱TBDMS醚反应aTable 2 Deprotection of aryl and alkyl TBDMS ethers to phenols and alcohols using Na3PO4·12H2Oa
进一步,我们考察了此方法的化学选择性问题.如表3所示,所有的含有其他功能基的芳基TBDMS醚都能以较高的产率转化成相应的酚.多种官能团如脂肪族TBDMS醚(表3,Entries 1-5)、TBDPS醚(表3,Entries 6)、羧酸酯(表3,Entries 7-11)、碳酸酯(表3,Entries 12-13)、THP醚(表3,Entries 14)及磺酸酯(表3,Entries 15)等在此反应条件下均能保持完整.
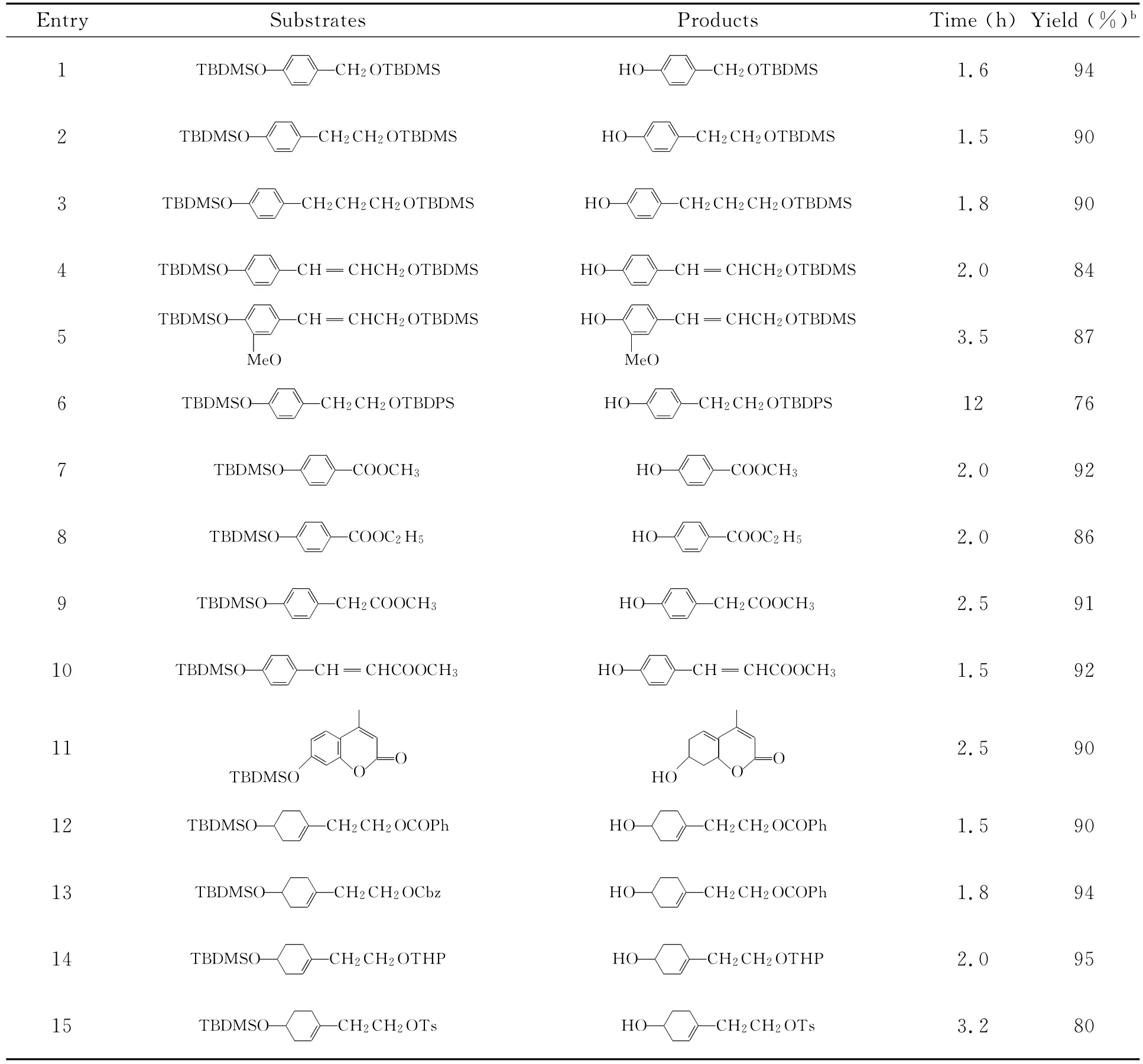
表3 Na3PO4·12H2O催化的含有其他功能基底物的脱TBDMS醚反应aTable 3 Chemoselective deprotection of various ary TBDMS-protected ethers using Na3PO4·12H2Oa
近年来,由于光学纯的足叶草毒素及其类似物与抗肿瘤药物依托泊苷(VP-16)、替尼泊苷(VM-26)的结构非常相似,而引起化学家的广泛关注.但是,其结构中的内酯环在碱性环境下容易消旋.用我们建立的方法,将TBDMS醚保护的足叶草毒素类似物(1)溶于DMF中,加入0.5equiv.的Na3PO4·12H2O室温下搅拌,以67%的收率成功地得到了相应的酚(2)(图2).
3 结论
综上所述,我们发展了由磷酸盐(Na3PO4·12H2O)为催化剂,在温和的室温条件下成功用于选择性脱去芳基TBDMS醚的方法,具有多种官能团耐受性,且催化剂廉价易得,具有较好的工业应用前景.
[1]CROUCH R D.Selective monodeprotection of bis-silyl ethers[J].Tetrahedron,2004,60(28):5833-5871.
[2]COREY E J,VENKATESWARLU A.Protection of hydroxyl groups astert-butyldimethylsilyl derivatives[J].J Am Chem Soc,1972,94(17):6190-6191.
[3]COREY E J,SNIDER B B.A total synthesis of(±)-fumagillin[J].J Am Chem Soc,1972,94(4):2549-2550.
[4]HAYAMI J I,ONO N,KAJI A.Quaternary ammonium fluoride:a reagent for proton abstraction[J].Tetrahedron Lett,1968,9(11):1385-1386.
[5]ANHLE S R,WADA T.An approach to the narciclasine alkaloids via a quinone methide initiated cyclization reaction[J].Tetrahedron Lett,1997,38(46):7955-7958.
[6]BHATT S,NAYAK S K.A facile and catalytic method for selective deprotection oftert-butyldimethylsilyl ethers with copper(Ⅱ)bromide[J].Tetrahedron Lett,2006,47(47):8395-8399.
[7]BLASS B E,HARRIS C L,PORTLOCK D E.A facile,selective KF/Al2O3mediated method for the deprotection of aryl silyl ethers and preparation of aryl SEM ethers[J].Tetrahedron Lett,2001,42(9):1611-1613.
[8]SCHMITTLING E A,SAWYER J S.Selective desilylation oftert-butyldimethylsilyl ethers of phenols using potassium fluoride-alumina and ultrasound[J].Tetrahedron Lett,1991,32(49):7207-7210.
[9]COLLINGTON E W,FINCH H,SMITH I J.Selective deprotection of alcoholic and phenoilc silyl ethers[J].Tetrahedron Lett,1985,26(25):681-684.
[10]ANKALA S V,FENTEANY G.Selective deprotection of either alkyl or aryl silyl ethers from aryl,alkyl bis-silyl ethers[J].Tetrahedron Lett,2002,43(27):4729-4732.
[11]CROUCH R D,STIEFF M,FRIE J L,et al.Selective deprotection of silyl-protected phenols using solid NaOH and a phase transfer catalyst[J].Tetrahedron Lett,1999,40(16):3133-3136.
[12]JIANG Zhi Yong,WANG Yan Guang.A mild,efficient and selective cleavage of aryltert-butyldimethylsilyl ethers using KOH in ethanol[J].Chem Lett,2003,32(7):568-569.
[13]WILSON N S,KEAY B A.Mild base mediated desilylation of various phenolic silyl ethers[J].Tetrahedron Lett,1997,38(2):187-190.
[14]JIANG Zhi Yong,WANG Yan Guang.A mild,efficient and selective deprotection oft-butyldimethylsilyl-protected phenols using cesium carbonate[J].Tetrahedron Lett,2003,44:3859-3861.
[15]PRAKASH C,SALEH S,BLAIR I A.Selective removal of phenolic and alcoholic silyl ethers[J].Tetrahedron Lett,1994,35(41):7565-7568.
[16]WANG Bing,SUN Hui Xia,SUN Zhi Hua.LiOAc-Catalyzed chemoselective deprotection of aryl silyl ethers under mild conditons[J].J Org Chem,2009,74(4):1781-1784.
[17]OYAMA K I,KONDO T.A novel and convenient chemoselective deprotection method for both silyl and acetyl groups on acidic hydroxyl groups such as phenol and carboxylic acid by using a nitrogen organic base,1,1,3,3-tetramethylguanidine[J].Org Lett,2003,5(2):209-212.
[18]ZUBAIDHA P K,BHOSALE S V,HASMI A M.A facile and selective deprotection oftert-butyldimethylsilyl ethers of phenols using triethylamine N-oxide[J].Tetrahedron Lett,2002,43(40):7277-7279.

