乙醇脱氢酶底物分子对接的优化
黄可君,张光亚
(华侨大学 化工学院,福建 厦门361021)
乙醇脱氢酶(EC 1.1.1.1,ADHs)分布广泛,目前从多种生物中均可分离得到[1].来源于微生物的乙醇脱氢酶吸引了更多研究者关注,这是由于它能用于合成或修饰一些高价值的醇类物质,尤其是一些手性醇类物质[2-3].乙醇脱氢酶能参与体内的乙醇代谢,但是当摄入过多乙醇的时候,将大量消耗NAD(烟酰胺腺嘌呤二核苷酸)生产NADH,导致肝脏甘油三磷酸酯的积累并抑制柠檬酸循环,最终导致代谢紊乱[4].近年来,关于乙醇脱氢酶的研究越来越深入,ADH正在更加广泛的应用于工业、医疗以及科研中[5].ADH主要以同型或异形二聚体的形式存在,有研究表明部分乙醇脱氢酶甚至有由二聚体聚合成为的更加复杂的四聚体结构[4].在人体中,乙醇脱氢酶可将底物氧化为醛,是一个氧化过程,而植物和细菌中的这一过程则恰好相反,其ADH催化的则是一个还原反应[4].分子对接对研究高级结构尚不明晰蛋白质的反应机理具有明显优势.有文献报导,通过同源建模所得三维结构,在木聚糖与底物可能结合的活性口袋部分以计算机模拟对接,可预测酶促反应过程的关键氨基酸残基[6].如盖伟等[7]利用Autodock程序筛选复方丹参方中HMG-CoA还原酶的抑制性成分;章媛等[8]利用分子对接与同源建模的方法对设计的化学药物进行打分,这也是一种典型的利用分子模拟对接完成的药物开发环节.分子对接的结果对酶的定向改造及抑制剂开放均具有重要意义.基于此,本文通过分子对接的方法探寻其催化底物脱氢时酶与底物分子的特定位点间存在作用力及其与底物亲和力之间的相关性.
1 材料与方法
1.1 数据获取
使用的ADH源自Sulfolobussolfataricus,是一种极端嗜热古菌[9],属双亚基蛋白,每个单体具有一个酶蛋白、一个辅酶分子(NAD),以及两个锌离子.其中:两个锌离子功能不同,Zn400仅属于结构原子,Zn500则位于活性位点,对催化活性和对接结果具有显著影响.相关的实验数据均在0.1mol·L-1甘氨酸-NaOH缓冲液 (pH=10.5,65℃)的条件下测定的[10].
小分子一般没有现成的PDB文件,所以文中底物分子的原始数据源自NCBI的Pubchem,并需要通过PRODRG2Server,转为为PDB文件(http:∥davapc1.bioch.dundee.ac.uk/prodrg/).图1为选用的15种底物小分子结构,表1为其相应的催化能力参数[10].表1中:Km为抗体与底物结合的解离平衡常数(米氏常数);Kcat为抗体酶存在时的转换速率;CID为化合物的编号.
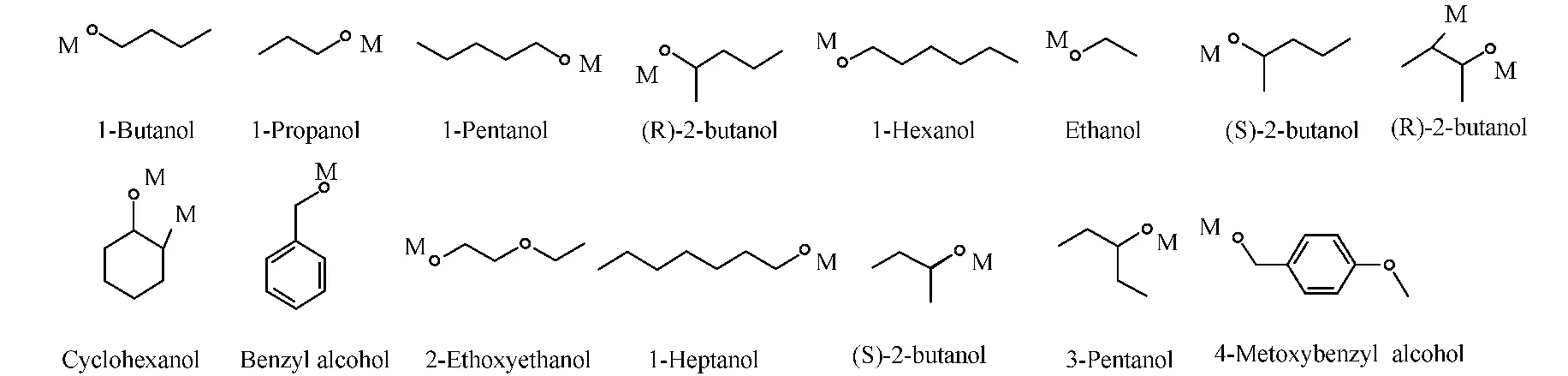
图1 15种底物分子的结构Fig.1 Structure of the 15substrates
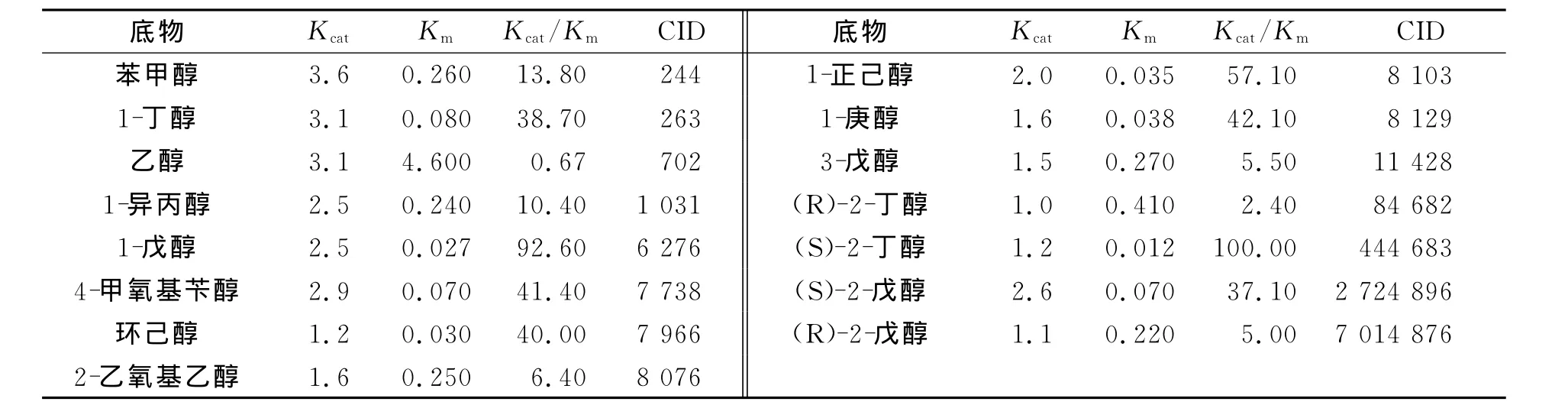
表1 对不同底物催化能力参数表Tab.1 Catalytic capacity parameters with all substrates
1.2 模拟方法
采用的分子对接方式:a)单亚基酶蛋白与底物分子对接;b)单亚基酶蛋白+辅酶与底物对接;c)单亚基酶蛋白+辅酶+锌离子(位于活性位点的Zn500)与底物进行对接.由于要进行Gasteiger加电计算,要求小分子底物必须提前做过能量最小化且加上所有氢.此过程可在PRODRG2Server生成pdb文件时完成.在对接条件的选择中,将蛋白质分子作为刚性分子考虑,并且不合并非极性氢.由于所下载的PDB文件本身就带有辅酶NAD及底物,故可通过计算PDB文件中底物分子的中心来估算活性位点的坐标.
GridBox的设定将明显影响到分子的对接效果,故设定的GridBox需遵守以下的2个原则:1)确保活性位点周边基团都能纳入GridBox,这是底物正确对接的基本保证;2)设定尽可能小的GridBox,有效对接的比例将大大增加.在保持模拟次数不变的条件下,有效对接次数的增加将使最佳对接模型更接近实际情况.综合考虑底物分子中心及分子口袋位置,选取(70.389,16.766,15.254)作为中心点.其中:X,Y,Z轴的长度单位分别取40,42,40,晶格大小定义为3.75×10-11m.使用的软件为Autodock 4.2小分子三维建模软件.
2 结果与分析
2.1 辅酶对分子对接结果的影响
当仅使用酶蛋白与底物进行对接的时候,底物分子被对接在原来酶蛋白与NAD相作用的位点,如图2所示.由此可以推断后者的对接是没有意义的 .小分子与酶蛋白的对接结果,如图3所示 .图3中:E为分子势能 .对比图3的实验数据可知:对接结果所得的各参数与实验测定的Km值没有相关性,其r值仅为0.13,而p值为0.63,远远大于所要求的小于0.05的值.

图2 小分子与酶蛋白的错误对接Fig.2 Error docking result of the substrates with zymoprotein
实验解析出的底物分子、辅酶和锌离子紧紧相邻而互不重叠,它们共同位于分子最大的一个沟,辅酶恰好填补了沟内的深处空间,而锌离子附近则位于酶的活性位点附近.辅酶存在时,小分子能正确地对接在靠近口袋出口的地方;而缺少NAD时,小分子则向口袋纵深漂移(图2).
2.2 锌离子对分子对接结果的影响
Zn离子并不会通过占据空间的方式阻止地位结合到错误的位点,相反,它起到了一个吸引的作用,能降低底物分子漂出活性口袋的概率.图4为小分子与全酶的对接结果,表2为不同对接方式的r值.从图3,4和表2的对接结果可以看出:带有锌离子的全酶比不带有锌离子的酶的对接结果与实验值具有更高的相关性.Hu等[11]研究也显示,锌离子在总的结合能中贡献了相当大的一部分.这就解释了为什么没有锌离子的时候也能正确对接,而对接位点的专一性会下降.锌离子能够起到一个稳定体系的作用,具体表现为当缺少锌离子的时候,对接结果的RMSD值显著上升[12].

图3 小分子与酶蛋白的对接结果Fig.3 Docking result of the substrates with zymoprotein
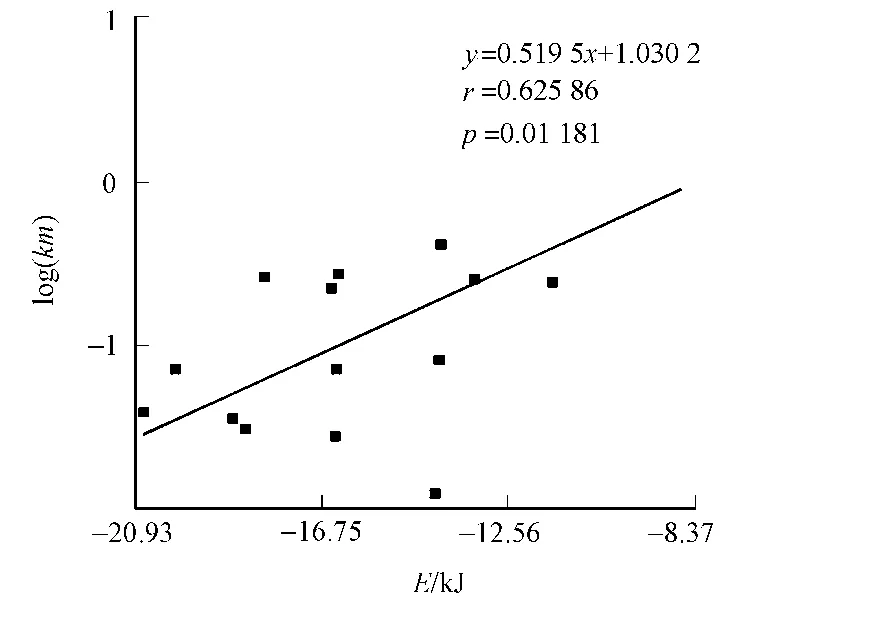
图4 小分子与全酶的对接结果 Fig.4 Docking result of the substrates with holoenzyme
由于Autodock默认将均方根偏差(RMSD)值相差在2以内的对接结果归于同一组,RMSD值的上升将导致对接结果的分组明显增多.因此从对接结果来看,其分组数目与RMSD值一样,都是体现体系稳定性的一个重要指标.对接的结果表明该乙醇脱氢酶是锌离子依赖性的,这与相关文献的研究结果是一致的[13].引入NAD及Zn以后,数据的相关性就大大增强了,r值为0.63,p值为0.01,模型达到极显著相关性 .此外,RMSD值的变化也趋于变小,表现为分组变少或对接结果更加集中于第一组,证明体系的稳定性是因为引入辅酶和辅基而显著增强的.

表2 不同对接方式的r值Tab.2 r-value of different docking ways
图5为正确的分子对接结果.图5显示了底物分子,NAD和Zn三者的相对位置,是通过实验解析所得出的空间关系.为了更清晰地显示小分子,NAD和Zn,以不同的显示方式来表示不同分子.从图5可以发现:底物分子,NAD和Zn三者都被包埋在分子的同一深沟,底物分子位于此深沟的最外区.
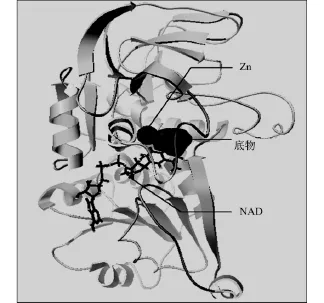
图5 小分子与全酶的相对位置Fig.5 Relative position of the substrates with holoenzyme
从以上数据可以得出如下3点结论:1)底物与酶进行对接的过程中,辅酶和金属离子对于酶活性的保持是不可或缺的,它们的存在与否大大影响到对接的可靠性;2)当只使用酶蛋白与底物进行分子对接的时候,所得数据与实验值无任何相关性;3)与酶蛋白对接的在原始数据中,各独立实验的RSMD值变化很大,证明对接的专一性很差.有文献表明[4],小分子没有直接同酶蛋白相互作用,而是与酶-金属离子复合体相互作用,对接所得的数据恰恰佐证了这一点.从图3,4和表2的R值可以看出:当NAD和Zn同时存在的时候,数据的相关性更强.
2.3 其他因素对分子对接结果的影响
经过对对接结果的分析,发现单个氢键的键能、键长并不会对对接结果的打分造成明显影响.所有有效的对接结果中均存在相同的氢键(由第40位的Ser(丝氨酸)与底物分子中的氧原子形成).然而,错误的对接结果则可能含有更多的氢键(3~4个氢键),这表明氢键的数量对分子的结合有明显的影响,氢键越多,分子间结合越稳定.只有形成有效的氢键才是正确的对接结果,且只有正确的空间位置才能保证酶的催化活性.除了位点空间位的互补、静电相互作用和氢键以外,溶解熵也对稳定受体-配体复合物起着重要的作用[14].
需要注意的是,对接时虚拟的环境与实验的测定环境不同,目前的对接程序尚无法提供具体的离子强度、温度等参数的设定.实际试验中,体系的离子强度、离子种类以及温度都能影响到酶与底物的结合情况.例如,Sulfolobussolfataricus是一种超高温菌[9],故实验使用的数据是在0.1mol·L-1甘氨酸-NaOH缓冲液(pH=10.5,65℃)的条件下测定的[10].Autodock对条件进行了简化和近似处理,在计算能量时将体系温度设定为298.15K(25℃),而pH值及离子强度和种类也难以设定.有文献显示,温度,pH值和金属离子对乙醇脱氢酶的活性均有显著影响[15].综上所述,这样的条件差别会明显影响到分子对接的准确性及其与实验数据Km的相关性.
3 讨论
分子对接结果能提供一个统计学上的参考,但当前的分子对接选算法不可能替代传统实验.虽然分子对接的结果并不能十分精确反应底物与蛋白质相互作用的结果,分子结合力的强弱也不能完全反映酶活性的大小(过高的结合力将使得酶促反应的效果变差)[16].但值得一提的是,分子对接的结果具有明显的统计学意义(结合力弱的一定不会是最佳底物),如果利用其结果进行初步筛选,将会极大节省时间和实验成本.Richard[17]曾经把350万台个人计算机连接起来,在几天内从数十亿的类药分子库里筛选出目标蛋白质的配体,而筛选出的数百个小分子经测试约10%的小分子有活性.
对接结果表明:单独的酶蛋白对接结果没有统计学意义,证明了酶蛋白失去辅酶后确实不具有生物学活性.辅酶对于酶分子的活性具有至关重要的作用,对于乙醇脱氢酶来说,底物是同酶蛋白-辅酶复合体相互作用完成酶促反应的.锌离子则能够给起到一个稳定体系的作用,缺乏锌离子将引发酶活性的降低.当然,文中分子对接环境与实验中酶分子所处真实环境有所不同,这对分子对接结果与酶活性实验结果的相关系数有可能有一定影响.
对于带有辅酶或者金属辅基的分子对接,欲预测某个特定酶对底物的生物活性,则必须将辅酶及金属离子加入到对接体系中,否则对接的特异性和有效性将大打折扣,不能取得有参考意义的结果.对于不知道结合位点的盲目对接(blind docking)来说,金属离子和辅酶的意义就更为重要了.底物分子与酶的对接结果并不能完全反映酶对底物的活性,因为酶活性不仅涉及底物与酶的结合,还涉及产物的离开,并且分子对接的过程中其理化参数会与生理状态下有所不同.虽然分子对接的结果只能提供一个相对粗糙的、趋势性的预测,但是确实能够极大缩减实际实验的成本,对提高实验的效率和经济效益具有非凡的意义.
[1] HIDEHIKO H,NORIHO K,YUTAKA K,et al.Properties of an alcohol dehydrogenase from the hyperthermophilic archaeonAeropyrumpernixK1[J].Journal of Bioscience and Bioengineering,2004,97(3):202-206.
[2] REID M F,FEWSON C A.Molecular characterization of microbial alcohol dehydrogenases[J].Critical Reviews in Microbiology,1994,20(1):13-56.
[3] ZHANG J,DUETZ W A,WITHOLT B,et al.Rapid identification of new bacterial alcohol dehydrogenases for(R)-and(S)-enantioselective reduction ofβ-ketoesters[J].Chemical Communications,2005,36(11):2120-2121.
[4] 鲍文娜.乙醇脱氢酶的克隆表达及生物活性分析[D].杭州:浙江大学,2007:6-23.
[5] 张晓霞,毛跟年,张云丽.乙醇脱氢酶应用研究现状[J].动物医学进展,2007,28(12):92-95.
[6] 林锦霞,张燎原,张光亚,等.计算机模拟短小芽孢杆菌木聚糖酶与底物木聚糖的对接[J].生物工程学报,2007,23(4):715-716.
[7] GAI Wei,ZHANG Yan-ling,AI Lu,et al.Screening of HMG-CoA reductase inhibitors from composite salvia miltiorrhiza using autodock[J].Chinese Journal of Natural Medicines,2010,8(1):51-56.
[8] 章媛,陈亚东.同源模建和分子对接研究 HDAC1/HDAC8的选择性[J].物理化学学报,2010,26(6):1676-1686.
[9] 祝伟,彭谦.超高温菌酶构象的刚性和热稳定性的相互关系[J].生命的化学,2003,23(3):187-190.
[10] PENNACCHIO A,ESPOSITO L,ZAGARI A,et al.Role of tryptophan 95in substrate specificity and structural stability ofSulfolobussolfataricusalcohol dehydrogenase[J].Extremophiles,2009,13(5):751-761.
[11] HU X,SHELVER W H.Docking studies of matrix metallo proteinase inhibitors:Zinc parameter optimization to improve the binding free energy prediction[J].Journal of Molecular Graphics and Modelling,2003,22(2):115-126.
[12] 赵文娜,邹建卫,蒋勇军,等.基于HPPK靶标酶的分子对接研究:金属离子 Mg2+的影响[J].化学学报,2005,63(5):434-438.
[13] RADIANINGTYASA H,WRIGHT P C.Alcohol dehydrogenases from thermophilic and hyperthermophilic archaea and bacteria[J].FEMS Microbiology,2003,27(5):593-616.
[14] STODDARD B L,Jr KOSHLAND D E.Prediction of the structure of a receptor-protein complex using a binary docking method[J].Nature,1992,358(27):774-776.
[15] 霍丹群,张云茹,侯长军.Acetobacter Z127乙醇脱氢酶的纯化及酶学性质[J].重庆大学学报:自然科学版,2006,29(4):65-68.
[16] PLEWCZYNSKI D,ŁAZNIEWSKI M,AUGUSTYNIAK R,et al.Can we trust docking results?Evaluation of seven commonly used programs on PDBbind database[J].Journal of Computational Chemistry,2011,32(4):742-755.
[17] RICHARDS W G.From diatomics to drugs and dividends[J].Journal of Molecular Graphics and Modelling,2007,26(3):596-601.

