葡萄酒中水分的冷冻 离心提取法
孙海波,王绍清,王琳琳,林 立
(国家食品质量安全监督检验中心,北京100091)
通过葡萄酒中水分的稳定氢氧同位素比检测法对掺假葡萄酒进行鉴别时,葡萄酒中水分的提取是本技术的关键点。随着稳定同位素比质谱技术及其应用领域的发展[1-2],很多抽提技术已经被应用于样品的水分提取,包括低温真空蒸馏[3-4]、共沸蒸馏[5-6]、微蒸馏法(锌)[7]和沸点蒸馏[2]等。但各种抽提技术各有不足之处,如采用甲苯、二甲苯及煤油等共沸蒸馏技术被证实存在同位素分馏现象[8];锌的微蒸馏法需要与离线稳定同位素质谱仪配合,且只能测δD‰;沸点蒸馏和低温真空蒸馏的应用最为广泛,但针对组成复杂的葡萄酒(80%左右的水,9.5%~15%的乙醇,1%~5%的各种酚、糖、酸、芳香等有机物),蒸馏得到的是乙醇和水的混合物,因此上述常规方法都不完全适用于葡萄酒中水分的提取。活性炭经活化处理后,被广泛应用于脱色和有机物的吸附[9-10],能够实现酒完全脱色,也有文献证明其对乙醇也有一定的吸附作用[11],但并不能将乙醇和水完全分离开来。冷冻浓缩[12-13]是一种提高食品(主要葡萄酒、牛奶和果汁)品质的工艺技术,依据食品的固-液相位分布,在冰和液体两相共存区域,将冰分离出来的技术,冰的分离方法有过滤式离心、压滤和洗涤等[14]。利用葡萄酒中乙醇和水的熔点差距大(乙醇:-117.3℃,水:0℃),本研究开发了冷冻离心与活性炭吸附相结合的方法(称冷冻-离心法),在保证不发生稳定氢氧同位素分馏的前提下,对葡萄酒中水分进行提取。此技术的开发,解决了葡萄酒中水分的稳定氢氧同位素比检测技术的关键问题。
1 材料与方法
1.1 材料与仪器
葡萄酒样 干型,酒精度12%,北京龙徽酿酒有限公司;标准平均海洋水(Standard Mean Ocean Water,SMOW) 同位素比值为 δD‰=0;δ18O‰=0;酸性活性炭[15]称取粉状活性炭(化学纯,80~200目)约200g,加入1L体积分数为10%的盐酸,加热至沸腾,真空过滤,取下结块于一个大烧杯中,用水清洗至滤液中无铁离子为止,在110~120℃烘箱中干燥约10h后使用;乙醇水系列标准溶液的配制 分别移取无水乙醇 0.2、0.5、1.0、1.5、2.0mL 于 10mL 的容量瓶中,加实验室纯净水定容后摇匀备用;乙醇水模拟溶液配制 量取无水乙醇100mL于1000mL的容量瓶中,加实验室纯净水定容后摇匀备用。
Hydra20-20 HTF/EA稳定同位素比率质谱仪英国sercon;7890A气相色谱仪 美国Agilent;Rotofix32A离心机;海尔冰箱(BCD-252KBSL)。
1.2 实验方法
取葡萄酒样品或10%的乙醇水溶液10mL于塑料小瓶中,盖盖拧紧后置于-18℃的冰箱中冷冻8h以上,取出后立即倒置于离心机中进行过滤式离心,离心半径5cm,4000r/min离心3min,取上层冰置于室温,待冰融化后,加入0.5g活性炭,摇匀,静置一段时间后,取上层清液过0.45μm水相微孔滤膜于色谱瓶中待测。
为考察活性炭吸附和冷冻离心分离水分提取方法对水分提取效率和葡萄酒中水分的氢氧稳定同位素检测结果的影响,设计如下多级冷冻离心与活性炭吸附结合水分提取实验,实验设计示意见图1,经活性炭脱色的葡萄酒样品冷冻离心后得到的上层冰标记为样品U,下层溶液标记为样品D;用U和D的下标数字表示离心次数,取每一步的上层冰U和下层溶液D进行氢氧稳定同位素比率和总碳含量的检测,由于D12溶液在-18℃不能结冰,从而未能得到下层溶液冷冻离心二次以后的数据。
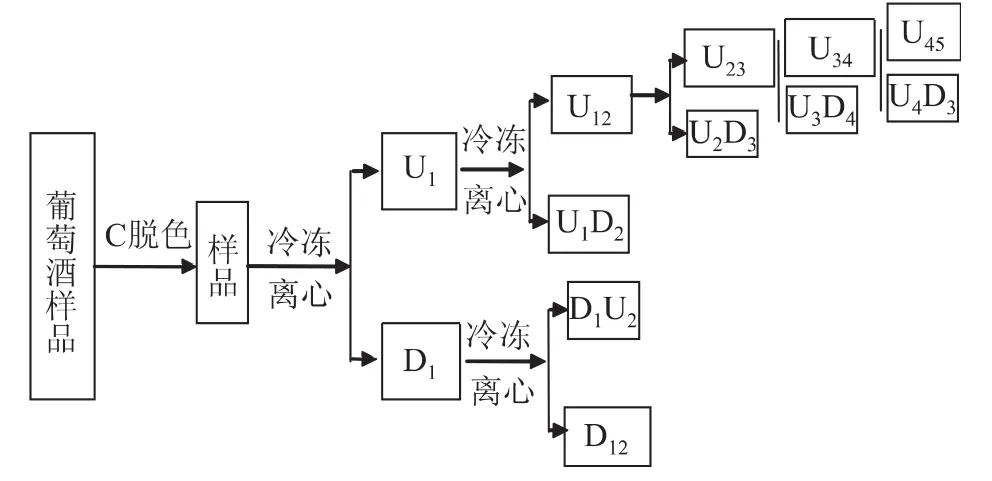
图1 葡萄酒样水分分离效果检验实验设计图Fig.1 Wine sample moisture separation effect test design of experiments
1.3 检测方法
1.3.1 氢稳定同位素的测定 使用HTF-稳定同位素比率质谱仪,载气流速90mL/min,色谱柱温度90℃,HTF炉温1350℃,进样量0.5μL,待设备稳定,每个目标样品重复测试5遍,测定结果由标准平均海洋水(SMOW)校正,取后三遍结果的平均值。
1.3.2 氧稳定同位素的测定 使用HTF-稳定同位素比率质谱仪,载气流速90mL/min,色谱柱温度60℃,HTF 炉温 1350℃,进样量 0.2μL,其他步骤同上。
1.3.3 乙醇去除率的测定 使用气相色谱仪(GC),在测试样品序列的首尾分别检测2%、5%、10%、15%和20%系列乙醇水标准曲线,通过检测目标样品的信号强度计算其乙醇体积百分含量,再通过对比水分提取处理前后目标样品的乙醇的体积百分含量,计算目标样品水分提取过程的乙醇去除率。
1.3.4 总碳去除率的测定 使用EA-稳定同位素比率质谱仪,载气流速60mL/min,色谱柱温度100℃,EA氧化柱1000℃,还原柱600℃,待设备稳定,吸取20μL样品于加有硅吸附剂的锡杯中,包裹成小球立即进样(放置时间不超过10min),测定目标样品的含碳量,通过对比水分提取处理前后目标样品的总含碳量,计算目标样品水分提取过程的总碳去除率。
2 结果与讨论
2.1 活性炭吸附和冷冻离心水分提取方法比较
2.1.1 活性炭吸附 实验考察了活性炭的用量和吸附时间对水分提取的影响,结果见表1。结果表明,无论增加活性炭的用量,还是延长吸附时间,葡萄酒中的色素及其他有机物的脱除效果明显,而乙醇的去除率都很低。所以无法仅仅通过活性炭吸附实现葡萄酒中的水分提取以用于稳定氢氧同位素比的测定。
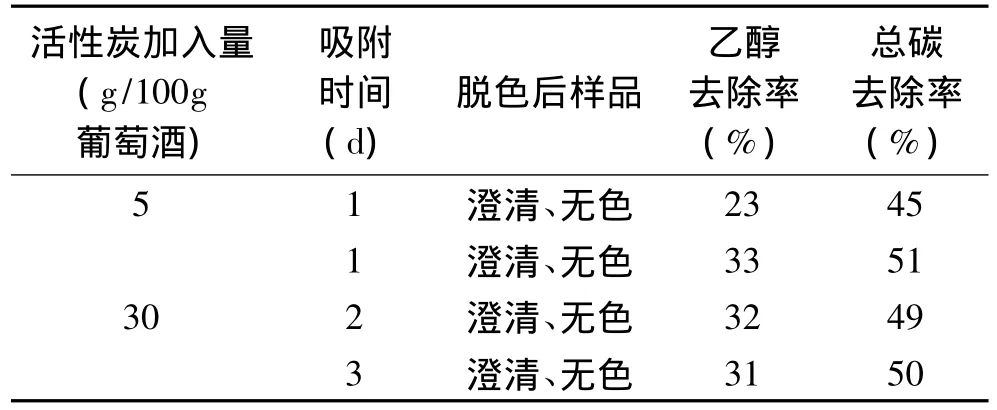
表1 活性炭吸附时间和浓度对吸附效率的影响Table 1 Fiber activity of carbon adsorption time and concentration on adsorption efficiency
2.1.2 冷冻离心 分别考察了冷冻后样品平衡时间和离心时间对样品的乙醇去除率和总C去除率的影响,结果见表2和表3。如表2所示,在-18℃的冰箱中冷冻12h以上后,样品置于-5℃的冰箱中平衡5h虽然乙醇去除率略有增加,但水分的提取率却降低了一倍,因此样品应该在-18℃的冰箱中冷冻后直接进行离心以提取其中的水分。从表3的结果可以看出,离心时间为3min,葡萄酒和10%乙醇水经冷冻离心提取后的乙醇和总碳去除率最高,理论上离心时间越长分离越彻底,但离心时间过长造成冰的融化程度增加,从而减小乙醇的去除率。另外葡萄酒经冷冻离心提取后总碳去除率明显低于乙醇去除率,表明葡萄酒样品中的色素和其他有机物经冷冻离心分离后的去除率偏低。

表2 平衡时间对分离效率的影响Table 2 Effect of equilibration time on separation efficiency
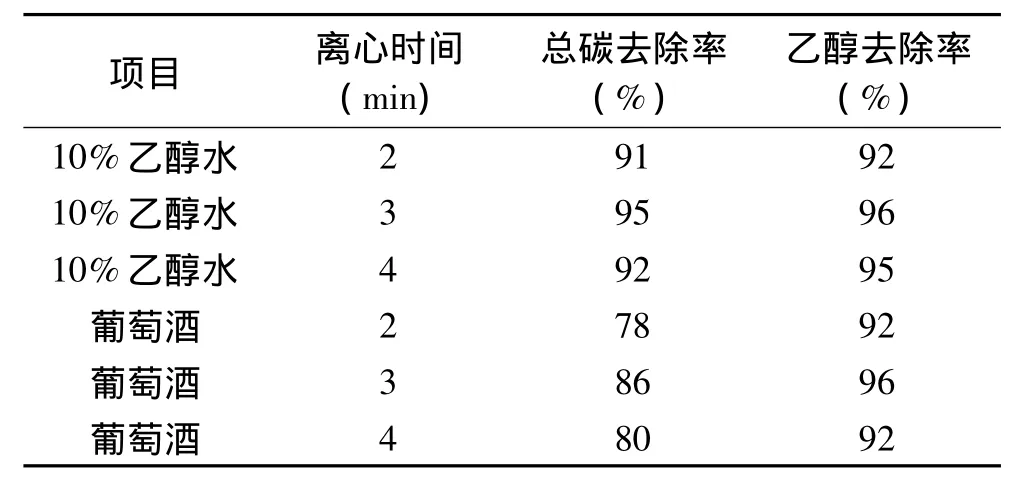
表3 离心时间对分离效率的影响Table 3 Effect of centrifugation time on separation efficiency
2.2 冷冻-离心法条件优化
依据方法中系统实验设计,每一级经冷冻离心样品的乙醇百分含量结果见图2,稳定氢同位素比率值见图3。结果表明:冷冻离心一次就能使乙醇在上层(冰)和下层溶液中发生有效的重新分配,冷冻离心两次,上层冰中的乙醇的含量已趋近于零,而且下层溶液中的乙醇明显富集;冷冻离心U(冰)和D溶液的稳定同位素δD‰检测结果发生明显分离,且U(冰)离心2次以后的检测结果基本稳定,这说明冷冻离心2次以上提取的水样可以代表葡萄酒样品用于氢氧稳定同位素比率的测定。
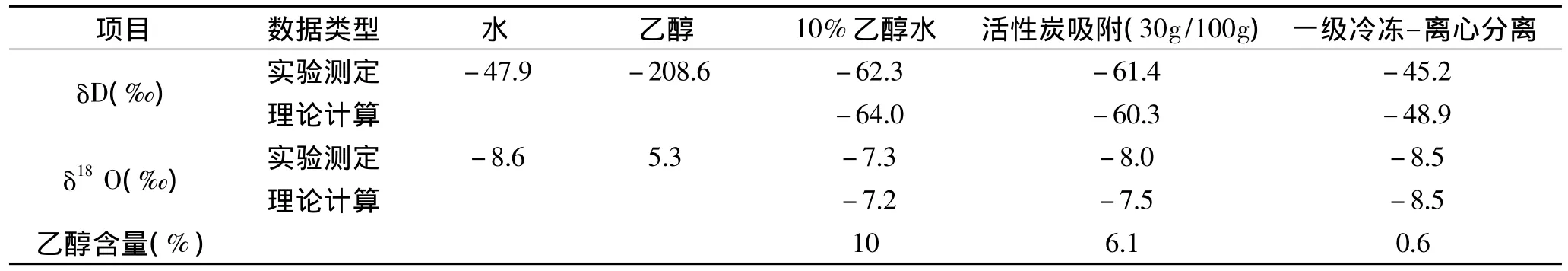
表4 活性炭吸附和冷冻-离心分离方法对稳定同位素检测结果的影响Table 4 Carbon adsorption and freezing-centrifugal separation method for stable isotope detection result influence
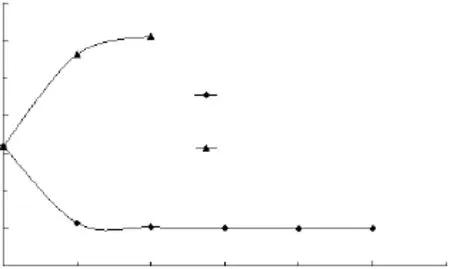
图2 冷冻离心次数对分离效率的影响Fig.2 Frozen centrifugation times on the separation efficiency effect
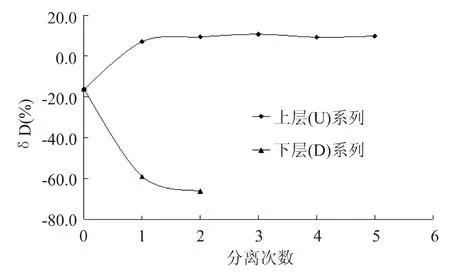
图3 冷冻离心次数对稳定氢同位素检测的影响Fig.3 Frozen centrifugation times on the stable isotope detection effect
2.3 冷冻-离心法提取葡萄酒样品中水分有效性的验证
用实验室配制的10%乙醇水溶液进行冷冻-离心和活性炭吸附实验,实验前后样品的稳定氢氧同位素比的测定结果和乙醇的百分含量见表4,依据乙醇和水的稳定氢氧同位素比值与乙醇的百分含量的测定结果,通过计算得到10%乙醇水溶液及其经水分提取后氢氧稳定同位素的理论计算结果也示于表4。从实验结果看,理论计算结果与实验检测结果在偏差范围内均一一对应。这说明:冷冻-离心和活性炭吸附相结合的实验方法在分离过程没有引起水的δD‰和δ18O‰稳定同位素分馏和水与乙醇中δD‰和δ18O‰的重新分配,能够实现葡萄酒样品中水分的有效提取。
3 结论
通过系统实验设计优化了冷冻-离心分离法实验条件,实现了葡萄酒中水分的有效提取,葡萄酒经提取后的水样中,乙醇和色素等其他有机物的去除率大于99%,且冷冻-离心分离和活性炭吸附方法均未引起葡萄酒中水分的δD‰和δ18O‰分馏。
[1] VersiniGiuseppe,MonettiA,Reniero F.Monitoring authenticity and regional origin of wines by natural stable isotope ratios analysis[J].Journal Article,1997,661:113-130.
[2]牛丽影,胡小松,赵镭,等.稳定同位素比率质谱法在NFC与FC果汁鉴别上的应用初探[J].中国食品学报,2009,9(6):192-198.
[3]Adam G West,Shela J Patrickson,James R Ehleringer.Water extraction times for plant and soil materials used in stable isotope analysis[J].Rapid Communications Mass pectrometry,2006,20:1317-1321.
[4]王涛,包为民,陈翔,等.真空蒸馏技术提取土壤水实验研究[J].河海大学学报,2009,37(6):661-665.
[5]Revesz K,Woods P H.A method to extract soil water for stable isotope analysis[J].Journal of Hydrology,1990,115:397-406.
[6]Hendry M J.Groundwater recharge through a heavy-textured soil[J].Journal of Hydrology,1983,63:201-209.
[7]Walker G R,Woods P H,Allison G B.Interlaboratory comparison of methods to determine the stable isotope composition of soil water[J].Chemical Geology,1994,111:297-306.
[8]Araguas-Araguas L,Rozanski K,Gonfiantini R,et al.Isotope effects accompanying vacuum extra-ction of soil water for stable isotope analyses[J].Journal of Hydrology,1995,168:159-171.
[9]易四勇,王先友,李娜.活性炭活化处理技术的研究进展[J].食品科技,2008,22(3):72-75.
[10]吴光前,孙新元,张齐生.活性炭表面氧化改性技术及其对吸附性能的影响[J].浙江农林大学学报,2011,28(6):955-961.
[11]邓丹雯,周武,张彬.变色基酒的脱色实验研究[J].食品科技,2002(3):11-12.
[12]张春娅,张军,王树生,等.葡萄酒冷冻浓缩技术的研究及应用[J].酿酒科技,2007(2):55-60.
[13]孙卉卉,马会勤,陈尚武.冷冻浓缩对低糖葡萄汁及葡萄酒品质的影响[J].食品科学,2007,28(5):86-91.
[14]高福成.现代食品工程高新技术[M].北京:中国轻工业出版社,2006:221-225.
[15]李洪美,王同华.改性活性炭纤维的制备及对乙醇的吸附[EB].中国科技论文在线,http://www.paper.edu.cn.

