提取温度与提取时间对真鳕鱼骨明胶理化性质的影响
王珊珊,卢玉坤,杨 霞,常钰菲,解 铭,李八方
(中国海洋大学食品科学与工程学院,山东青岛266003)
明胶是胶原蛋白经过不可逆水解转化而成的变性纤维状蛋白,其主要成分为氨基酸组成相近但分子量分布很广的水溶性多肽混合物。明胶作为功能性添加剂,具有优良的胶体保护性、粘稠性、稳定性和浸润性,因此被广泛应用于食品和医药等行业[1]。传统明胶是使用陆生动物(主要是猪、牛等)的皮、骨和筋腱等结缔组织通过酸或碱处理后,经蒸煮、提取和浓缩而制成。在提取过程中,由于温度、溶剂、pH和时间等因素的差异,明胶大分子会表现出不同的构象,其功能特性也会随之改变。近年来全球对明胶的需求量持续上涨,但随着疯牛病等人畜共患疾病的出现,传统明胶的安全性受到广泛质疑。水产明胶由于具有更高的使用安全性,且不受地区和宗教因素限制,因而具有广阔的市场应用前景[2]。目前水产明胶主要是由鱼皮制得,其开发应用意味着水产业每年产生的大量加工副产物能够得到合理利用。太平洋真鳕(Gadus macrocephalus)作为重要的商业捕捞品种,每年的平均年捕捞量已超过25万t。在我国,真鳕主要用于冷冻鳕鱼鱼片的生产,随之产生的大量皮、骨等下脚料至今没有得到充分有效地利用。鱼皮做为水产明胶的原料已经得到较多研究[3],而从鱼骨中提取明胶并探讨其理化性质的研究目前还相对较少[4]。本实验使用太平洋真鳕为原料,研究提取温度与提取时间对鱼骨明胶理化性质的影响,为实现鱼骨明胶作为食品等功能性添加剂的产业化生产提供理论依据。
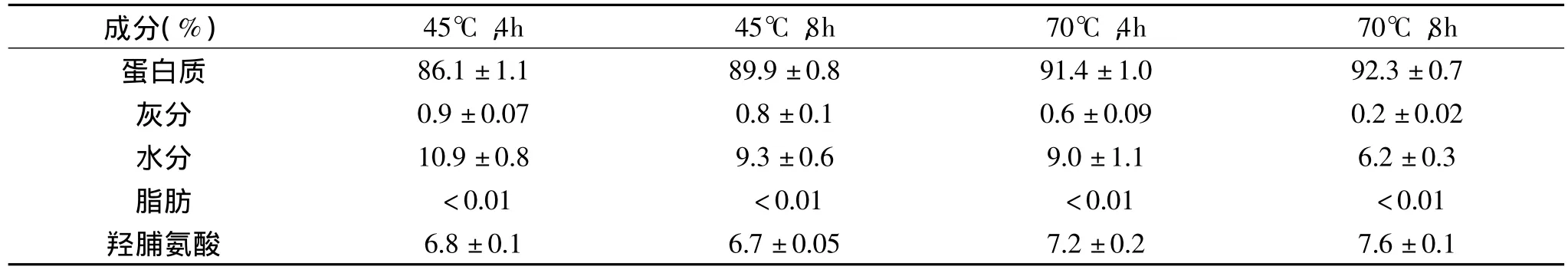
表1 基本成分分析Table 1 Proximate analysis of samples
1 材料与方法
1.1 材料与仪器
太平洋真鳕(Gadus macrocephalus)鱼骨 取自青岛福生食品有限公司,原料获取后,经清洗并去除杂质,冷藏于-18℃冰箱中备用;HCl、对二甲氨基苯甲醛、氯胺T、高氯酸、乙二胺四乙酸二钠等试剂 均为国产分析纯。
HHS-Ni型电热恒温水浴锅 北京长安科学仪器厂;Alpha 1-4LD型冷冻干燥机 德国CHRIST公司;Nicoletnexos型傅立叶红外光谱仪 美国Nicolet公司;Hitachi 835-50氨基酸自动分析仪 日本日立公司;JSM-840型扫描电子显微镜 日本JEOL公司。
1.2 实验方法
1.2.1 样品的制备 明胶样本的提取流程如下[5]:将经过预处理清洗的鱼骨使用4%盐酸溶液处理18h,溶胀结束后,鱼骨清洗至中性匀浆。热水提取温度分别设置为45、70℃,不同提取温度的提取时间分别设置为4、8h。热水提取后离心获得上清液,冷冻干燥后得到4种热水提取明胶(Hot-water extracted gelatin,HEG)样品:45℃ 4h,45℃ 8h,70℃ 4h 和70℃ 8h。
1.2.2 基本成分的测定 水分测定:恒温干燥法(GB 5009.3-2010)[6];蛋白质测定:凯氏定氮法(GB 5009.5-2010)[7];脂肪测定:乙醚抽提法(GB/T 14772-2008)[8];灰分的测定:灰化法(GB 5009.4-2010)[9];羟脯氨酸测定:ISO3496:1978(E)[10]方法。
1.2.3 凝胶强度分析 凝胶的制备:将HEG样品溶解于 60℃蒸馏水中,使样品终浓度达到 6.67%(w/v)。搅拌溶液至样品全部溶解,将溶液置于4℃陈化18h。
凝胶强度的测定(GB 6783-94)[11]:以直径为12.7mm的圆柱,压入含有6.67%HEG的胶冻表面以下4mm时,所施加的力为冻力,以Bloom g为单位。1.2.4 浊度分析 配制浓度为6.67%的HEG样品水溶液,并使用紫外-可见分光光度法在360nm下测试溶液的浊度[12]。
1.2.5 乳化性质分析 根据Pearce等人的方法,测定HEG样品的乳化性与乳化稳定性[13]。配制浓度分别为10、20、30mg/mL的HEG样品溶液,量取该溶液22.5mL与7.5mL的大豆色拉油相混合。设定高速组织分散机参数为20000r/min,对混合液乳化1min。使用微量进样器从底部迅速吸取50μL乳化液和5mL 0.1%SDS溶液混合均匀,然后在500nm处测其吸光度。空白使用0.1%SDS溶液。样品乳化性(Emulsifying Activity Index,EAI)和乳化稳定性(Emulsifying Stability Index,ESI)的计算公式如下所示:
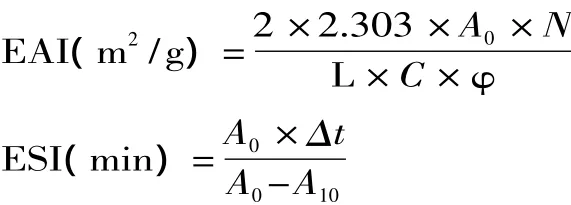
式中:A0代表0min的吸光度;A10代表乳化液10min后所测定吸光度;L代表比色皿光径为0.01m;N代表稀释倍数为100;C代表形成乳化液前蛋白质溶液中蛋白质的浓度,g/m3;Φ代表乳化液中油体积分数是0.25;Δt代表10min。
1.2.6 起泡性质分析 按照Shahidi等人的方法测定HEG的起泡性和起泡稳定性[14]。配制浓度分别为10、20、30mg/mL的HEG样品溶液,量取一定体积V0的溶液,在高速组织分散机中以13400r/min转速搅拌2min,然后立即测定搅拌后的总体积V1,静置40min后,记下总体积V2。泡沫膨胀率(Foam expension,FE)和泡沫稳定性(foam stability,FS)。计算公式如下:FE(%)=(V1-V0)/V0×100;FS(%)=V2/V0×100。
1.2.7 傅立叶变换红外光谱(FTIR)分析 在干燥条件下,将适量样品和KBr在玛瑙研钵中充分研磨混匀。取样品手动压片,将样品放入样品室,使用Nicolet-200SXV傅立叶红外光谱仪对样品在4000~500cm-1区间扫描,分辨率设置为2cm-1。
1.2.8 氨基酸组成分析 将样品用6mol/L盐酸于110℃水解24h,脱酸后使用Hitachi 835-50氨基酸自动分析仪进行测定。
1.2.9 扫描电镜(SEM)观察 将本实验1.2.3部分所制备的6.67%(w/v)HEG凝胶切成1mm厚的小块,使用2.5%(v/v)戊二醛溶液(pH7.2)固定12h。将样品清洗后逐级脱水。将脱水后的样品折断,将自然断面作为观察面,真空喷金后使用JEOL JSM-840型扫描电镜(SEM)对样品显微结构进行观察[15]。
2 结果与讨论
2.1 基本成分的测定
HEG样品的蛋白含量随着提取温度和提取时间的提高而有所增加,这可能是因为在较高的提取温度和较长的提取时间下,热力能够充分断开胶原纤维分子内和分子间的共价交联及氢键,提高了蛋白得率。热水提取制备明胶样品的灰分均小于1%,脂肪成分小于0.01%,这说明热水提取工艺能够有效避免非明胶成分的抽提。
2.2 凝胶强度分析
如图1所示,HEG的凝胶强度随着提取温度的升高而显著降低,与45℃HEG凝胶样品相比,70℃制备的HEG样品凝胶强度急剧下降(p<0.05)。由于提取条件的不同,热水提取法制备胶原蛋白会导致胶原蛋白分子在不同程度上的水解[16]。胶原蛋白分子中的一部分α链及低聚体会在适度的水解过程中释放出来形成氢键,有利于分子的聚集和凝胶交联的形成。但随着提取温度的升高和提取过程的继续进行,蛋白分子水解加剧。由于α链的过度降解,凝胶在陈化过程中无法形成有序交联,从而导致凝胶强度的下降。由图1可见,在一定的提取时间内,高温对明胶凝胶能力的破坏尤为显著。
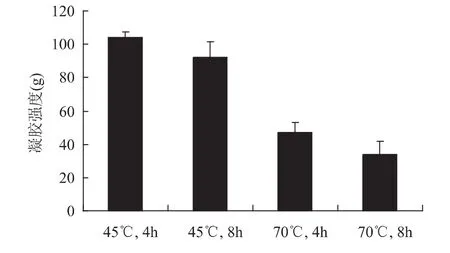
图1 提取温度和提取时间对凝胶强度的影响Fig.1 Effect of different extraction times and temperatures on the gel strength
2.3 浊度分析
HEG溶液的浊度随着提取温度的上升和提取时间的延长而提高。HEG溶液浊度的提高通常伴随着凝胶强度的减少。当提取时间相同时,70℃提取的HEG样品浊度显著高于45℃制备的HEG样品浊度(p<0.05),相应70℃HEG样品的凝胶强度下降到最低值。蛋白分子发生无序错误的聚集有可能导致凝结块的形成,引起溶液浊度提高,并最终造成凝胶网状结构的紊乱,造成凝胶强度的减少[17]。当蛋白分子在高温条件下无序聚集程度增高时,溶液的浊度也随之增大[18]。
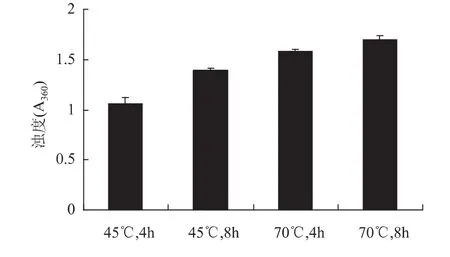
图2 提取温度和提取时间对浊度的影响Fig.2 Effect of different extraction times and temperatures on the turbidity
2.4 乳化性质分析
HEG样品的乳化性和乳化稳定性随提取温度和提取时间的提高而降低。胶原蛋白分子在热水提取的过程中会逐渐水解,产生低分子量的肽段,并暴露出亲水性基团。高温(70℃)和长时间(8h)热水提取所得HEG具有更高的亲水性,易于留在水相而非油-水界面。低温(45℃)和短时间(4h)热水提取所得HEG更易于在油-水界面富集并降低界面张力,其乳化性和乳化稳定性显著高于高温(70℃)条件下制备的HEG样本(p<0.05)。乳化稳定性主要取决于界面膜中蛋白质间的静电斥力。Surh等[19]人发现在水包油型乳状液中分子量较高的胶原蛋白片段乳化稳定性更佳,高分子量蛋白质所形成的界面膜厚度较大。
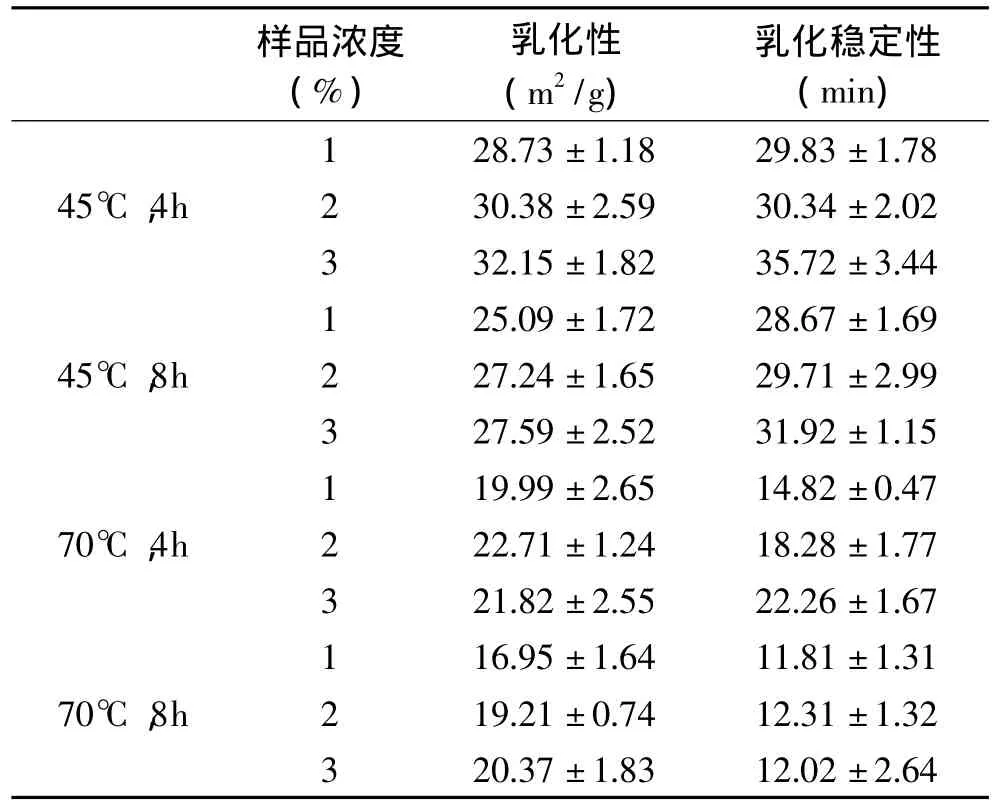
表2 提取温度和提取时间对样品乳化性质的分析Table 2 Effect of extraction temperatures and times on emulsifying properties
如表2所示,尽管多数测定结果之间差异并不显著,但HEG的乳化能力和乳化稳定性一般随蛋白质浓度增大而有增高的趋势。主要原因是蛋白分子在油-水界面上吸附,随着蛋白浓度的增加,吸附层逐渐形成更加紧密的、具有一定厚度和强度的界面膜。但乳化性质也有随浓度增高而降低或者增加不显著的例子,例如在70℃提取8h条件下提取的HEG其乳化稳定性在蛋白质浓度为3%时与2%时相比并未有所增高。这可能是因蛋白浓度超过一定值,即使再增加蛋白分子的数量,其结合油的量也不会再发生明显变化,界面膜的厚度和强度增加亦随之变小,故其稳定性未能提高。
2.5 起泡性质分析
如表3所示,HEG样品的起泡性和起泡稳定性随其浓度的增高而有显著性上升(p<0.05)。高浓度蛋白溶液的界面膜较厚,因此泡沫更为密集和稳定。如果蛋白质分子在起泡过程中能够快速富集于气-液界面,同时在界面上分子发生重排反应并结构伸展,则其起泡性能更好[20]。分子量较小的蛋白分子更易富集到气-液界面,形成较为坚韧的液膜。起泡稳定性与多种因素有关,例如达到平衡表面张力的速率、体积黏度和表面黏度和液膜两侧的电斥力等[21]。随着提取温度的升高和提取时间的延长,HEG分子逐渐发生降解,肽链展开且极性基团暴露,分子易于与液膜结合,增加了液膜的韧性,使起泡稳定性得以提高。
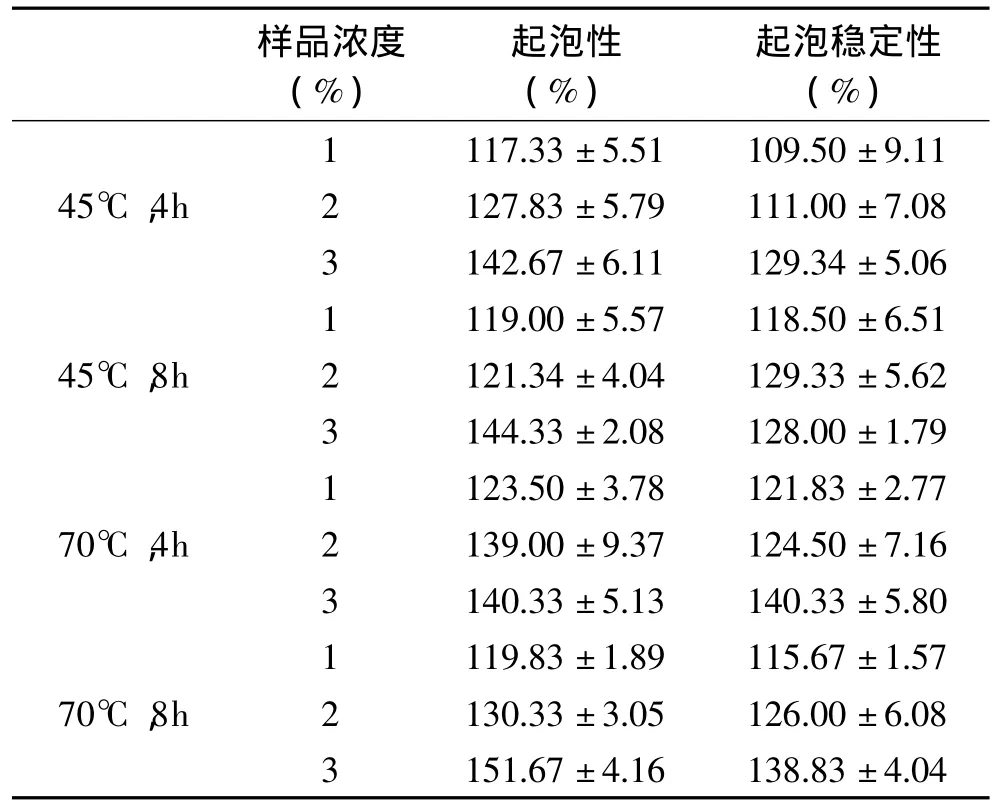
表3 提取温度和提取时间对样品起泡性质的分析Table 3 Effect of extraction temperatures and times on foaming properties
2.6 傅立叶变换红外光谱(FTIR)分析
FTIR光谱可用来研究胶原蛋白的二级结构变化,酰胺I带是蛋白质多肽骨架C=O伸缩振动产生,是研究蛋白质二级结构变化的最有效区域[22]。由图1可知,在一定提取时间内,高温对HEG样品凝胶能力的影响较为显著,故本实验选择45℃及70℃8h制备的HEG样品,比较其红外光谱图。由图3可见,与未变性酸溶性胶原蛋白(ASC)[23]相比,热水提取明胶HEG的酰胺A吸收峰变宽,酰胺A与酰胺B的吸收强度亦有所减少;HEG的酰胺I和Ⅱ峰值强度明显减少。在两组HEG样品中,70℃温度下提取制备的HEG蛋白其酰胺I吸收峰强度要弱于45℃提取的HEG样品,这可能是由于提取温度的提高导致了样品分子无序程度的增加。
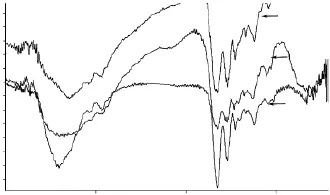
图3 ASC与HEG的红外光谱分析Fig.3 FTIR spectra of ASC and HEC extracted at different temperatures
2.7 氨基酸组成分析
HEG样品的氨基酸组成如表4所示,在4种样品中,甘氨酸、亚氨酸(脯氨酸+羟脯氨酸)和丙氨酸的含量较多,而组氨酸、蛋氨酸、苯丙氨酸、酪氨酸和异亮氨酸的含量较少,未检测出半胱氨酸含量。其中,脯氨酸与羟脯氨酸的含量分别在109~117与72~77之间。Regenstein等人研究认为甘氨酸、丙氨酸、脯氨酸和羟脯氨酸是热水提取明胶中含量最多的氨基酸[24]。在不同提取温度与不同提取时间下制备的4种HEG样品其氨基酸组成并无显著差异(p>0.05)。

表4 氨基酸组成分析(‰)Table 4 Comparative analysis of amino acid composition of samples(‰)
2.8 扫描电镜(SEM)观察
在凝胶基质骨架中,蛋白分子的排列方式与其凝胶强度大小有关[25],通常排列有序且孔洞较小的凝胶具有较好的强度。在两组HEG凝胶样品的扫描电镜观察图中(如图4所示),45℃提取制备的HEG样品凝胶结构较为紧密有序,而70℃提取制备HEG样品凝胶中可见大量无规则排列孔洞,这说明高温条件下制备的明胶其凝胶结构更容易被破坏。

图4 HEG凝胶样品的扫描电镜(SEM)观察图Fig.4 SEM images of gel samples
3 结论
实验结果显示,随着提取温度的升高和提取时间的延长,HEG样品凝胶强度、乳化和乳化稳定性随之下降,而其浊度和起泡性能则有所上升。红外光谱分析显示70℃提取制备的明胶样品其酰胺I吸收峰强度要弱于45℃提取的样品,说明提取高温会导致样品分子结构无序程度的增加。在扫描电镜观察下,高温制备的凝胶呈无规则结构排列,且具有大量孔洞。
[1]Johnston-Banks F A.Gelatin[M].In P Harris(Eds),New York:Elsevier Applied Sciences,1990:233-289.
[2]Muyonga J H,Cole C G B,Duodu K G.Extraction and physicochemical characterization of Nile perch(Lates niloticus)skin and bone gelatin[J].Food Hydrocolloids,2004,18:581-592.
[3]Karim A A,Bhat R.Fish gelatin:properties,challenges,and prospects as an alternative to mammalian gelatins[J].Food Hydrocolloids,2009,23:563-576.
[4]Kolodziejska I,Skierka E,Sadowska M,et al.Effect of extracting time and temperature on yield of gelatin from different fish offal[J].Food Chemistry,2008,107:700-706.
[5]王珊珊,单银银,李志皓,等.真鳕鱼骨明胶的提取工艺及性质研究[J].食品与发酵工业,2012,38(7):152-156.
[6]GB 5009.3-2010.食品安全国家标准食品中水分的测定[S].中华人民共和国国家标准.
[7]GB 5009.5-2010.食品安全国家标准食品中蛋白质的测定[S].中华人民共和国国家标准.
[8]GB/T 14772-2008.食品中粗脂肪的测定[S].中华人民共和国国家标准.
[9]GB 5009.4-2010.食品安全国家标准食品中灰分的测定[S].中华人民共和国国家标准.
[10]ISO 3496(E).Meat and meat products-determination of L(-)hydroxyproline content(reference method)[S].International Standardization,1978.
[11]GB 6783-94.食品添加剂 明胶[S].中华人民共和国国家标准.
[12]Fernandez-Diaz M D,Montero P,Gomez-Guillen M C.Gel properties of collagens from skins of cod(Gadus morhua)and hake(Merluccius merluccius) and their modification by the coenhancers magnesium sulphate,glycerol and transglutaminase[J].Food Chemistry,2001,74(2):161-167.
[13]Patel M T,Kilara A.Studies on whey protein concentrates.Foaming and emulsifying properties and their relationships with physicochemical properties[J].Journal of Dairy Science,1990,73:2731-2740.
[14]Shahidi F,Xiao Q H,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotus villosus)[J].Food Chemistry,1995,53:285-293.
[15]Kittiphattanabawon P,Benjakul S,Visessanguan W,et al.Comparative study on characteristics of gelatin from the skins of brownbanded bamboo shark and blacktip shark as affected by extraction conditions[J].Food Hydrocolloid,2010,24:164-71.
[16]Jongjareonrak A,Benjakul S,Visessanguan W,et al.Skin gelatin from bigeye snapper and brownstripe red snapper:chemical compositions and effect of microbial transglutaminase on gel properties[J].Food Hydrocolloids,2006,20:1216-1222.
[17]Pomeranz Y.Functional properties of food components[M].San Diego:Academic Press,Inc.1991.
[18]Johnson T M,Zabik M E.Egg albumin proteins interactions in an angel food cake system[J].Journal of Food Science,1981,46(4):1231-1236.
[19]Surh J,Decker E A,McClements D J.Properties and stability of oil-in water emulsions stabilized by fish gelatin[J].Food Hydrocolloids,2006,20:596-606.
[20]Damondaran S.Protein-stabilized foams and emulsions[M].In S.Damodaran and A.Paraf(Eds.).Food proteins and their applications.New York:Marcel Dekker Inc.1997.
[21]Liu J,Xu G,Yuan S,et al.The effect of macromolecules on foam stability in sodium dodecyl sulfate/cetylpyridinium bromide mixtures[J].Journal of Dispersion Science and Technology,2003,24:779-787.
[22]Surewicz W K,Mantsch H H.New insight into protein secondary structure from resolution enhanced infrared spectra[J].Biochimica et Biophysica Acta-Protein Structure and Molecular Enzymology,1988,952:115-130.
[23]Nagai T,Suzuki N.Preparation and Characterization of several fish bone collagens[J].Journal of Food Biochemistry,2000,24(5):427-436.
[24]Regenstein JM,Zhou P.Collagen and gelatin from marine by-products[M].In:Maximising the value of marine by-products.Shahidi F.(Eds)Woodhead Publishing Limited,Cambridge.2007,pp.279-303.
[25]BenjakulS,Oungbho K,Visessanguan W,etal.Characteristics of gelatin from the skin of bigeye snapper,Priacanthus tayenus and Priacanthus macracanthus[J].Food Chemistry,2009,116(2):445-451.

