北五味子醇提物对亚硝酸钠所致记忆巩固障碍模型小鼠记忆功能的影响
徐 博 安 英 沈 楠 赵丽晶 陈 雪 吴畏难 陈建光
阿尔茨海默病病理机制复杂,更缺乏有效的治疗措施已成为老年人致残最严重的疾病之一,并且随着人口的老龄化,患者日益增多,将给家庭和社会带来沉重的负担[1]。因此对老年性痴呆药物的寻求和研究是当前医学界的一个紧迫问题。学习记忆的“痕迹论”表明,记忆获得、巩固、再现组成了记忆的全过程[2]。本文应用亚硝酸钠造成小鼠记忆巩固障碍,从而观察北五味子醇提物(Schisandra Chinensis baill extract,SCE)对记忆障碍的改善作用。
1 资料与方法
1.1 一般资料实验所用动物为 60只清洁级健康昆明种小白鼠,雌雄兼用,体重(20±2)g,实验动物许可证号为SCXK-(吉)2003~2004,由长春高新医学动物实验研究中心提供;实验所用试剂分别为 SCE(北华大学林学院);亚硝酸钠,长春市试剂厂,批号:930220;脑复康,天津金世制药有限公司,批号:20060661;超氧化物歧化酶(SOD)试剂盒,南京建成生物工程研究所批号:20080417;丙二醛(MDA)含量测定试剂盒,南京建成生物工程研究所批号:20080417;实验所用仪器为小鼠避暗测试仪(成都泰盟科技有限公司)。
1.2 实验方法
1.2.1 动物分组、造模及给药[3-4]将筛选的昆明种小鼠60只,雌雄各半,随机均分成6组,对照组、模型组、脑复康组、SCE低剂量组、SCE中剂量组、SCE高剂量组。对照组与模型组给予蒸馏水灌胃,脑复康组给予脑复康0.3g/kg·d,SCE低、中、高剂量分别给予SCE 0.15g/kg、0.30g/kg、0.60g/kg连续灌胃给药(每只小鼠按0.1ml/10g灌胃)15d。在第15天灌胃给药1h后,进行避暗实验。将小鼠面部背向洞口放入明室,适应环境5min,然后立即通以36V交流电,打开隔板,小鼠穿过洞口进入暗室受到电击,记时自动停止。取出小鼠,记录小鼠从放入明室至进入暗室遇到电击所需时间,即潜伏期。实验完毕除空白对照组外,其余各组立即皮下注射(sc)亚硝酸钠120mg/kg,即破坏记忆的巩固,对照组注射同体积的生理盐水。在第16天重做测试,记录小鼠从放入明室至进入暗室遇到电击所需时间即潜伏期和5min内受电击次数。
1.2.2 样本取材及测定实验第18天称重,快速剥离脑组织,用电子天平称脑组织湿重后用锡箔纸包好,置-80℃低温冰箱保存,待测各种生化指标。测定时,按重量:体积=1:9的比例加入预冷的生理盐水,用组织匀浆机充分匀浆,制成10%的脑组织匀浆,用微量移液器转移至离心管中,3000r/min离心10min。测定时取上清液进行超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量的测定。
1.3 统计学处理本文中数据均以均数±标准差(±s)表示,经SPSS 13.0统计学软件单因素方差分析(One-way ANOVA)中的Dunnett's Test处理。
2 结果
实验结果如表1~3所示。
3 讨论
实验表明,在第二次记忆测试中,SCE中、高剂量组较模型组潜伏期延长,错误次数减少,表明SCE可以改善记忆巩固障碍模型小鼠的记忆能力。SCE可增高抗氧化酶 SOD的活力,抑制脂质过氧化产物MDA的增多,从而减少氧自由基的损伤,加速体内自由基的清除,并且随着 SCE剂量的增加,此种变化越明显,且中药SCE中、高剂量组抗氧化作用明显高于低剂量组。提示,SCE具有清除自由基,延缓细胞老化,抑制细胞退化和变性,改善机体的结构和功能,提高机体生命力的作用。
近年自由基学说与AD的关系越来越引起学者的关注,被认为是AD的一个重要致病因素,而且大量实验也证明抗氧化剂对AD的发病有保护和延缓进程的作用[5]。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基,保护细胞免受损伤。MDA是氧自由基与生物膜多聚不饱和脂肪酸发生脂质过氧化的产物,其产生量与氧自由基的量相平行,因而测定MDA能反映氧自由基的水平,间接反映出细胞损伤的程度。MDA的测定常常与SOD的测定相互配合,SOD活力的高低间接反应了机体清楚氧自由基的能力,而MDA的高低又间接反应了机体细胞受自由基攻击的严重程度。
本实验为临床前期研究 SCE药物治疗老年痴呆症、改善学习和记忆功能提供了有价值的实验数据,但要获得更有价值的治疗药物,还需要做大量艰苦工作。相信随着时间的推移和对SCE改善学习记忆、防治衰老和老年痴呆症的研究进一步深入,SCE相关药物及其保健产品的研发将会取得突破。
表1 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠记忆能力的影响(避暗法)[(±s),n=10]
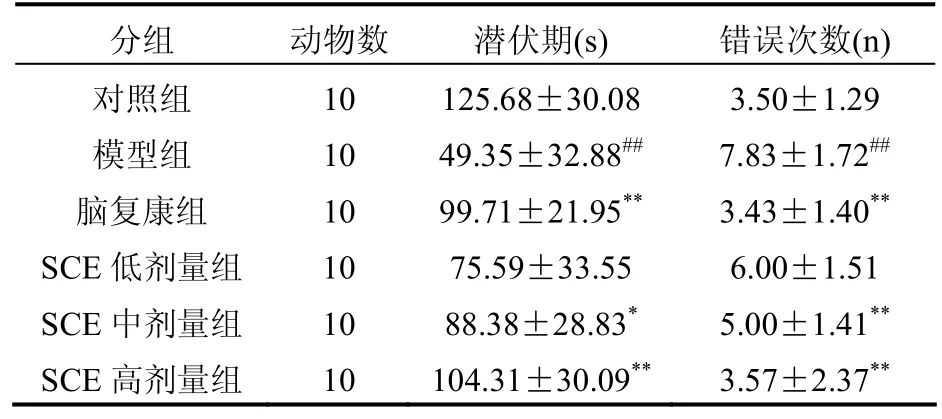
表1 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠记忆能力的影响(避暗法)[(±s),n=10]
注:与对照组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
分组 动物数 潜伏期(s) 错误次数(n)对照组 10 125.68±30.08 3.50±1.29模型组 10 49.35±32.88## 7.83±1.72##脑复康组 10 99.71±21.95** 3.43±1.40**SCE低剂量组 10 75.59±33.55 6.00±1.51 SCE中剂量组 10 88.38±28.83* 5.00±1.41**SCE高剂量组 10 104.31±30.09** 3.57±2.37**
表2 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠脑组织SOD活性的影响[(±s),n=10]
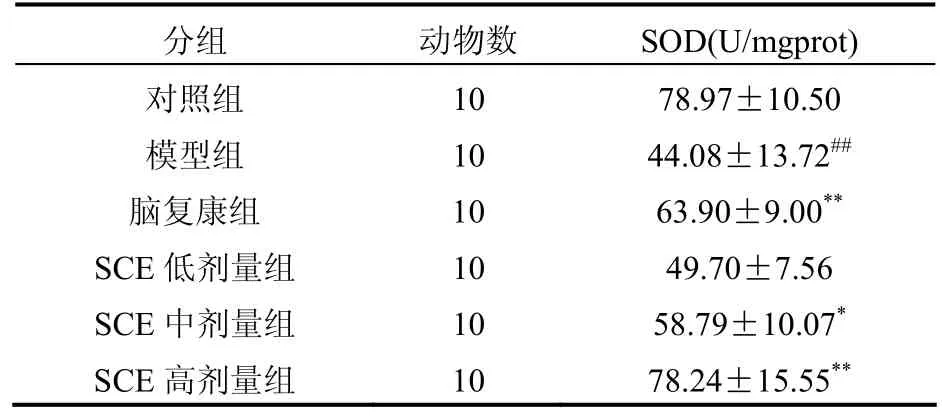
表2 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠脑组织SOD活性的影响[(±s),n=10]
注:与对照组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
分组 动物数 SOD(U/mgprot)对照组 10 78.97±10.50模型组 10 44.08±13.72##脑复康组 10 63.90±9.00**SCE低剂量组 10 49.70±7.56 SCE中剂量组 10 58.79±10.07*SCE高剂量组 10 78.24±15.55**
表3 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠脑组织MDA含量的影响[(±s),n=10]
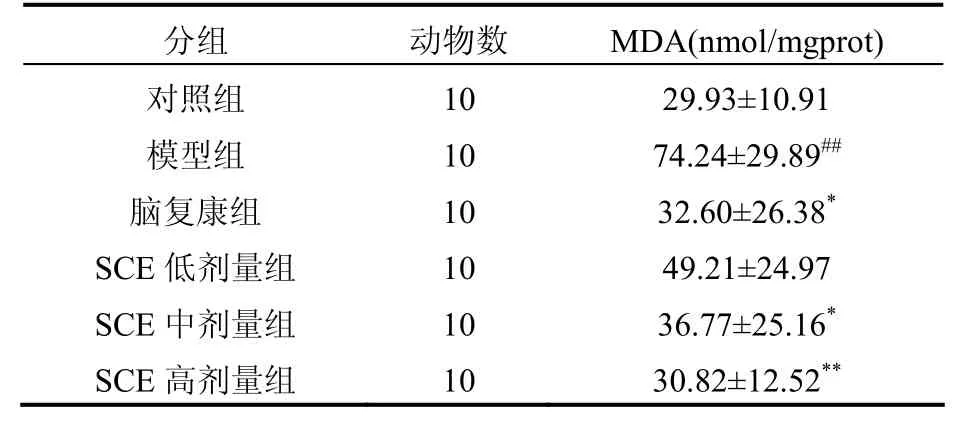
表3 SCE对亚硝酸钠所致记忆巩固障碍模型小鼠脑组织MDA含量的影响[(±s),n=10]
注:与对照组比较#P<0.05,##P<0.01;与模型组比较*P<0.05,**P<0.01
分组 动物数 MDA(nmol/mgprot)对照组 10 29.93±10.91模型组 10 74.24±29.89##脑复康组 10 32.60±26.38*SCE低剂量组 10 49.21±24.97 SCE中剂量组 10 36.77±25.16*SCE高剂量组 10 30.82±12.52**
[1]赵丽波,付宏娟,张健莉.阿尔茨海默病发生机制的研究进展[J].中国老年学杂志,2011,31(24):4997-4998.
[2]林途春,闰也.阿尔茨海默病发病机制研究的现状与进展[J].辽宁医学院学报,2009,30(6):558-560.
[3]邹宇晓,廖森泰,吴娱明,等.金针菇多糖提取物对记忆障碍模型大鼠、小鼠学习记忆能力的影响[J].中国食品学报,2010,10(1):26-29.
[4]罗建,王晔,程薇波.磷脂酰胆碱对小鼠记忆障碍模型的影响[J].现代预防医学,2011,38(3):446-448.
[5]林玉坤,曾园山,屈泽强,等.氧化应激与阿尔茨海默病[J].解剖学研究,2009,31(1):67-70.

