针刺对哮喘大鼠肺组织pan-Ras/c-fos蛋白表达的影响*
崔建美,杨晓溪,刘慧娟,孙 娜,喇孝瑾,王洪彬
(河北联合大学中医学院,河北 唐山 063000)
1 引言
在以往的针刺抗哮喘机理研究中,我们采用蛋白质组学技术,从大鼠肺组织中找到一种针刺抗哮喘的差异表达蛋白,即 Ras抑制蛋白1。该蛋白仅存在哮喘模型组,经针刺处理后该蛋白消失。目前Ras抑制蛋白1的体内功能并不清楚。为进一步明确针刺与Ras依赖型的丝裂素活化蛋白激酶(Ras-MAPK)信号传导通路的关系及对其影响,本研究采用免疫组化等方法检测Ras-MAPK信号传导通路中主要蛋白pan-Ras及c-fos的表达,从而进一步探讨针刺对哮喘的治疗及作用机制。
2 材料与方法
2.1 实验动物
SPF级雄性SD大鼠30只,体质量117±8.03g,购于天津市山川红实验动物科技有限公司(许可证号SCXK(津)2009-0001)。动物饲养在河北联合大学实验动物中心屏障环境动物实验设施[SYXK(冀)2010-0038],环境温度 20℃~25℃,湿度 60%~70%,通风良好。实验动物的使用采取“3R”原则,给予人道关怀。大鼠饲料购于北京华阜康生物科技股份有限公司(许可证号 SCXK(京)2009-0008),动物饮水采用超滤系统处理的无菌水。
2.2 主要试剂和仪器
OVA(美国 Sigma A5378),Al(OH)3凝胶(天津欧博凯化工有限公司,批号20110711),兔抗大鼠pan-Ras多克隆抗体(Santa Cruz),兔抗大鼠c-fos多克隆抗体(Biolegend),超敏 SP试剂盒(Kit-9710,福州迈新生物公司),DAB(Kit-0031,福州迈新生物公司);切片机(德国莱卡,型号RM2235),光学显微镜(奥林巴斯,型号 BX51),Image pro plus6.0(美国Media Cybernetics)。
2.3 方法
2.3.1 实验分组 30只SD大鼠适应性喂养1周后随机分为3组,每组10只。分别为空白组:未给予任何处理;哮喘模型组:复制哮喘模型,无针刺处理;哮喘模型针刺组:自造模之日起按照下述针刺干预方法处理。
2.3.2 动物模型制备 哮喘模型组及哮喘模型针刺组SD大鼠分别一次性腹腔注射含OVA1mg和Al(OH)310mg的生理盐水1ml,2周后颈外静脉内注射 OVA(15mg/kg),激发哮喘发作[1]。
2.3.3 针刺干预 取穴:取大椎、肺俞(双)、风门(双)[1],依照6版《实验针灸学》“大鼠常用穴位定位方法”定位。大椎:第7颈椎与第1胸椎间,背部正中。肺俞:第3胸椎下两旁肋间。风门:第2胸椎下两旁肋间。
针刺方法:平补平泻,每次留针20 min,每隔5 min行针1次(以200次/min捻转速度,捻针20次为行针1次),隔日针刺1次,共7次。
2.3.4 切片制备 哮喘模型组及哮喘模型针刺组用10%的水合氯醛按3.5ml/kg腹腔注射麻醉。结扎大鼠右肺中叶,右心室头皮针插管并剪开左心耳,以无菌生理盐水进行肺循环灌注至双肺呈苍白色。整体取出心肺和气管,清除心脏、气管、大血管和肺门周围结缔组织,剥离肺用生理盐水漂洗干净,吸水纸试干。剪出结扎的右肺中叶,4%甲醛固定,24h后石蜡包埋。
2.3.5 肺组织病理学观察 各组大鼠肺组织石蜡切片分别行苏木素伊红(HE)染色,显微镜下观察气道、肺组织病理学改变。
2.3.6 肺组织pan-Ras及c-fos蛋白表达的检测 免疫组织化学染色采用SABC法,实验操作按S-P试剂盒说明书进行并略加修正。其步骤如下:(1)石蜡切片常规脱蜡至水,PBS洗3×5min;(2)高压修复抗原,修复液枸橼酸盐(自制),待喷气1.5min后冷水冷却,PBS洗3×5min;(3)滴加内源性过氧化酶阻断剂(S-P试剂盒A试剂)室温下孵育10min,以阻断内源性过氧化物酶活性。PBS洗3×5min;(4)滴加非免疫性羊血清(S-P试剂盒 B试剂),室温下孵育20min,以减少非特异性背景,无需冲洗,倒去多余血清;(5)滴加第一抗体(兔抗大鼠pan-Ras多克隆抗体,工作浓度1∶100;或兔抗大鼠c-fos多克隆抗体,工作浓度 1∶100),置湿盒内 4℃冰箱过夜。PBS洗3×5min;(6)滴加生物素标记的羊抗兔IgG(S-P试剂盒C试剂,工作浓度1∶500)置湿盒内,37℃恒温箱孵育30min。PBS洗3×5min;(7)滴加过氧化物酶标记的链霉素亲和素(S-P试剂盒D试剂,工作浓度 1∶500),室温下孵育 30min。PBS洗3×5min;(8)切片DAB显色5min,流水充分冲洗;(9)苏木素复染1min,分化、返蓝;(10)梯度酒精脱水,二甲苯透明,中性树胶封固、光镜观察。阴性对照采用PBS代替一抗,其余步骤相同。
2.3.7 免疫组织化学结果判断 细胞染色呈棕黄色为阳性细胞。根据免疫组织化学结果判断标准定性处理[2],阴性(-):阳性细胞数≤5%;阳性(+):阳性细胞数>5%。以大鼠肺组织细胞胞浆胞核染色强度高于背景非特异染色并5%以上为阳性。细胞不着色与背景一致为阴性。
半定量处理,运用OLYMPUS BX51型显微镜系统进行图像采集,用Image pro plus6.0(美国 Media Cybernetics公司)医学图像分析软件,测定 pan-Ras及c-fos蛋白阳性表达的平均光密度(average optical density,AOD)。AOD=累计光密度(IOD)/(图像面积-组织空白区面积)。每张切片随机选择5个高倍镜视野(×400),计算其 AOD的均值,作为该切片的代表值,反应其阳性表达的强度。
2.4 统计学处理
3 结果
3.1 各组大鼠肺组织病理变化
石蜡切片HE染色镜下观察示,空白组大鼠仅偶见极少量炎性细胞,但未见嗜酸性粒细胞,支气管、肺组织结构正常。哮喘模型组大鼠气道周围有嗜酸性粒细胞、淋巴细胞等多种炎症细胞的浸润和聚集,可见支气管平滑肌痉挛、管腔狭窄及气道黏膜下组织水肿等病理改变。针刺组大鼠气道周围仍有炎性细胞浸润,但与模型组比较则明显减轻;气管平滑肌痉挛,管腔狭窄有不同程度的好转(图1)。
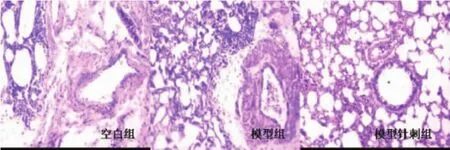
图1 各组大鼠肺组织病理学变化(HE×400)
3.2 各组大鼠肺组织免疫组化染色结果
3.2.1 各组免疫组化结果 免疫组化染色结果显示,pan-Ras阳性表达呈棕黄色,主要位于细胞浆中。pan-Ras在空白组偶见,阳性表达(阳性细胞数>5%);哮喘模型组表达增加,可见大量阳性反应细胞,主要分布在气管黏膜部位(阳性细胞数>5%);针刺组阳性细胞表达较哮喘模型组明显减少,但仍较空白组显著,呈阳性表达(阳性细胞数>5%)。c-fos细胞核染色呈蓝色,阳性表达呈棕黄色颗粒样。空白组和针刺组表达很少,呈阴性表达(阳性细胞数≤5%)。哮喘模型组表达良好,呈阳性表达(阳性细胞数>5%)(图2、3)。
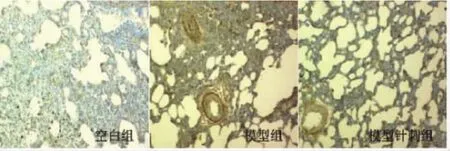
图2 pan-Ras大鼠肺组织中的表达(免疫组化×400)
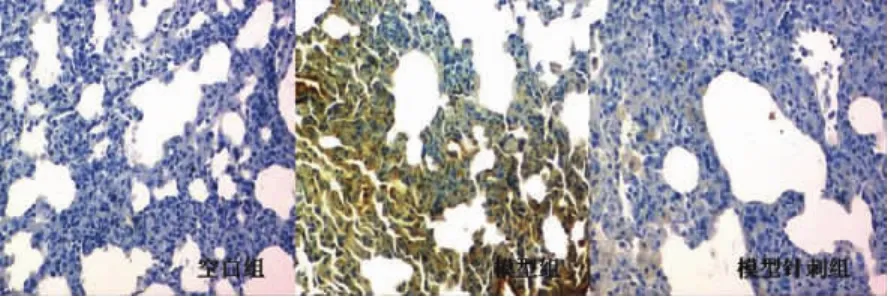
图3 c-fos大鼠肺组织中的表达(免疫组化×400)
3.2.2 各组大鼠肺组织 pan-Ras及c-fos蛋白阳性表达的AOD值 表1显示,pan-Ras阳性表达AOD值比较,哮喘模型组明显高于空白组(F=0.022,P=0.000<0.05);针刺组亦高于空白组(F=0.013,P=0.008<0.05);且针刺组阳性表达强度值低于哮喘模型组(F=0.009,P=0.046<0.05),差异均具有统计学意义。c-fos阳性表达AOD值比较,哮喘模型组高于空白组及针刺组(F=0.007,P=0.000;F=0.005,P=0.002 < 0.05),差异具有统计学意义;针刺组与空白组比较,其阳性表达值虽高于空白组,但二者差异不具有统计学意义(F=0.002,P=0.169 >0.05)。
表1 各组大鼠肺组织pan-Ras及c-fos蛋白阳性表达AOD值的比较(±s)

表1 各组大鼠肺组织pan-Ras及c-fos蛋白阳性表达AOD值的比较(±s)
注:与空白组比较:△P<0.05;与哮喘模型组比较:▲P<0.05
组别 例数pan-Ras c-fos空 白 组10 0.022 8±0.006 6 0.004 9±0.003 5哮 喘 模 型 组 10 0.044 8±0.013 9△ 0.011 3±0.003 6△哮喘模型针刺组 10 0.035 5±0.007 8△▲ 0.006 1±0.004 7▲
4 讨论
Ras-MAPK通路是目前为止研究得最为透彻的一条,其信号传导过程一般包括细胞外信号/酪氨酸蛋白激酶受体(RPTK/RTK)/Ras/Raf/MAPKK(MEK1/2)/MAPK/c-fos。整个 Ras-MAPK信号通路在胚胎的发育,细胞的分化、增殖、凋亡等生物学过程中具有重要的调节作用[3]。Ras蛋白是这一通路的分子开关,在细胞增殖分化信号从激活的跨膜受体传递到下游蛋白激酶的过程中起重要作用[4]。其过度表达能促使这一过程转化。有文献报道,哮喘豚鼠的Ras蛋白表达量明显高于正常对照组,提示与哮喘气道重塑有着密切联系[5]。c-fos原癌基因位于人类常染色基因 14q24.3-q31上,是 Ras-MAPK信号传导下游核心元件ERK的底物之一。其蛋白产物与c-jun蛋白组成稳定的异二聚体活性蛋白-1(AP-1),属于转录因子,后者可与 DNA分子特异顺序AP-1位点结合来调控靶基因的转录表达。c-fos在多数正常细胞中显有表达,但它可受多种炎症介质、炎症细胞和细胞因子激活,激活后可参与哮喘的病理过程。转化生长因子、血小板衍化生长因子可通过肌醇脂质信使系统作用以及通过酪氨酸蛋白激酶活化 MAPK,促进 c-fos表达,从而刺激气道平滑肌的增生[6]。此外,c-fos表达增高还能调节炎症反应,阻断糖皮质激素及其受体对某些基因转录的诱导,进一步加重哮喘的发生[7]。
本实验结果显示,哮喘模型组HE染色镜下观察,炎症病理改变明显;经针刺干预后,炎症反应明显减轻,但仍未达到正常组水平。哮喘模型组肺组织中,与Ras-MAPK信号传导通路密切相关的pan-Ras、c-fos蛋白表达显著增强(P<0.05);针刺后pan-Ras、c-fos蛋白表达降低(P<0.05),c-fos蛋白表达降低至与正常组差异无统计学意义(P>0.05)。以上说明,针刺具有良好的抗炎作用,能有效缓解大鼠哮喘发作,其治疗作用可能与抑制Ras-MAPK途径的激活有关。细胞外针刺刺激,能明显抑制Ras-MAPK信号传导通路上主要蛋白pan-Ras、c-fos的表达,进而抑制 Ras-MAPK途径的激活,发挥抑制气道平滑肌细胞增殖、降低炎症反应的作用。至于针刺与Ras-MAPK途径上游跨膜受体之间的关系,它通过影响何种配体来与膜受体结合,进一步调控Ras-MAPK信号传导通路发挥作用,它与该途径下游其他分子之间的关系等问题,仍需进一步研究证实。
[1]崔龙苹,杨永清,陈汗平,等.针刺对过敏性哮喘大鼠的影响[J].上海针灸杂志,1999,18(3):35-37.
[2]沈丹华,廖晓耘,刘艳丽,等.胎盘部位结节的临床病理分析[J].中华病理学杂志,2004,33(5):441-444.
[3]Matzke M,Matzke AJ,Kooter J M.RNA:guiding gene silencing[J].Science,2001,293(5532):1080-1083.
[4]MasuelliL,CutlerML. Increased Expression ofthe Ras Suppressor Rsu-1 Enhances Erk-2 Activation and Inhibits Jun Kinase Activation[J].Molecular and cellular biology,1996,16(10):5466-5476.
[5]Carlo P,Gabriele D, Antonietta R, et al. ERK-mediated regulation of leukotriene biosynthesis by androgens:A molecular basis for gender differences in inflammation and asthma[J].PNA,2008,105(50):19881-19886.
[6]Takahashi E,Onda K,Hirano T,et al.Expression of c-fos,rather than c-jun or glucocorticoid-receptor mRNA,correlates with decreased glucocorticoid response ofperipheralblood mononuclear cells in asthma[J].Int Immunopharmacol,2002,2(10):1419-1427.
[7]陈如华,吉爱斌,王玢.川芎嗪对哮喘大鼠肺组织 c-fos表达的影响[J].南通大学学报(医学版),2005,25(6):402-404.

