两株副猪嗜血杆菌的分离鉴定及药敏试验
乔荣岑,王生富,2,孙进忠,张许科,廖永洪,2,白朝勇,2*
(1.普莱柯生物工程股份有限公司,河南洛阳 471000;2.国家兽药工程技术研究中心生物制品研究所,河南洛阳 471000)
副猪嗜血杆菌(Haemophilus parasuis,Hps)属于巴斯德菌科嗜血杆菌属,是引起猪格拉泽氏病(Glasser’s disease)的病原菌[1]。该病常见于 5 ~8周龄的猪,发病率一般在50% ~70%,死亡率可达到10%以上[2]。主要引起猪的纤维素性多发性浆膜炎和关节炎,急性型可引起败血症,在不出现典型的浆膜炎时就呈现发绀,皮下水肿和肺水肿,甚至死亡,急性感染后可能留下后遗症,如公猪跛行[3]。近年来,副猪嗜血杆菌在我国各猪场引起多发性浆膜炎和关节炎的报道越来越多,在卫生条件和管理水平均较好的猪场该病的发病率和死亡率也逐渐显著增多,给养猪业带来巨大的损失。本研究从2008~2009年河南省发生猪浆膜炎和关节炎的猪场采集58份病料中分离到2株革兰氏阴性细小杆菌,进行了一系列鉴定,并对分离株进行了药敏分析。
1 材料与方法
1.1 材料
1.1.1 病料 2008年3月至2009年10月,从河南省不同地区发生猪关节炎和浆膜炎的20家猪场共采集病猪肺脏55份、关节液3份,共58份病料。
1.1.2 主要试剂 革兰氏染色液,北京索来宝公司;微量生化鉴定管和药敏试纸,杭州天和微生物试剂有限公司;辅酶 NAD,上海生工;dNTP、PCR buffer、rTaq DNA 聚合酶、DNAMarker DL 2000、pMD18-T载体(批号:B6805B)、DNA胶回收试剂盒(批号:1208250006),宝生物工程(大连)有限公司;胰蛋白大豆琼脂(TSA)、胰蛋白大豆肉汤(TSB),Difco公司;优级胎牛血清,浙江天杭生物科技有限公司。
1.1.3 标准分型血清 武汉科前动物生物制品有限责任公司(批号:0902001)。
1.2 方法
1.2.1 细菌分离培养 无菌采集病猪肺组织、关节液用接种环接种于含10%血清和1μg/mL NAD的TSA平板上,37℃条件下含5%CO2培养箱中恒温培养24 h,挑取疑似菌落进行革兰氏染色镜检。
1.2.2 V因子依赖试验 参照文献[4],将可疑菌落分别接种于含NAD及不含NAD的2种TSA平板上,于37℃培养24 h后观察TSA平板上是否有菌落长出。
将含有10%脱脂绵羊血的TSA平板上,划线接种金黄色葡萄球菌,再垂直于金黄色葡萄球菌划线接种上述分离纯化的可疑菌,在37℃条件下含5%CO2培养箱中恒温培养24 h,观察是否有“卫星现象”和溶血发生。
1.2.3 生化鉴定 取纯培养菌落接种于脲酶、氧化酶、接触酶、硝酸盐还原、吲哚、葡萄糖、蔗糖、果糖、半乳糖、核糖和麦芽糖等微量生化鉴定管,按说明书操作并观察结果。
1.2.4 PCR鉴定 参照文献[5]设计三条引物,由invitrogen(上海)贸易有限公司合成:
HP1F3:5’-TATCGRGAGATGAAAGAC-3’
HP2F2:5’-GTAATGTCTAAGGACTAG -3’
HPRevx:5’-CCTCGCGGCTTCGTC -3’;特异性扩增Hps部分16S rRNA基因,预计扩增片段大小为1090 bp。
1.2.4.1 基因组DNA的提取 挑取单菌落于含50μL双蒸水中混匀,水浴煮沸5 min,冰上放置5 min,10000 r/m离心2 min取上清作为模板。
1.2.4.2 16sRNA的 PCR扩增 PCR反应体系:10 ×Buffer 2.5 μL,dNTP 2.0 μL,MgCL2 1.5 μL,Taq 0.1 μL,模板 2 μL,引物(上、下游)各0.8 μL,加无菌水至总体积为25μL。PCR反应程序:94℃预变性5 min,94℃变性1 min,60℃退火40 s,72℃延伸50 s,30个循环,72℃延伸10 min。PCR产物电泳检测后4℃保存。
1.2.4.3 测序 用DNA柱回收试剂盒将PCR产物割胶回收,将其克隆入pMD-18T载体,进行蓝白斑筛选,将鉴定为阳性的转化子送往invitrogen公司测序。
1.2.5 血清学分型 用 KieLetein-Rapp-Gabriedson(KRG)琼脂扩散法[6]进行血清分型,其中中间孔加入标准阳性血清,周边孔分别加入标准菌株热稳定抗原、待检菌株热稳定抗原和PBS液,热稳定抗原参照文献[7]制备。
1.2.6 药敏试验 挑取分离菌株,于含NAD鲜血琼脂平板或TSA平板均匀划线,用无菌镊子将药敏纸片平贴于培养基表面,37℃培养24 h后测量抑菌圈直径。按照美国临床实验室标准委员会(CLSI/NCCLS)2006 版执行标准判定结果[8-9]。
1.2.7 Balb/c小鼠致死性试验 将分离菌划线接种于TSA培养基,37℃培养24 h,用生理盐水洗脱并分别稀释至1×1010CFU/mL、1×109CFU/mL和1 ×108CFU/mL,每只经腹腔注射0.2 mL,每个分离株每个稀释度接种5只Balb/c小鼠,同时另设5只经腹腔各注射相同量的生理盐水作对照。接种后观察精神状态及死亡情况,连续观察10 d,剖检Balb/c小鼠,无菌取其肺脏、心脏血液分离细菌。
2 结果
2.1 组织病料分离培养 采集的病料无菌条件下接种于含辅酶Ⅰ(NAD)和小牛血清的TSA平板,37℃条件下含5%CO2培养箱中恒温培养24 h,有针尖大小,约1~2 mm左右,半透亮,表面光滑的菌落长出。挑取单菌落进行革兰氏染色,有2株为革兰氏阴性短小杆菌,有2株为革兰氏阴性球杆菌。
2.2 纯化培养 挑取革兰氏染色为阴性小杆菌的2株疑似菌落,转接入新的TSA平板上,37℃条件下含5%CO2培养箱中进行了纯培养,36 h后有单菌落长出,平板上菌落形态单一。
2.3 V因子依赖试验和“卫星现象” 2株可疑菌株均在含NAD的TSA平板上生长,在不含NAD的TSA平板上无菌落生长。
将可疑菌株在绵羊鲜血琼脂平板上与金黄色葡萄球菌交叉划线,结果37℃培养36 h后在金黄色葡萄球菌线两侧有针尖大小、圆形、边缘整齐的菌落生长,越靠近葡萄球菌的周围其生长越好,远离葡萄球菌的地方菌落较小,呈现出明显的“卫星现象”,且无溶血产生(见图1、图2),因此命名2株菌分别为HeN1株和HeN2株。
图1 HeN1株 "卫星现象",且无溶血

图2 HeN2株"卫星现象",且无溶血
2.4 生化鉴定结果 分离菌株生化试验鉴定结果为脲酶试验阴性,氧化酶试验阴性,接触酶试验阳性,硝酸盐还原试验阳性,吲哚试验阴性,并发酵葡萄糖、蔗糖、果糖、核糖和麦芽糖等碳水化合物,符合副猪嗜血杆菌的生化特性(见表1)。
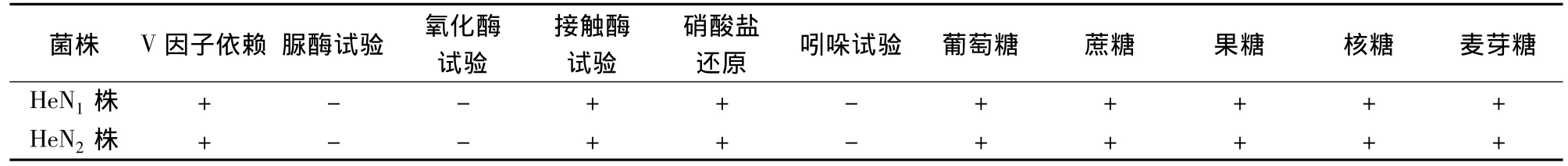
表1 V因子依赖性和生化鉴定结果
2.5 PCR 结果
2.5.1 根据设计的副猪嗜血杆菌16sRNA引物进行了PCR鉴定,扩增结果经过琼脂糖凝胶电泳,出现约为1090 bp的目的条带,见图3。
2.5.2 测序结果 将测序的结果与GenBank上发表的 M75065进行了比对,发现 HeN1(测序号PT5A)和HeN2(测序号PT4A)与M75065的同源性分别为96.2%和96.0%,而与M75066的同源性均达98.0%,可以确定分离的菌株为副猪嗜血杆菌(同源性见图4、进化树见图5)。
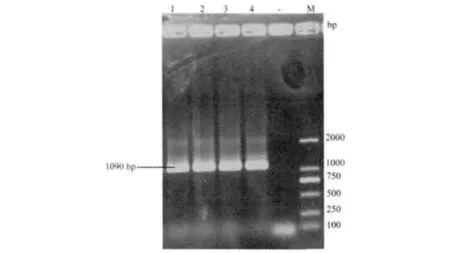
图3 HeN1株和HeN2株的PCR鉴定结果

2.6 血清学分型结果 根据琼脂扩散血清学分型结果表明,HeN1株和HeN2株抗原孔均和副猪嗜血杆菌血清4型标准阳性血清孔之间出现沉淀线,其它孔之间均未出现沉淀线,因此 HeN1株和HeN2株均为副猪嗜血杆菌血清4型菌株。
2.7 药敏试验结果 药敏试验结果表明,两株分离株都对头孢噻肟、头孢噻吩、替米考星高敏,对四环素、丁胺卡那、恩诺沙星、环丙沙星中敏,对甲氧苄氨嘧啶、复方新诺明、链霉素、阿莫西林、新霉素均耐药(表2)。
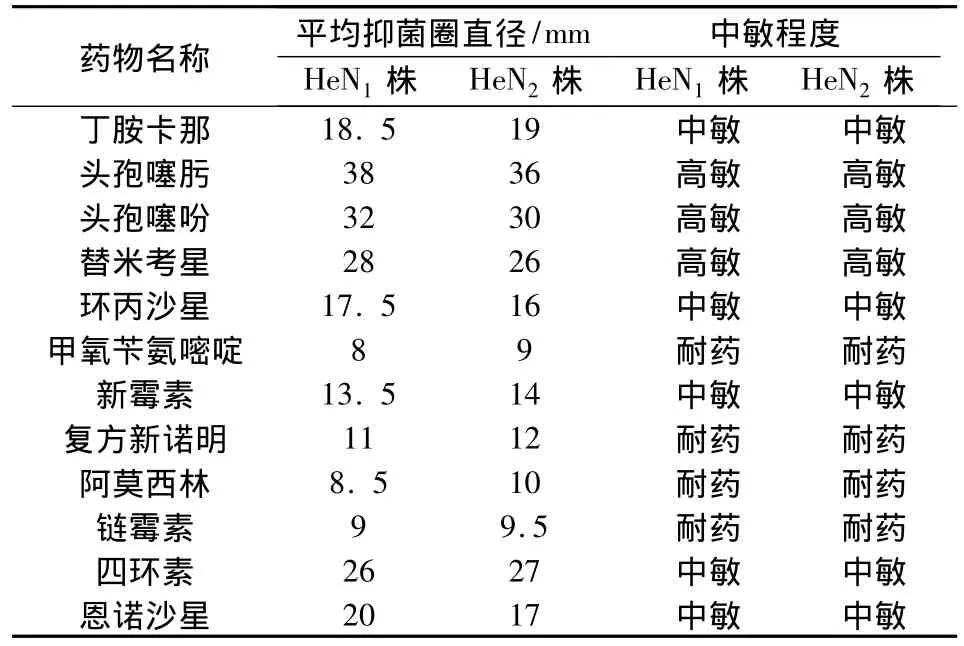
表2 药敏试验结果
2.8 致病性试验结果 分离菌株菌液感染的Balb/c小鼠在12 h后出现死亡,在24~72 h内呈现死亡高峰,对照组全部健活(表3)。取死亡Balb/c小鼠的肺脏、心脏血液划线接种含NAD的TSA培养基进行分离鉴定,从发病死亡的小鼠肺心中再次分离菌株与攻毒菌株一致,均为副猪嗜血杆菌。分离的HeN1株和HeN2株以2×109CFU/只的攻毒剂量可致80% ~100%小鼠死亡,表明分离的菌株对小鼠有较强的毒力。
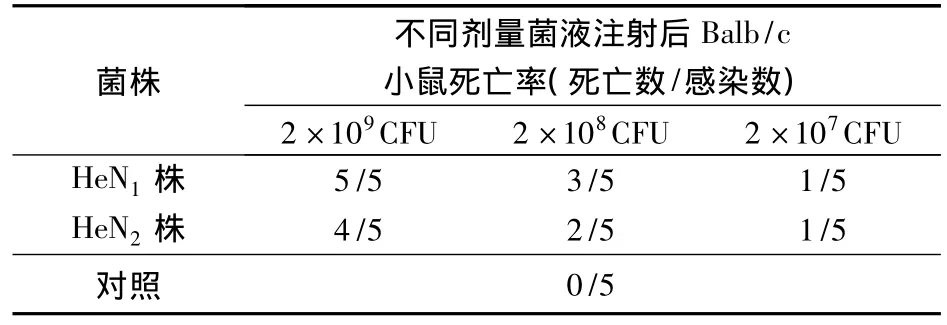
表3 不同剂量菌液注射Balb/c小鼠后死亡结果
2 讨论
副猪嗜血杆菌病与猪的链球菌病、支原体肺炎、传染性胸膜肺炎等临床上很容易将它们混淆[10]。副猪嗜血杆菌对生长条件要求比较苛刻,分离鉴定存在耗时长、分离率低等缺点,本文用分离细菌常用的菌落形态、生长特性、染色镜检、生化鉴定等方法结合16S rRNA的PCR检测。根据Ø ysten A等建立的复合PCR检测方法,设计了3条引物,扩增到1090 bp左右的片段,该PCR方法具有高度的种特异性,能够将副猪嗜血杆菌与吲哚放线杆菌[5]、猪放线杆菌相区别[11],在分离培养过程中结合16S rRNA的PCR检测法,排除了2株革兰氏阴性球杆菌,大大提高了分离效率。同时所建立的PCR检测方法不仅可从分离培养物中对进行鉴定,而且可以直接对病料进行PCR检测,因此,可以应用于临床诊断中。
我国的副猪嗜血杆菌病流行病学调查显示,优势血清型为血清4型、5型、12型和13型[12]。笔者从58份病料中仅分离到2株副猪嗜血杆菌,经血清学分型均为副猪嗜血杆菌血清4型,与调查结果相似,未分离到其它血清型菌株,原因可能是样品采集地区主要流行血清4型菌株,也可能是用过抗生素或者是部分病例死亡时间过长造成的。由于副猪嗜血杆菌的血清型众多,血清型之间缺乏有效的交叉保护[13],副猪嗜血杆菌又具有明显的地方特征,而疫苗的使用是预防副猪嗜血杆菌的最有效的方法之一。其防疫用疫苗在西班牙、日本、澳大利亚、加拿大和美国应用极广泛[14]。因此本文研究为今后副猪嗜血杆菌的临床诊断和疫苗的研制奠定了基础。
药敏试验结果表明,副猪嗜血杆菌分离株对头孢噻肟、头孢噻吩、替米考星高度中敏,对四环素、丁胺卡那、恩诺沙星、环丙沙星中敏,对甲氧苄氨嘧啶、复方新诺明、链霉素、阿莫西林、新霉素均耐药。给猪场在合理使用抗生素时提供了一定的参考。
[1] Oliveiar S,Pijoan C.Haemophilus parasuis:new ternds on diagnosis,epidemiology and contorl[J].Veterinary Microbiology,2004,99:11-12.
[2] Turni C,Blackall P.J.Comparison of sampling sites and detection methods for Haemophilus parasuis[J].Australian Veterinary Journal,2007(5):177 -184.
[3] OliveiraS,GalinaL,BlancoI,etal.Naturally - farrowed,artificially-rearedpigsasanalternativemodelforexperimental infectionbyHaemophilusparasuis[J].CanJVetRes.2003,67(2):146-150.
[4] KielsteinP,WutheH,AngenO,etal.Phenotypicandgenetic characterizationofNAD-dependentPasteurellaceaefromthe respiratorytractofpigsandtheirpossiblepathogeneticimportance[J].VetMicrobiol,2001(81):243 -255.
[5] ysteinA,SimoneO.Developmentofanimprovedspeciesspecific PCRtestfordetectionofHaemophilusparasuis[J].VetMicrobiol.2007,119(2 -4):266 -276.
[6] RafieeM,BlackallP.J.Establishment,validationanduseofthe Kielstein-Rapp-GabrielsonSerotypingschemeforHaemophilus parasuis.AustralianVetrinaryJournal,2000,78(3):172 -174.
[7] KielsteinP,Rapp - GabrielsonVJ.Designationof15serovarsof Haemophilusparasuisonthebasisofimmunodiffusionusing heat- stableantigenextracts[J].JClinMicrobiol.1992,30(4):862-865.
[8] 孙长贵译.抗微生物药物敏感性试验执行标准[S].第十六版信息增刊.CLSI文件 M100-S16(ISBN1-56238-556-7).CLSI,940WestValleyRoad,Suite1400,Wayne,Pennsylvania 19087 -1898USA,2006.
[9] 倪语星,洪秀华.细菌耐药性监测抗感染治疗[M].2002.
[10]钟登科,魏建超.副猪嗜血杆菌病实验室诊断方法研究进展[J].中国兽医杂志,2009,11:41 -43.
[11]米丰泉,陈小玲,王翠敏,等.猪的胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌复合PCR检测方法的建立[J].动物医学进展,2005,26(5):85 -88.
[12]蔡旭旺.副猪嗜血杆菌的分离鉴定及诊断方法与灭活疫苗的研究[D].华中农业大学博士论文,2006.
[13] BarbarE.Straw.猪病学第九版[M].2008,769 -782.
[14] MorikoshiT,KobayashiK,KaminoT,etal.Characterizationof HaemophilusparasuisisolatedinJapan[J].NipponJuigaku Zasshi,1990,52(3):667 -669.

