慢性阻塞性肺疾病合并2型糖尿病患者凝血、纤溶功能的变化
林武洲,李浪波,陈梅唏,刘晓黎
(桂林医学院附属医院 呼吸内科,广西 桂林541001)
慢性阻塞性肺疾病(COPD)患病率和死亡率高,已成为一个重要的公共卫生问题,越来越受到重视。有研究发现,糖尿病可增加血液凝血状态的异常和血栓的形成,可加速COPD进展[1],血浆D-二聚体(D-D)是纤维蛋白特异性降解产物,是反映体内纤溶功能和高凝状态的标志之一[2]。纤维蛋白原(FIB)的浓度可以反映体内血栓前状态。本文探讨COPD合并2型糖尿病(T2DM)患者在有无并发症状态下血浆D-D、FIB水平,以进一步探讨其临床意义。
1 对象与方法
1.1 对象及分组
来源于2010年8月至2011年8月本院住院符合COPD诊断标准[3]稳定期患者90例。单纯COPD组30例,男18例,女12例,平均年龄(66.23±9.63)岁。COPD合并T2DM组60例,符合1999年世界卫生组织(WHO)2型糖尿病诊断标准,根据COPD合并2DM组患者有无微血管病变(眼底、肾脏)及神经系统病变再分为无并发症组30例,男17例,女13例,平均年龄(67.03±8.42)岁,有并发症组30例,男19例,女11例,平均年龄(69.47±5.58)岁。通过眼底镜检查证实视网膜病变,Ⅰ期:微血管瘤、出血;Ⅱ期:微血管瘤、出血并有硬性渗出;Ⅲ期:出现棉絮状软性渗出;Ⅳ期:新生血管形成、玻璃体出血;Ⅴ期:机化物增生;Ⅵ期:继发性视网膜脱离、失明。糖尿病肾病患者24h尿蛋白>0.5g,血清尿素氨(Bum)>7.14mmol/L,血清肌肝(Cr)>115μmol/L,并除外酮症酸中毒、运动、泌尿系感染及其它肾病的影响。糖尿病周围神经病变有明显手足麻木、疼痛、感觉异常、肌萎缩,并除外酒精中毒、泌尿系感染、创伤、肿瘤等其它影响因素。各组间年龄及性别差异无统计学意义(P>0.05)。采血一周前均未用过抗凝血、抗血小板、抗纤溶药物。
1.2 方法
1.2.1 资料采集 清晨采集受试者空腹静脉血1.8ml,沿试管壁缓慢注入装有3.18%枸橼酸钠0.2ml的试管中,分离血浆。肺功能检测:采用美国PDS公司KOKO台式肺功能仪检测,用台式水银柱血压计测病人右上肢卧位血压。
1.2.2 检 测 方 法 D-D、FIB 用 日 本 Sysmex CA6000血浆仪检测,试剂由德国Dade behring Marburg GMBH生产,按使用说明操作。
1.3 统计学分析
采用SPSS17.0统计软件进行分析,所有计量资料均用“均数±标准差”来表示,各组数据均行正态性检验,非正态分布数据予对数转换为正态分布。各组间各指标比较用t检验及方差分析,率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
组间基本资料比较可见各组研究对象间年龄、性别、血压差异无统计学意义(P>0.05);组间DD、FIB结果比较:无并发症组的D-D、FIB与单纯COPD的比较差异无统计学意义(P>0.05);有并发症组与其他两组比较差异均有显著统计学意义(P<0.01),见表1。
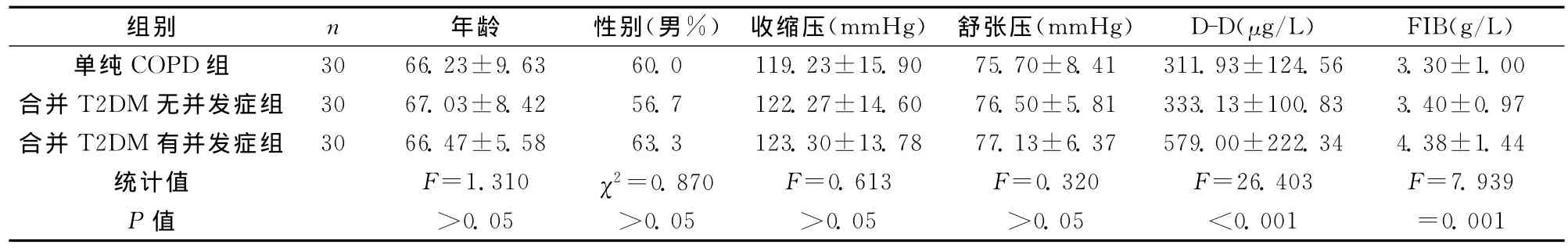
表1 各组年龄、性别、血压、D-D、FIB的比较
3 讨论
COPD发病机制复杂,受多种因素的影响,主要以气道、肺实质和肺血管的慢性炎症为特征,因肺内通气血流比例失调致慢性缺氧,可继发红细胞增多和血黏滞度增高,引起血流高黏、高聚、高凝及微血栓形成。COPD发展过程中出现的凝血纤溶功能异常及对COPD患者病程的影响,引起临床广泛关注[4,5]。
FIB(凝血因子Ⅰ)是凝血系统中的重要蛋白质,由肝细胞和巨核细胞合成分泌,是急性期蛋白,其浓度可以反映体内血栓前状态,通过以下途径参与血凝调节:①在凝血酶作用下,肽链解离,分子结构改变导致聚合反应,形成网状结构的纤维蛋白多聚体;②与血小板膜糖蛋白的Ⅱb/Ⅲa结合,介导血小板聚集反应而影响血流黏滞度。FIB升高不仅为血凝过程提供了较高水平的酶促反应底物,同时可使血液黏滞性增高,红细胞聚集性增强,血液流动性降低,进而影响血浆的循环,与血管因子一起促进血栓形成。FIB水平各项升高是血栓形成的重要危险因素[6]。
D-D是纤溶系统活化和纤维蛋白降解的分子标志,可溶性纤维蛋白单体在因子Ⅷa作用后,生成交联的纤维蛋白,再经纤溶酶作用形成特异性产物,其血浆浓度升高是继发性纤溶的特征表现[7]。
肺脏作为糖尿病损害的靶器官日益受到关注。慢性阻塞性肺疾病合并糖尿病患者,有文献报道[8]由于其高血糖所致肺血管内皮细胞结构改变,造成肺微血管通透性增加。此外,血浆及小分子蛋白漏出增加,组织蛋白的非酶糖基化可致肺结缔组织增生。血管上皮细胞损伤导致肺动脉壁、肺毛血管基底膜及肺泡上皮增厚。Boulbou等[9]实验证实高血糖水平增加黏附分子表达,这种分子在血管功能障碍的病理生理学中发挥重要作用,使得高血糖状态下肺层黏蛋白非酶糖基化作用加强,肺弥散功能受损。这些都为COPD患者因高血糖肺受累进一步加重COPD高凝状态和原发性与继发性纤溶亢进提供了依据。
从本试验结果显示,COPD合并2DM无并发症组的D-D、FIB与单纯COPD的比较差异无统计学意义(P>0.05),可能是COPD合并的是早期或较轻的DM,微血管病变轻微,有凝血激活的存在,机体尚有一定代偿能力,凝血酶产生后很快被中和,不足以引起纤维蛋白的产生及由此引发的继发纤溶。但彭德珍等报道[10]此时的COPD患者已处于高凝状态,应予重视。当COPD合并T2DM患者进展到有微血管病变时,本文显示:有并发症组D-D、FIB都明显高于单纯COPD组及无并发症组,差异有统计学意义(P<0.01);可能是由于微血管病变时进一步加重血管内皮受损和组织因子释放等,加速启动内源性凝血系统使血液黏度增高,微血栓栓塞形成、纤溶亢进等,使得患者血浆D-D、FIB高度表达。由于单独检测某一项指标受各种因素影响而不宜作为独立评估发生血管病变和血栓形成的指标[11],故综合测定凝血和纤溶指标可能对预防糖尿病并发微血管病变有一定意义,监测这些指标可作为COPD合并T2DM病情发展及观察其疗效的良好指标。
本研究结果表明:COPD合并T2DM患者伴有视网膜、肾和周围神经病变等微血管病变时,会进一步加重患者的凝血、纤溶功能紊乱,对COPD合并T2DM患者要进行合理的血糖控制,在疾病的进展过程中要注意监测相关凝血纤溶指标,必要时可给与预防性抗凝等治疗。
[1]林武洲,彭德珍,王昌明.D-二聚体、纤维蛋白原检测在慢性阻塞性肺疾病合并2型糖尿病患者中的临床意义[J].中国实验诊断学,2011,15(7):1133.
[2]胡 波,王 珂.血浆D-二聚体及FDP检测在DIC诊断中的意义[J].重庆医学,2004,33(11):1666.
[3]姚婉贞.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华内科杂志,2007,46(3):254.
[4]李立宇,王 晨,庞宝森,等.慢性阻塞性肺疾病急性期凝血纤溶系统功能变化的临床研究[J].中国实用内科杂志,2008,28(8):667.
[5]百 澎,陈东宁,陈永昌.慢性阻塞性肺疾病急性加重期C-反蛋白、D-二聚体与肺动脉高压关系探讨[J].中国现代医学杂志,2009,19(8):1204.
[6]Emst E.Fibrinogen:an important risk factor fatherothrombotic diseases[J].Ann Med,1994,26(1):15.
[7]Gualtiero P,Benilde C,Cristina L,et al.D-dimer testing to determine the duration of anticoagulation therapy[J].N Enalt Med,2006,355:1790.
[8]Walter RE,Beiser A,Givelber RJ,et al.Association between glycemic state and lung function[J].Am pespir Crit Care Med,2003,167(6):911.
[9]Boulbou MS,Gourgoulianis KI,Petinakin EA,et al.Pulmonary function and circulating adhesion molecules in patients with diabetes mellitus[J].Can Respir J,2003,10(5):259.
[10]彭德珍,林武洲,周 燕.慢性阻塞性肺疾病合并2型糖尿病患者检测D-二聚体的临床意义[J].实用医学杂志,2011,27(5):921.
[11]丁 磊,夏文权,余文红.2型糖尿病血浆tPA、PAI检测的意义和结果评价[J].血栓与止血杂志,2002,8(1):20.

