低白蛋白血症与肝硬化早期腹水的关系研究
聂 鑫,贺 勇,杨正兵,张国福,李贵星*,周汶静,胡科妍
(1.四川大学华西医院 实验医学科,四川 成都610041;2.四川大学华西医院 消化内科)
腹水(ascites)是肝硬化患者最常见的并发症,50%的肝硬化患者在10年内出现腹水[1]。肝硬化患者出现腹水预后很差,欧洲腹水治疗导则[2]中明确提出肝硬化伴腹水需要考虑肝移植,而其它的治疗方法效果均不理想。肝硬化腹水的发病机制至今尚不清楚,解释腹水发生主要有三大学说,即“充盈灌注不足学说”、“泛溢学说”和“内脏血管扩张学说”,三种学说均没有完全阐明腹水的发生机制,而血清白蛋白在腹水发生中的作用一直有争论[3,4]。本文通过对早期肝硬化腹水和无腹水患者进行对比分析,探讨低白蛋白血症与肝硬化早期腹水的关系,为预防和治疗早期腹水提供理论指导。
1 资料与方法
1.1 研究对象 为确保研究对象腹水形成处于早期阶段,纳入对象选择为我院2008年1月至2010年10月初次就诊并且未经治疗的肝硬化患者118例。肝硬化诊断依据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组推荐的诊断标准[5,6],因肝硬化或肝硬化腹水在外院治疗过或出院后再次入院的患者不纳入本研究,排除张力性腹水和自发性腹膜炎患者,并根据病史、X-线、ECG、超声心动图和实验室检查排除有原发性心脏病、原发性肾病、胸腹部肿瘤、肺结核及严重感染者。肝硬化腹水以B超检查为准,经B超检查,研究对象中有腹水患者38例(病理组),无腹水患者80例(对照组)。
1.2 研究方法 经检查和评估符合纳入标准的肝硬化患者,治疗前卧位空腹采集4管静脉血,分别为无抗凝剂管、肝素钠抗凝管、枸橼酸钠抗凝管和EDTA抗凝管,并测定患者卧位血压和心率,收集患者24小时尿液。
1.3 实验室指标分析方法 无抗凝剂管以3000r/min离心15min,血清用于肝功能([指标包括总胆红素(TB)、直接胆红素(DB)、丙氨酸氨基转移酶(ALT)、总蛋白(TP)、白蛋白(ALB)、谷氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)]、肾 功 能 [指 标 包 括 尿 素 (BU)、肌 酐(CREA)、半胱氨酸蛋白酶抑制剂C(Cys C)]、电解质[包括钠(NA)、钾(K)、氯(Cl)]分析;肝素钠抗凝管以3000r/min离心10min,血浆用于血氨(Ammon)指标分析;枸橼酸钠抗凝管经混匀后用于血液学指标[包括血红蛋白(Hb)、血小板(PLT)、白细胞(WBC)]分析;EDTA抗凝管以3000r/min离心10 min,血浆用于凝血酶原时间(PT)和纤维蛋白原(Fb)分析。4℃低温分离血清0.5ml,并迅速保存于-20℃用于一氧化氮(NO)和醛固酮(ALD)分析。肝功能、肾功能及电解质指标采用瑞士Roche Modular-P800全自动生化分析仪和配套试剂分析;NO由中国南京建成生物有限公司提供的试剂进行分析;Ammon采用美国Johnson VITROS-250干化学分析仪和配套试剂分析;PT采用日本Sysmex CA-7000全自动血凝分析仪及德国Dade Behring公司试剂分析;血液学指标采用日本Sysmex XE 2100全自动血液分析仪和配套试剂分析;ALD采用放射免疫分析方法分析。本实验室通过美国病理学家协会(CAP)实验室认可,所有分析指标均通过美国病理学家协会的能力验证(PT)。
1.4 统计学处理 采用SPSS13.0统计软件进行分析,计量资料采用均数±标准差(¯x±SD)表示,组间比较采用成组资料的t检验,计数资料分析采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 118例符合研究目的肝硬化患者,经B超检查有腹水38例,无腹水80例,肝硬化住院患者腹水发生率为32.2%。病例组和对照组其它资料见表1。
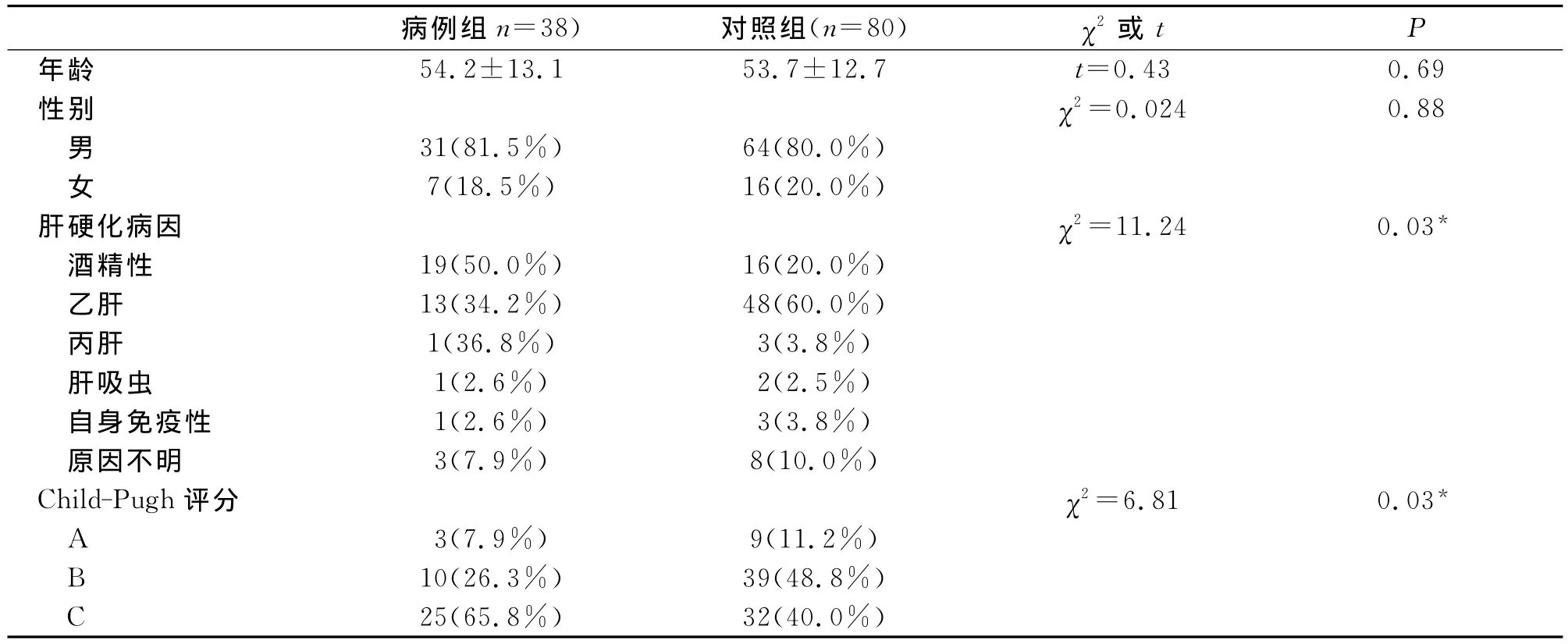
表1 病例组和对照组一般资料比较
表1结果显示:两组的年龄和性别比例没有差异(P>0.05)。肝硬化病因比较有差异(χ2=11.24,P<0.05),病例组以酒精性肝硬化为主(50.0%),而无腹水组以乙肝肝硬化为主(60.0%)。两组的child-pugh分级比较有差异(χ2=6.81,P<0.05),病例组以C级为主(65.8%),而对照组以B级为主(48.8%)。
2.2 病例组和对照组生化指标比较 按实验室标准化操作程序分析两组的生化指标,结果见表2。

表2 病例组(n=38)和对照组(n=80)生化指标结果
表2结果显示:病例组血清ALB为27.7±5.9 g/L,低于对照组的30.2±6.1g/L(t=2.201,P<0.05),ALP和 GGT结果分别为167±147U/L和131±173U/L,高于无腹水组的119±80U/L、76±93U/L(t值分别为2.092和2.074,P<0.05),其它肝功能指标、电解质、肾功能和血氨在两组间比较差异无统计学意义(P>0.05)。
2.3 病例组和对照组血液学和血凝学指标比较按实验室标准化操作程序分析两组的血液学和血凝学指标,结果见表3。

表3 病例组(n=38)和对照组(n=80)血液学和血凝学指标
表3结果显示:两组的血液学和血凝学指标比较差异均无统计学意义(P>0.05)。
2.4 病例组和对照组血液动力学指标比较 两组患者的血液动力学指标比较结果见表4。

表4 病例组(n=38)和对照组(n=80)血液动力学指标
表4结果显示:病例组24小时尿量为1185±599ml,低于对照组的1473±812ml(t=2.013,P<0.05),而血压和心率在两组间比较差异无统计学意义(P>0.05)。
2.5 病例组和对照组NO和ALD水平比较两组患者NO和ALD水平比较见表5。

表5 病例组(n=38)和对照组(n=80)NO和ALD 水平
表5结果显示:病例组ALD为18.74±14.18 ng/dl,高于对照组的10.99±7.17ng/dl(t=2.224,P<0.05),而NO在两组间比较差异无统计学意义(P>0.05)。
3 讨论
肝硬化患者有多种并发症,包括腹水、肝性脑病、消化道出血、自发性腹膜炎和肝肾综合征等[1]。肝硬化患者出现腹水是慢性肝疾病发展过程中的一个重要标志,腹水的产生表明有更多的并发症(如难治性腹水、自发性腹膜炎、肝肾综合征)随之发生,并预示患者有较差的生存率[7]。肝硬化腹水的发生机制并不完全清楚,目前关于肝硬化腹水形成机制主要有三大学说[3],即“充盈灌注不足学说”、“泛溢学说”和“内脏血管扩张学说”。即使大多数研究者均认同的“内脏血管扩张学说”也不能完全解释清楚腹水发生的机制,因此,由于机制不清楚导致腹水治疗的效果不理想,唯一有效的方法是肝移植。随着肝硬化发病率上升,探讨腹水的早期形成机制,从而有效预防和治疗腹水显得尤为重要。
在本研究中,我们选择早期肝硬化患者进行分析。肝硬化病因和肝硬化程度分析发现酒精性肝炎和乙肝病毒感染是引发肝硬化的主要因素,而酒精性肝硬化比乙肝性肝硬化更容易引起腹水产生(50.0%vs 34.2%),并且肝硬化的分级越高,其腹水发生率越高。对两组患者的实验室指标进行分析,发现病例组血清 ALB水平为27.7±5.9g/L,明显低于对照组的30.2±6.1g/L(t=2.201,P<0.05),ALP和GGT结果分别为167±147U/L和131±173U/L,高于无腹水组的119±80U/L、76±93 U/L(t值分别为2.092和2.074,P<0.05),其它肝功能指标、肾功能、血氨、电解质、血清学和血凝指标在两组间比较差异无统计学意义(P>0.05)。实验结果表明肝硬化患者由于其合成功能降低,导致ALB合成减少,从而使血液的胶体渗透压降低,在门静脉高压的协同下,内脏淋巴液产生大于吸收,导致腹水的产生。研究结果说明低白蛋白血症在肝硬化早期腹水发生过程中发挥了关键性的作用,因此,及时早期给予肝硬化患者输注白蛋白,对于阻止和治疗早期腹水可能有显著的疗效,这一点需要进一步的研究。同时,病例组ALP和GGT升高,其原因可能是病例组中酒精性肝硬化比例高于对照组的结果,因为酒精性肝炎患者一直有ALP和GGT升高的现象。另外,本研究结果发现病例组和对照组的电解质无差异(P>0.05),并且其水平均在正常参考范围之内,表明此时患者并没有电解质紊乱的表现。因此,可以认为早期腹水形成和钠水潴留没有关系。据此,我们认为英国腹水治疗导则[4]中提出的“钠水潴留导致腹水形成”的观点并不完全正确(至少在腹水形成的早期无关,可能和中期腹水形成有关),也不认同该导则中提出的肝硬化患者血清白蛋白水平和腹水形成无关的观点。
“内脏血管扩张学说”认为:肝硬化患者由于NO的产生过度引起内脏血管扩张,从而引起有效血容量的减少,心输出量降低,激活肾素-血管紧张素-醛固酮系统,同时刺激交感神经系统兴奋以及抗利尿激素释放,引起钠水潴留,在门脉高压的协同作用下,导致腹水产生[8]。本研究结果表明:两组患者血清NO水平差异无统计学意义(P>0.05),而两组的结果均在参考值范围之内(<50μmol/L),说明早期腹水患者并无NO升高的现象,结果说明肝硬化患者早期腹水形成与NO的关系并不密切。病例组ALD水平轻度升高并高于对照组(t=2.224,P<0.05),其可能的原因在于腹水产生引起有效血容量减少,激活肾素-血管紧张素-醛固酮系统,ALD升高和血钠水平无关。
两组患者的血液动力学指标结果显示:两组患者血压和心率差异均无统计学意义(P>0.05),而病例组24小时尿量为1185±599ml,低于对照组的1473±812ml(t=2.013,P<0.05),而两组的肾功能指标均正常。我们认为病例组尿量减少可能是腹水形成导致有效循环血量减少的结果,和肾功能状态无关。
通过本研究并结合国内外大量的文献,我们对肝硬化腹水的发生机制提出了“三期理论”,即腹水形成分早期、中期和晚期三个阶段。早期腹水指低白蛋白血症期,其形成机制是低白蛋白血症和门静脉高压共同作用,破坏内脏微循环的starling平衡,淋巴液产生大于吸收,形成腹水,这和Backward理论一致[9,10]。中期腹水指神经内分泌紊乱期,其发生机制是在早期腹水形成的基础上,由于腹水形成使有效血容量减少或利尿剂的不当使用加重了血容量的减少,使交感神经、心肺的容量感受器和肾小球的肾素分泌激活,抗利尿激素、醛固酮等激素释放导致水钠潴留和肾动脉收缩,从而使血容量增加,在门静脉高压的协同下,内脏血管扩张,静水压增高,NO合成增加,加重腹水的产生。中期腹水形成和“泛溢学说”[11,12]有相同之处,不同点在于我们认为水钠潴留是继发于腹水形成-血容量减少-神经内分泌紊乱的结果,水钠潴留加重了腹水的形成,而不是传统认为水钠潴留引发了腹水的产生。晚期腹水指难治性腹水期,该期患者的主要特点是难治性腹水、重度低钠血症、心功能减退和肝肾综合征,其发生机制在于中期腹水的基础上,钠水进一步潴留,而且水潴留多于钠潴留,严重的低钠血症使肾素-血管紧张素-醛固酮系统极度激活,肾动脉重度收缩,导致肝肾综合征的发生,并且肾脏在长期缺血情况下出现肾小管坏死,导致肾脏由功能性损伤转变成肾实质受损,此时的机体进入一个恶性循环状态,肾功能受损使大量的液体潴留导致心功能受损[13],心输出量减少进一步促进肝肾综合征的发生和发展,心肾衰竭共同促进腹水的发展,该期患者即使采用特利加压素加白蛋白扩容治疗,也无助于减轻腹水和肝肾综合征。
综上,我们认为:低白蛋白血症是肝硬化患者早期腹水形成的关键因素,及时给予低白蛋白血症的肝硬化患者输注白蛋白,是预防和治疗肝硬化早期腹水的重要措施。
[1]Bruce A.Runyon.AASLD practice guidelines on the management of adult patients with ascites due to cirrosis:an updat e[J].Hepatology,2009,49:2087.
[2]Ginès P,Angelin P,Lenz K,et al,EASL clinical practice guidelines on the management of ascites,spontaneous bacterial peritonitis,and hepatorenal syndrome in cirrhosis[J].Journal of Hepatology,2010,53:397.
[3]Arroyo V,Colmenero J.Ascites and hepatorenal syndrome in cirrhosis:pathophysiological basis of therapy and current management[J].Journal of Hepatology,2003,38:69.
[4]Moore K,Aithal G.Guidelines on the management of ascites in cirrhosis[J].Gut,2006,55(Suppl.VI):1.
[5]Guildlines for diagnosis and treatment of nonalcoholic fatty lives disease.Fatty Lives and Alcoholic Lives Disease Study Group of the Chinese Lives Disease Association[J].Chinese Journal of Hepatology,2006,14(3):161.
[6]Diagnostic criteria of alcoholic lives disease.Fatty Lives and Alcoholic Lives Disease Study Group of the Chinese Lives Disease Association[J].Chinese Journal of Hepatology,2003,11(2):72.
[7]Planas R,Montoliu S,Balleste B,et al.Natural history of patients hospitalized for management of cirrhotic ascites[J].Clin Gastroenterol Hepatol,2006,4:1385.
[8]A Kashani,C Landaverde,V Medici,et al.Fluid retention in cirrhosis:pathophysiology and management[J].Q J Med,2008,101:71.
[9]Atkinson M,Losowsky MS.The mechanism of ascites formation in chronic liver disease[J].Q J Med,1961,30:153.
[10]Sherlock S,Shaldon S.The aetiology and management of ascites in patients with hepatic cirrhosis:a review[J].Gut,1963,4:95.
[11]Gines P,Fernandez-Esparrach G,Arroyo V,et al.Pathogenesis of ascites in cirrhosis[J].Semin Liver Dis,1997,17:175.
[12]Schrier RW,Arroyo V,Bernardi M,et al.Peripheral vasodilation hypothesis:aproposal for the initiation of renal sodium and water retention in cirrhosis[J].Hepatology,1988,8:1151.
[13]Krag A,Bendtsen F,Henriksen JH,et al.Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites[J].Gut,2010,59:105.

