运动和营养对线粒体能量代谢的调控
冯智辉
线粒体生成、融合、裂解和自噬组成了线粒体质量控制的有效体系,适应细胞外不同的环境和细胞内不同的能量需求,线粒体的动态调控亦会随之产生不同的变化[1]。在运动条件下,肌肉细胞内Ca2+的升高,高能磷酸盐含量的降低最终激活并诱导PGC-1α的表达,其下游靶基因线粒体转录因子A(TFAM)、核呼吸因子(NRF-1,NRF-2)转录因子协同作用调控线粒体蛋白和基因组的增加,线粒体数量及功能的增加,从而促进肌肉组织和机体功能改善[2]。同时,早期的研究也发现,运动能够促进人体内氧化应激的发生[3]。这项30多年前的研究发现,在达到最大耗氧量60%的状态下持续训练60 min 后,机体内脂质过氧化产物显著增加。随后越来越多的科学家关注运动与氧化应激的产生。虽然对于运动过程中产生氧化物的来源至今仍有争议,但被广泛接受的科学观点是运动中肌肉收缩能够产生大量的ROS,并且长期的剧烈运动所产生的氧化应激能够严重损伤细胞内的蛋白和脂质[4]。氧化损伤的存在增加了肌肉疲劳和损伤,导致运动能力下降[5],更有研究指出剧烈运动产生的肌肉损伤会显著降低肌肉葡萄糖的摄取,增加胰岛素抵抗的风险[6]。
线粒体是细胞内消耗氧气,发生氧化磷酸化的主要细胞器,有2%~5%的氧气在此过程中直接和电子反应,从而形成超氧自由基[7]。在运动肌肉中线粒体也同样是ROS的主要来源之一[8]。最近的研究发现NADPH氧化酶[9]、黄嘌呤氧化酶[10,11]的活化也能够促进肌肉运动ROS的产生。线粒体作为ROS的主要来源,同时也是ROS攻击的主要靶点。线粒体蛋白和脂质的氧化损伤会进一步加剧线粒体功能的失调,因而快速清除损伤的线粒体对于维持组织内线粒体功能的正常发挥至关重要。近年来的研究提示线粒体融合、裂解以及自噬的发生便是维持其自身功能的重要过程[12]。另一方面,从根本上降低ROS的产生也是维护线粒体的有效途径。Reid和他的同事们曾提出一个模型,该模型指出在肌肉中存在稳定的氧化还原平衡,机体自身的抗氧化体系能够抵抗正常ROS的产生,由此而生的适量的氧化物存在能够最大化发挥肌肉的收缩力,然而过量ROS产生的氧化物则会引起肌肉张力的下降[13]。这一模型得到众多研究者的支持。剧烈运动所产生的ROS能够降低机体内抗氧化剂如维生素E、谷胱甘肽等的含量,这有可能加剧氧化应激和肌肉损伤,因此对于经常运动的个体,适当补充抗氧化剂被认为是一种必要的措施[14]。已有研究指出,运动过程中补充维生素E这一天然抗氧化剂能够有效保护运动引起的肌肉损伤[15],同时在运动中使用自由基清除剂-N-乙酰半胱氨酸能够有效增加运动能力,然而却伴随一定的副作用[16]。因此,安全有效的营养分子的摄取对运动者的运动效果和机体健康是至关重要的。本课题组长期从事线粒体营养素领域的研究,并将线粒体营养素的功能定义为:(1)可以提高线粒体酶底物和辅酶的水平;(2)能够激活细胞内二相酶体系,增强细胞抗氧化能力;(3)能够清除自由基,防止氧化剂的产生。羟基酪醇、白藜芦醇和硫辛酸是近年来研究比较广泛的线粒体营养素,且有较好的应用前景。本文将结合实验室前期研究结果,综合阐述3种线粒体营养素对运动中线粒体功能代谢及调控的研究进展。
1 羟基酪醇
羟基酪醇是一种抗氧化活性极强的多酚化合物,最早发现于制备橄榄油的废水中。早期的研究表明,羟基酪醇的摄入能够有效增加机体的抗氧化能力[17],抑制低密度脂蛋白的氧化[18],减少高脂饮食引起的动脉粥样硬化病[19],降低吸烟引起的氧化应激[20],提示羟基酪醇对心血管疾病有良好的预防效果。而我课题组近期研究发现,羟基酪醇不仅能够作为抗氧化剂直接发挥作用,同时还能激活Nrf2/Keap1二相酶体系,增强细胞整体的抗氧化能力[21]。另一方面,羟基酪醇通过激活PGC-1α能够促进人视网膜色素上皮细胞和3T3-L1脂肪细胞中线粒体的生成[22,23]。这些结果提示我们,羟基酪醇是一个有效的线粒体营养素,它很有可能在运动引起的肌肉损伤和线粒体功能失调方面有较好的保护效果。我们利用Sprague-Dawley (SD)大鼠开展了羟基酪醇保护过度运动引起肌肉损伤的相关实验。实验选用180~200 g的8周龄雄性SD大鼠,经过适应后在电动跑台上以20 m/min的速度,5° 的跑台斜度运动1 h,每周运动6 d。在运动开始前45 min,羟基酪醇以灌胃的形式给予,保持剂量25 mg/kg/d。完成运动训练8周之后,对老鼠的运动耐力进行检测。结果显示过度运动使老鼠的运动耐力有降低趋势,羟基酪醇的补充使之显著增加[24]。羟基酪醇有效地抑制了过度运动引起的PGC-1α和线粒体复合物I亚基表达的降低,同时羟基酪醇的补充有效增加了运动中肌肉线粒体复合物I和II的活性,这种提高在补充了羟基酪醇的非运动组老鼠中并没有发生。这一结果提示,羟基酪醇在运动条件下对线粒体活性的促进尤为明显[24]。Bo等研究者介绍线粒体网络对于急性和耐力运动的不同反应,主要集中在线粒体融合和裂解反应上,急性运动能够增加ROS和线粒体4态的呼吸,降低线粒体融合及增加线粒体裂解[25]。与之类似,我们的研究发现剧烈运动引起线粒体分裂关键蛋白Drp1表达的上升,羟基酪醇的补充能够有效抑制该蛋白的上升,同时显著增加线粒体融合关键蛋白Mfn1和Mfn2的表达。这一结果提示羟基酪醇对线粒体分裂、融合的动态变化有一定的调控作用,从而有效保护线粒体活性,维持线粒体功能和运动的耐力[24]。
2 白藜芦醇
白藜芦醇是一种存在于多种植物中的多酚化合物,在葡萄皮中含量尤为丰富。科学家推测,法国人在高热量饮食环境中之所以依然保持着心血管疾病、癌症等的低发病率,与他们日常饮用的红葡萄酒中含有丰富的白藜芦醇有密切关系。这一推测掀起对白藜芦醇研究的热潮。随后的研究指出,白藜芦醇能够模拟热量限制的生活模式,激活Sirtuin家族蛋白(SIRT1),从而有效延缓衰老的发生[26]。目前为止,科学研究已阐明白藜芦醇在衰老相关疾病如心血管疾病、癌症、神经退行性疾病和Ⅱ型糖尿病中都有显著的预防保护效果,而这些疾病的发生与线粒体功能紧密相关,由此可推测白藜芦醇对线粒体具有积极的调控作用。
Marie等科学家首次发现在白藜芦醇喂养的小鼠肌肉中线粒体的数目和功能显著提高,这一影响主要是通过激活SIRT1和PGC-1α来实现的[27]。衰老过程中肌肉线粒体的生成能力下降,机体的运动耐力随之降低,通过常规运动状态下补充白藜芦醇能够显著增加衰老肌肉中线粒体的数量,并有效增强其运动耐力,而这一效果通过单纯的常规运动是无法实现的[28]。Dolinsky等的最新研究发现,与非运动对照相比,白藜芦醇能够增加常规运动大鼠中线粒体的数量,促进肌肉和心脏的功能,从而增强运动耐力[29]。Menzies等人对这一现象进行研究指出,常规运动或白藜芦醇本身都可以促进肌肉线粒体的生成。SIRT1作为PGC-1α主要的调控蛋白发挥作用,当常规运动与白藜芦醇摄入两者结合时会产生协同效应,SIRT1激活更多的PGC-1α进入细胞核来促进线粒体的生成[30]。然而到目前为止,白藜芦醇能否保护过度运动引起的肌肉损伤和线粒体功能失调仍缺乏相关报道。但是与羟基酪醇类似,白藜芦醇不仅仅能够作为抗氧化剂直接与自由基进行反应,还能够激活Nrf2/Keap1二相酶抗氧化体系,增加机体清除氧化损伤的能力[31]。因此我们推测白藜芦醇同样能够有效抑制运动损伤引起的线粒体功能障碍和运动耐力的降低。
3 硫辛酸
硫辛酸是含有一个手性碳结构的八碳二硫化合物,广泛存在于动植物中,最早于1951年在小牛的肝脏中分离得到。作为一种有效的抗氧化剂,硫辛酸具有两个巯基可以直接与自由基进行反应。大量研究揭示,硫辛酸能够激活Nrf2/Keap1信号通路,诱导抗氧化物谷胱甘肽、血红素单加氧酶(HO-1)的生成[32,33],从而有效保护缺血再灌注引起的心肌细胞的损伤[34]。人体内硫辛酸不单单是作为抗氧化剂存在,它还是线粒体中丙酮酸脱氢酶、α-酮戊二酸脱氢酶的辅助因子,对于线粒体功能的发挥有至关重要的作用。我们前期研究发现硫辛酸不仅可以有效提高线粒体活性,同时在与乙酰肉碱的共同作用下,还可以激活PGC-1α调控的线粒体生成信号通路,增加脂肪细胞中线粒体的数量[35]。此外,我们在Goto-Kakizaki (GK)大鼠的骨骼肌中发现,硫辛酸能够和其它线粒体营养素共同作用促进肌肉线粒体的生成及活性的增强,改善大鼠体内糖脂代谢的紊乱[36]。在过度运动的大鼠中,硫辛酸和其它线粒体营养素共同作用有效地降低其肌肉氧化损伤,促进线粒体复合物I、II、III的蛋白表达,以及线粒体DNA的拷贝数的增加,最终促进运动耐力的提高[37]。虽然在动物实验中我们采用硫辛酸和其它营养素共同作用,硫辛酸本身对肌肉线粒体依然具有良好促进作用,早在1999年Khanna等科学家就发现通过补充硫辛酸,力竭运动引起的肌肉组织脂质过氧化程度显著降低[38],同样在运动竞赛用的马匹中摄入硫辛酸后能够显著降低其持续运动过程中产生的氧化应激,并且在马匹恢复期间有效增加其体内谷胱甘肽的含量[39]。而Wang等人的实验发现,在24月大的C57BL/6小鼠中摄入硫辛酸1月后,肌肉中腺苷酸活化蛋白激酶(AMPK)被激活,其下游靶基因PGC-1α表达上升并促进线粒体数目和功能的升高[40],这些研究结果提示我们无论是运动或是衰老引起的线粒体和肌肉功能降低,都能有效地通过补充硫辛酸得到缓解和恢复。
4 小结
运动作为一种有益的生活方式能够改善心血管功能、肌肉功能、糖脂代谢功能等已经被人们广泛接受,但伴随着运动尤其是剧烈运动或长时间运动,机体内尤其是肌肉组织中产生的大量ROS引起的氧化损伤和线粒体功能降低同样不容忽视,已有研究同样提示肌肉线粒体功能的损伤能够引起肌肉张力下降、肌肉萎缩、胰岛素抵抗等症状。似乎对运动作用效果的定义处于自相矛盾之中,然而在运动中补充线粒体营养素则能够有效地解决这种矛盾。羟基酪醇、白藜芦醇和硫辛酸是我们目前认为安全有效的主要的线粒体营养素,它们都能够激活Nrf2/Keap1信号调控的二相酶体系,有效清除运动中产生的ROS,降低氧化损伤,通过不同途径激活PGC-1α,诱导线粒体数量的增加、提高机体运动耐力(图1)。虽然目前已开展多项研究,但它们对线粒体代谢的调控机制仍不全面,比如羟基酪醇如何激活PGC-1α,白藜芦醇和硫辛酸是否调控线粒体融合和分裂等,这方面的研究将进一步补充线粒体营养素调控运动线粒体代谢的理论体系,为羟基酪醇、白藜芦醇和硫辛酸的临床应用提供进一步的理论支持。
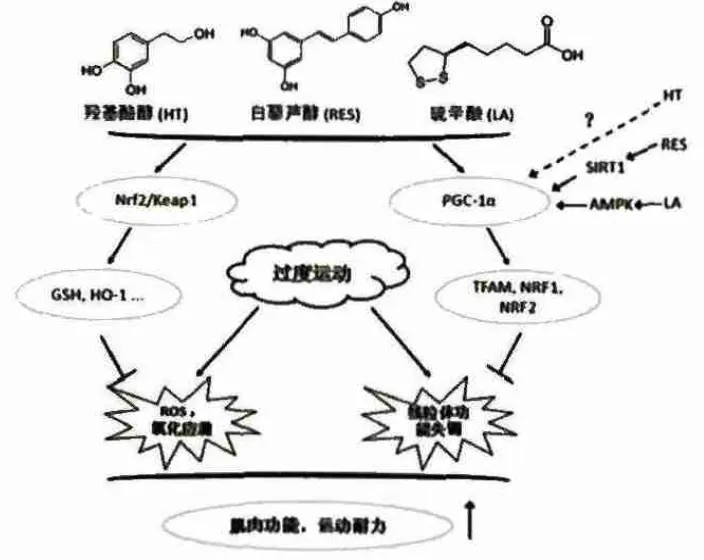
图1 线粒体营养素调节运动条件下线粒体功能的作用机制Figure 1 Mechanism of Mitochondrial Nutrients in Regulating Mitochondria in Motion State
[1] Liesa M., Shirihai O. S. (2013). Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure[J].Cell Metab,17:491-506.
[2] Holloszy J. O. (2008). Regulation by exercise of skeletal muscle content of mitochondria and GLUT4[J].J physiol Pharmacol,59 Suppl 7:5-18.
[3] Dillard C J, Litov RE, Savin, WM, et al. (1978). Effects of exercise, vitamin E, and ozone on pulmonary function and lipid peroxidation[J].J Appl Physiol: Respir, enviro exerc physiol,45:927-932..
[4] Powers S. K., Jackson M. J. (2008). Exercise-induced oxidative stress: cellular mechanisms and impact on muscle force production[J].PhysiolRev,88:1243-1276.
[5] Kuwahara H., Horie T., Ishikawa S., Tsuda C.et al.(2010).Oxidative stress in skeletal muscle causes severe disturbance of exercise activity without muscle atrophy[J].Free Radic Biol Med,48:1252-1262.
[6] Aoi W., Naito Y., Yoshikawa, T. (2013). Role of oxidative stress in impaired insulin signaling associated with exercise-induced muscle damage[J].Free Radic Biol Med,65C:1265-1272.
[7] Boveris A., Chance B. (1973). The mitochondrial generation of hydrogen peroxide. General properties and effect of hyperbaric oxygen[J].Biochem J,134:707-716.
[8] Venditti P., Bari A., Di Stefano L., Di Meo S. (2007). Role of mitochondria in exercise-induced oxidative stress in skeletal muscle from hyperthyroid rats[J].Arch Biochem Biophys,463:12-18.
[9] Wang H. J., Pan Y. X., Wang W. Z., Zucker I. H., Wang W.(2009). NADPH oxidase-derived reactive oxygen species in skeletal muscle modulates the exercise pressor refl ex[J].J Aappl Physiol,107:450-459.
[10] Gomez-Cabrera M. C., Borras C., Pallardo F. V., Sastre J. et al.(2005). Decreasing xanthine oxidase-mediated oxidative stress prevents useful cellular adaptations to exercise in rats[J].J Physiol,567:113-120.
[11] Gomez-Cabrera M. C., Close G. L., Kayani A., McArdle A.et al.(2010). Effect of xanthine oxidase-generated extracellular superoxide on skeletal muscle force generation[J].Am J Physiol Requl Integr Comp Physiol,298:R2-8.
[12] Yan Z., Lira V. A., Greene N. P. (2012). Exercise training-induced regulation of mitochondrial quality[J].Exerc Sport Sci Rev,40:159-164.
[13] Reid M. B., Khawli F. A., Moody M. R. (1993). Reactive oxygen in skeletal muscle. III. Contractility of unfatigued muscle[J].J Appl Physiol,75:1081-1087.
[14] Banerjee A. K., Mandal A., Chanda D., Chakraborti S. (2003).Oxidant, antioxidant and physical exercise[J].Mol CellBiochem,253:307-312.
[15] Sacheck J. M., Blumberg J. B. (2001). Role of vitamin E and oxidative stress in exercise[J].Nutrition,17:809-814.
[16] Cobley J. N., McGlory C., Morton J. P., Close G. L. (2011).N-Acetylcysteine Attenuates Fatigue Following Repeated-Bouts of Intermittent Exercise: Practical Implications for Tournament Situations[J].Int J Sport Nutr Exe.
[17] Visioli F., Caruso D., Plasmati E., Patelli R. et al.(2001) .Hydroxytyrosol,as a component of olive mill waste water, is dose- dependently absorbed and increases the antioxidant capacity of rat plasma[J].Free Radical Res,34:301-305.
[18] Salami M., Galli C., De Angelis L., Visioli F. (1995). Formation of F2-isoprostanes in oxidized low density lipoprotein: inhibitory effect of hydroxytyrosol[J].Pharmacol Res: the official journal of the Italian Pharmacological Society,31:275-279.
[19] Gonzalez-Santiago M., Martin-Bautista E., Carrero J. J., Fonolla J. et al.(2006). One-month administration of hydroxytyrosol, a phenolic antioxidant present in olive oil, to hyperlipemic rabbits improves blood lipid profile, antioxidant status and reduces atherosclerosis development[J].Atherosclerosis,188:35-42.
[20] Visioli F., Galli C., Plasmat E., Viappiani S. et al.(2000). Olive phenol hydroxytyrosol prevents passive smoking-induced oxidative stress[J].Circulation,102:2169-2171.
[21] Zou X., Feng Z., Li Y., Wang Y. et al. (2012). Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells:activation of Nrf2 and JNK-p62/SQSTM1 pathways[J].J Nutri Biochem,23:994-1006.
[22] Hao J., Shen W., Yu G., JiaH. et al. (2010). Hydroxytyrosol promotes mitochondrial biogenesis and mitochondrial function in 3T3-L1 adipocytes[J].J Nutri Biochem,21:634-644.
[23] Zhu L., Liu Z., Feng Z., Hao J. et al.(2010). Hydroxytyrosol protects against oxidative damage by simultaneous activation of mitochondrial biogenesis and phase II detoxifying enzyme systems in retinal pigment epithelial cells[J].J Nutri Biochem,21:1089-1098.
[24] Feng Z., Bai L., Yan J., Li Y. et al.(2011). Mitochondrial dynamic remodeling in strenuous exercise-induced muscle and mitochondrial dysfunction: regulatory effects of hydroxytyrosol[J].Free Radic Biol Med,50:1437-1446.
[25] Bo H., Zhang Y., Ji L. L. (2010). Redefining the role of mitochondria in exercise: a dynamic remodeling[J].Ann N Y Acad Sci,1201:121-128.
[26] Wood J. G., Rogina B., Lavu S., Howit K. et al.(2004). Sirtuin activators mimic caloric restriction and delay ageing in metazoans[J].Nature,430:686-689.
[27] Lagouge M., Argmann C., Gerhart-Hines Z., Meziane H. et al.(2006). Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha[J].Cell,127:1109-1122.
[28] Murase T., Haramizu S., Ota N., Hase T. (2009). Suppression of the aging-associated decline in physical performance by a combination of resveratrol intake and habitual exercise in senescence-accelerated mice[J].Biogerontology,10:423-434.
[29] Dolinsky V. W., Jones K. E., Sidhu R. S., Haykowsky M.et al.(2012). Improvements in skeletal muscle strength and cardiac function induced by resveratrol during exercise training contribute to enhanced exercise performance in rats[J].J Physiol,590:2783-2799.
[30] Menzies K. J., Singh K., Saleem A., Hood D. A. (2013). Sirtuin 1-mediated effects of exercise and resveratrol on mitochondrial biogenesis[J].J Biol Chem,288:6968-6979.
[31] Gurusamy N., Ray D., Lekli I., Das D. K. (2010). Red wine antioxidant resveratrol-modified cardiac stem cells regenerate infarcted myocardium[J].J Cell Mol Med,14:2235-2239.
[32] Suh J. H., Shenvi S. V., Dixon B. M.et al.(2004). Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid[J].Proc Natl Acad Sci USA,101:3381-3386.
[33] Lii C. K., Liu K. L., Cheng Y. P., Lin A. H. et al. (2010).Sulforaphane and alpha-lipoic acid upregulate the expression of the pi class of glutathione S-transferase through c-jun and Nrf2 activation[J].J Nutr,140:885-892.
[34] Deng C., Sun Z., Tong G., Yi W. et al.(2013). alpha-Lipoic acid reduces infarct size and preserves cardiac function in rat myocardial ischemia/reperfusion injury through activation of PI3K/Akt/Nrf2 pathway[J].PloS one,8:e58371.
[35] Shen W., Liu K., Tian C., Yang L. et al.(2008.) R-alphalipoic acid and acetyl-L-carnitine complementarily promote mitochondrial biogenesis in murine 3T3-L1 adipocytes[J].Diabetologia,51:165-174.
[36] Shen W., Hao J., Tian C., Ren J. et al.(2008). A combination of nutriments improves mitochondrial biogenesis and function in skeletal muscle of type 2 diabetic Goto-Kakizaki rats[J].PloS one,3:e2328.
[37] Sun M., Qian F., Shen W., Tian C. et al.(2012). Mitochondrial nutrients stimulate performance and mitochondrial biogenesis in exhaustively exercised rats[J].Scand J Med Sci Spor,22:764-775.
[38] Khanna S., Atalay M., Laaksonen D. E., Gul M.et al.(1999).Alpha-lipoic acid supplementation: tissue glutathione homeostasis at rest and after exercise[J].J Appl Physiol,86:1191-1196.
[39] Kinnunen S., Oksala N., Hyyppa S., Sen C. K. et al. (2009). alpha-Lipoic acid modulates thiol antioxidant defenses and attenuates exercise-induced oxidative stress in standardbred trotters[J].Free Radical Res,43:697-705.
[40] Wang Y., Li X., Guo Y., Chan L., Guan X. (2010). alpha-Lipoic acid increases energy expenditure by enhancing adenosine monophosphate-activated protein kinase-peroxisome proliferatoractivated receptor-gamma coactivator-1alpha signaling in the skeletal muscle of aged mice[J].Metabolism: clinical and experimental,59:967-976.

