醌基聚氨酯泡沫强化活性污泥脱色活性艳红X-3B特性研究
周 集 体, 王 颖, 吕 红, 王 竞, 杨 旭
(大连理工大学 工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
0 引 言
随着印染工业的发展和染料品种的日益增多,染料废水给环境带来的污染日益加大[1].目前染料废水的处理方法主要有物理法[2]、化学法[3]和生物法[4].生物法具有操作简单、运行成本低、二次污染少等优点,其中厌氧-好氧工艺是处理这类废水的有效方法之一[5].然而,在厌氧条件下,偶氮染料的脱色速率缓慢,是偶氮染料完全生物降解的瓶颈[6].最近研究表明,水溶性醌类化合物如蒽醌-2-磺酸、蒽醌-2,6-二磺酸作为氧化还原介体可以加速偶氮染料厌氧生物脱色速率[7-10].其过程为醌化合物首先被微生物还原为氢醌,后者再将电子传递给偶氮染料,从而使偶氮染料还原为芳香胺,同时醌化合物再生[11].但是,在废水处理过程中,连续添加这类醌化合物介体会造成成本的增加,并且它们易随出水流失造成二次污染[12].为此,本实验室采用化学共价方法将蒽醌-2-磺酸(AQS)固定在聚氨酯泡沫上,固定后的AQS对偶氮染料生物脱色具有较好的催化作用[13].
在实际的偶氮染料废水处理过程中,所用的活性污泥往往需要经过长时间的驯化才能满足要求.但近年来发现,醌化合物能够提高未经驯化的活性污泥处理偶氮染料脱色的能力[9].基于此,本文研究醌基聚氨酯泡沫强化活性污泥厌氧处理偶氮染料脱色的特性,以期为固定化氧化还原介体在偶氮染料废水处理工艺中的实际应用提供一定的理论基础.
1 材料与方法
1.1 实验材料和药品
聚氨酯泡沫由大连兰大生物环境技术有限公司提供.实验所用活性污泥来自大连春柳河污水处理厂二沉池.偶氮染料活性艳红X-3B购自天津天顺化工有限公司;蒽醌-2-磺酸(AQS)购自美国Sigma-Aldrich公司;蒽醌-2-磺酰氯(ASC)按文献[14]方法合成;其余药品均为分析纯.
1.2 培养基
无机盐培养基组成(g·L-1):NH4Cl 1.0,KH2PO40.5,K2HPO40.6,MgCl2·6H2O 0.2,CaCl2·2H2O 0.05.
厌氧培养基组成:在无机盐培养基基础上加甲酸钠3.0g·L-1;pH=7.
1.3 醌基聚氨酯泡沫的制备
30℃下,在 NaOH 溶液中加入0.68~0.70g聚氨酯泡沫(1cm3)和48g二乙烯三胺,反应6h,水洗并干燥;将上述胺化的泡沫放入NaOH溶液中,然后加入2mmol·L-1蒽醌-2-磺酰氯(ASC)搅拌反应1h,待反应结束后取出聚氨酯泡沫,用蒸馏水冲洗干净烘干备用.经元素分析仪测定,反应后醌基聚氨酯泡沫中的醌浓度为0.03mmol·g-1.
1.4 偶氮染料活性艳红X-3B生物脱色实验
在装有无机盐培养基的血清瓶(250mL)中加入200mg·L-1活性艳红X-3B和一定浓度的电子供体,调节pH=7,然后再加入一定浓度的活性污泥和0.83g醌基聚氨酯泡沫块(醌终浓度为0.1mmol·L-1),使用橡胶塞密封瓶口,N2曝气10min保持厌氧状态,在一定温度下,于120 r·min-1摇床中反应.分别研究污泥浓度(0.4~1.8g·L-1)、电子供体(甲酸钠、乙酸钠、乳酸钠、葡萄糖)、甲酸钠浓度(0.5~4.5g·L-1)、温度(30~50℃)对活性艳红X-3B厌氧生物脱色的影响.
1.5 醌基聚氨酯泡沫重复使用实验
在装有无机盐培养基的血清瓶(250mL)中加入一定浓度的活性艳红X-3B、1.5g·L-1甲酸钠、1.8g·L-1活性污泥,调节培养基初始pH 为7.0,加入0.83g醌基聚氨酯泡沫块(醌终浓度为0.1mmol·L-1),于30℃、120r·min-1摇床中进行厌氧反应.24h后取出醌基聚氨酯泡沫,加入到下一个同样的反应体系,研究醌基聚氨酯泡沫的重复使用效率及长期使用性能.
1.6 分析方法
污泥浓度(MLSS)采用重量法进行测定[15].
染料浓度测定方法:取培养液离心后(10 000 r·min-1,5min)的上清液,以不含染料的无机盐培养基为参比,利用JASCO V-560紫外可见分光光度计,在染料活性艳红X-3B相应的最大吸收波长处(538nm)测量其吸光度.染料脱色率计算如下:

式中:A0、At分别为初始时刻和培养t时刻上清液的吸光度;r为脱色率,%.
1.7 聚氨酯泡沫的表征
使用电子扫描电镜(SEM)对聚氨酯泡沫和醌基聚氨酯泡沫表面形态的变化进行表征.
2 结果与讨论
2.1 活性污泥浓度对活性艳红X-3B生物脱色的影响
以3g·L-1甲酸钠为电子供体,向反应体系中加入醌基聚氨酯泡沫(0.1mmol·L-1固定化醌),并以普通聚氨酯泡沫为对照,于30℃下研究不同活性污泥浓度对活性艳红X-3B脱色的影响.未添加活性污泥的反应体系中染料浓度基本不变,表明聚氨酯泡沫自身吸附的染料很少,吸附作用可忽略不计.结果如图1所示,从加入普通聚氨酯泡沫体系可以看出,未经驯化的活性污泥本身对活性艳红X-3B具有一定的脱色能力,并且随着活性污泥浓度的增加,脱色率增大.但当活性污泥浓度大于1.4g·L-1时,活性艳红X-3B脱色率增加缓慢,并且当活性污泥浓度达到1.8g·L-1时,活性艳红X-3B脱色率达到最大.相比较,在含有醌基聚氨酯泡沫体系中,活性艳红X-3B的脱色率随着活性污泥浓度的增加大幅度提高,当活性污泥浓度达到1.8g·L-1时,活性艳红X-3B的脱色率比无醌体系提高了30%.这不仅表明醌基聚氨酯泡沫具有很好的催化性能,而且表明醌还原菌在活性污泥中普遍存在.因此,在以下实验中污泥浓度采用1.8g·L-1.

图1 不同活性污泥浓度对活性艳红X-3B生物脱色的影响Fig.1 Effect of the activated sludge concentration on the bio-decolorization of Reactive Brilliant Red X-3B
2.2 不同电子供体对活性艳红X-3B生物脱色的影响
不同电子供体对偶氮染料的生物脱色率会有不同的影响[16].为此,在30℃条件下,本文选取4种常用电子供体(甲酸钠、乙酸钠、乳酸钠、葡萄糖,皆为3g·L-1)来研究不同电子供体对活性艳红X-3B生物脱色的影响.实验结果如图2所示,其中以葡萄糖作为电子供体时,活性艳红X-3B的脱色率最低.主要是因为反应结束后体系pH变为3.6,不利于微生物的代谢.其他3种电子供体对活性艳红X-3B的生物脱色率影响相差不大.相比较来看,甲酸钠为比较适宜的电子供体.因此以下实验中采用甲酸钠作为电子供体.

图2 不同电子供体对活性艳红X-3B生物脱色的影响Fig.2 Effect of different electron donors on the biodecolorization of Reactive Brilliant Red X-3B
2.3 甲酸钠浓度对活性艳红X-3B生物脱色的影响

图3 甲酸钠浓度对活性艳红X-3B生物脱色的影响Fig.3 Effect of the concentration of sodium formate on the bio-decolorization of Reactive Brilliant Red X-3B
在30℃条件下,甲酸钠浓度对活性艳红X-3B生物脱色的影响如图3所示.从图中可以看出,当甲酸钠浓度为1.5g·L-1,活性艳红 X-3B的脱色率最大.过低浓度的甲酸钠不能满足染料脱色的需要,但当甲酸钠浓度高于1.5g·L-1时,脱色率略有下降.因此下面实验采用的甲酸钠浓度为1.5g·L-1.
2.4 温度对活性艳红X-3B生物脱色的影响
温度对活性艳红X-3B生物脱色的影响如图4所示,随着温度的增加,微生物的代谢活性提高,活性艳红X-3B的脱色率呈增大趋势.在温度分别为30、40、50℃,含有0.1mmol·L-1固态醌体系中的活性艳红X-3B脱色率分别比无醌体系提高了43%、60%、46%.这与 Dos Santos报道的结论一致[17].推测可能是温度的增加,提高了活性污泥中醌还原菌的醌呼吸作用.但考虑到实际应用过程中,提高温度会增加废水处理成本,因此在以下实验中,采用的是30℃.
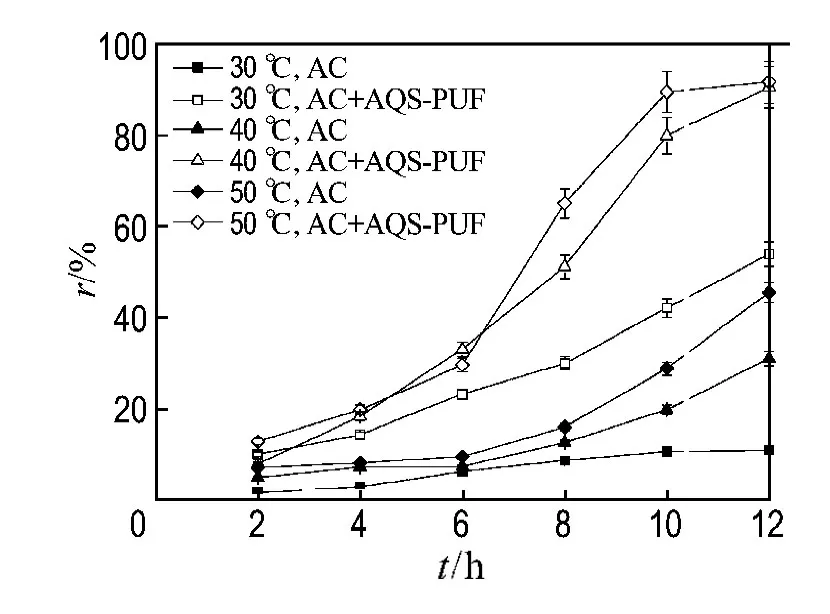
图4 温度对活性艳红X-3B生物脱色的影响Fig.4 Effect of temperature on the bio-decolorization of Reactive Brilliant Red X-3B
2.5 醌基聚氨酯泡沫重复使用情况
在活性艳红X-3B浓度为200mg·L-1,活性污泥浓度为1.8g·L-1,甲酸钠浓度为1.5 g·L-1时,研究了醌基聚氨酯泡沫的循环使用情况.结果如图5所示,醌基聚氨酯泡沫循环使用10次后,活性艳红X-3B的脱色率仍达90%以上,表明聚氨酯泡沫共价固定AQS较为稳固,固定后的AQS具有较好的催化性能.
2.6 醌基聚氨酯泡沫长期使用性能
在上述研究的基础上,研究了醌基聚氨酯泡沫的长期使用性能.实验结果如图6所示,当初始进水浓度为100mg·L-1时,含有醌基聚氨酯泡沫体系(AC+AQS-PUF)中活性艳红X-3B脱色率稳定维持在90%以上,而活性污泥体系(AC)和含有普通聚氨酯泡沫体系(AC+PUF)中的活性污泥在经过大约10d适应后,活性艳红X-3B的脱色率才达到90%.研究表明,醌基聚氨酯泡沫能够明显缩短活性污泥厌氧处理活性艳红X-3B的启动时间.
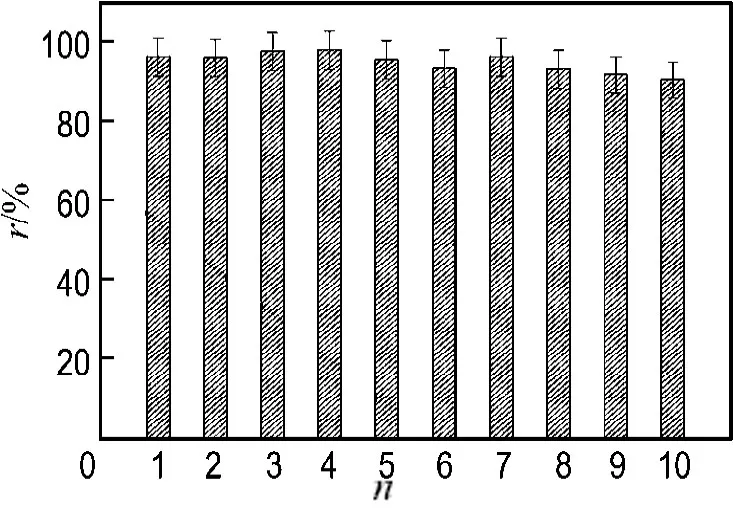
图5 醌基聚氨酯泡沫的循环使用性能Fig.5 AQS-PUF reusage performance

图6 长期使用过程中醌基聚氨酯泡沫的催化性能Fig.6 Catalytic performance of AQS-PUF during the long running
当进水浓度提高到200mg·L-1时,活性污泥体系活性艳红X-3B的脱色率呈现出先降低、后增大的趋势,其抗冲击性能明显低于其他两个体系.含有醌基聚氨酯泡沫体系处理活性艳红X-3B的性能最高.当进水浓度继续提高到400 mg·L-1时,含有醌基聚氨酯泡沫体系中活性艳红X-3B的脱色率始终高于90%;含有普通聚氨酯泡沫体系中活性艳红X-3B的脱色率略低一些,并在27d后开始逐渐降低;活性污泥体系的脱色率更从97%降低到25%,反应体系崩溃.研究表明,醌基聚氨酯泡沫能够提高活性艳红X-3B的厌氧生物脱色速率,并且具有一定的稳定性.
反应结束后,从反应体系中取出醌基聚氨酯泡沫.通过扫描电镜可以看到(如图7所示),醌基聚氨酯泡沫表面附着很多微生物.这是因为聚氨酯泡沫的大孔网状结构适宜微生物附着生长[18-19];并且也增强了固定化醌与微生物的直接接触.通过含有醌基聚氨酯泡沫反应体系的处理性能可以推测出,醌基泡沫表面附着的微生物能够充分有效地还原固定化的醌,被还原的醌也能够将电子传递给偶氮染料,从而提高偶氮染料的脱色速率[18-19].
此外,醌基聚氨酯泡沫与普通聚氨酯泡沫相比,表面上都附着很多污泥颗粒和微生物,未见有明显区别.推测可能是附着的微生物种类有些差异,目前正在进一步分析.

图7 不同聚氨酯泡沫电镜照片Fig.7 SEM photographs of different polyurethane foams
3 结 论
(1)污泥浓度、电子供体和温度对活性艳红X-3B厌氧生物脱色具有不同程度的影响,醌基聚氨酯泡沫能够强化活性污泥厌氧处理活性艳红X-3B.
(2)污泥浓度1.8g·L-1,甲酸钠浓度1.5 g·L-1,温度30℃时,醌基聚氨酯泡沫连续使用10次,活性艳红X-3B脱色率一直能够保持在90%以上,重复利用性能较好.
(3)活性污泥厌氧处理活性艳红X-3B连续30d实验表明,醌基聚氨酯泡沫不仅能够提高活性艳红X-3B厌氧脱色率,并且能够明显缩短活性污泥厌氧处理活性艳红X-3B的启动期.
[1]徐文东,文湘华.微生物在含染料废水处理中的应用[J].环境污染治理技术与设备,2000,1(2):9-16.XU Wen-dong, WEN Xiang-hua.Functions of microorganisms in dying wastewater treatment[J].Techniques and Equipments for Environmental Pollution Control,2000,1(2):9-16.(in Chinese)
[2]Santhy K,Selvapathy P.Removal of reactive dyes from wastewater by adsorption on coir pith activated carbon[J].Bioresource Technology,2006,97(11):1329-1336.
[3]杨岳平,吴星义,徐新华,等.印染废水的 UVFenton氧化处理研究[J].高校化学工程学报,2001,15(3):242-247.YANG Yue-ping,WU Xing-yi,XU Xin-hua,etal.Treatment of dying wastewater by photo-assisted Fenton system [J].Journal of Chemical Engineering of Chinese Universities,2001,15(3):242-247.(in Chinese)
[4]Supaka N,Juntongjin K,Damronglerd S,etal.Microbial decolorization of reactive azo dyes in a sequential anaerobic-aerobic system [J].Chemical Engineering Journal,2004,99(2):169-176.
[5]Van Der Zee F P, Villaverde S.Combined anaerobic-aerobic treatment of azo dyes-A short review of bioreactor studies [J].Water Research,2005,39(8):1425-1440.
[6]Stolz A.Basic and applied aspects in the microbial degradation of azo dyes [J].Applied Microbiology and Biotechnology,2001,56(1-2):69-80.
[7]Encinas-yocupicio A A,Razo-flores E,Sanchez-diai F,etal.Catalytic effects of different redox mediators on the reductive decolorization of azo dyes[J].Water Science and Technology,2006,54(2):165-170.
[8]Van Der Zee F P,Cervantes F J.Impact and application of electron shuttles on the redox (bio)transformation of contaminants:A review [J].Biotechnology Advances,2009,3(27):256-277.
[9]Rau J,Knackmuss H J,Stolz A.Effects of different quinoid redox mediators on the anaerobic reduction of azo dyes by bacteria[J].Environmental Science and Technology,2002,36(7):1497-1504.
[10]LIU Guang-fei,ZHOU Ji-ti,WANG Jing,etal.Acceleration of azo dye decolorization by using quinone reductase activity of azoreductase and quinone redox mediator [J].Bioresource Technology,2009,100(11):2791-2795.
[11]Costa M C,Mota S,Nascimento R F,etal.Anthraquinone-2,6-disulfonate (AQDS) as a catalyst to enhance the reductive decolourisation of the azo dyes Reactive Red 2and Congo Red under anaerobic conditions [J].Bioresource Technology,2010,101(1):105-110.
[12]张禄艳,王 竞,吕 红,等.高盐条件下染料酸性橙7的生物降解特性[J].中国环境科学,2009,29(6):640-645.ZHANG Lu-yan,WANG Jing,LV Hong,etal.Biodegradation characteristics of Acid Orange 7 under hypersaline conditions [J].China Environmental Science,2009,29(6):640-645.(in Chinese)
[13]LV Hong,ZHOU Ji-ti, WANG Jing,etal.Enhanced biodecolorization of azo dyes by anthraquinone-2-sulfonate immobilized covalently in polyurethane foam [J].Bioresource Technology,2010,101(18):7185-7188.
[14]FENG Fang, Uno B, Goto M,etal.Anthraquinone-2-sulfonyl chloride:a new versatilederivatization reagent-synthesis mechanism and application for analysis of amines [J].Talanta,2002,57(3):481-490.
[15]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:107-108.Editorial Board of Water Quality & Wastewater Monitoring Method, The Central People′ s Government of the People′s Republic of China.Water Quality & Wastewater Monitoring Method[M].4th ed.Beijing:China Environmental Science Press,2002:107-108.(in Chinese)
[16]Ong S A,Toorisaka E,Hirata M,etal.Granular activated carbon-biofilm configured sequencing batch reactor treatment of C.I.Acid Orange 7[J].Dyes and Pigments,2008,76(1):142-146.
[17]Dos Santos A B,Bisschops L A E,Cervantes F J,etal.Effect of different redox mediators during thermophilic azo dye reduction by anaerobic granular sludge and comparative study between mesophilic(30 ℃)and thermophilic (55 ℃)treatments for decolourisation of textile wastewaters [J].Chemosphere,2004,55(15):1149-1157.
[18]Coughlin M F, Kinkle B K,Bishop P L.Degradation of Acid Orange 7in an aerobic biofilm[J].Chemosphere,2002,46(1):11-19.
[19]Nurdan K P, Raziye O U, Fulya E.Biodecolourization of Direct Blue 15by immobilized phanerochaete chrysosporium [J].Process Biochemistry,2005,40(5):1923-1927.

