新型双萘酰亚胺类化合物与DNA作用研究
金 礼 吉*, 王 利 平, 邹 薇, 肖 义
(大连理工大学 化工与环境生命学部,辽宁 大连 116024)
0 引 言
1973年,Brana等首次合成了一系列3-硝基单萘酰亚胺类衍生物,这类化合物被证明能有效地嵌入DNA[1].在单萘酰亚胺类衍生物中,已经进入临床实验的药物有米托萘胺(Mitonafide)[2]和氨萘非特(Amonafide)[3],它们均能嵌入DNA,影响DNA和RNA的功能.20世纪80年代,人们将2个萘环用一个“手臂”连接起来,得到了具有更高细胞毒性和更强DNA结合力的双萘酰亚胺[4],连接基上的氨基氮原子质子化形成的正离子有利于发生静电作用,从而提高嵌入剂分子与DNA的亲和力,适当的柔性和长度又可确保二者形成稳定的复合物.目前处于临床研究的双萘酰亚胺类化合物主要有依利萘法德(Elinafide)[5]和Du Pont Merck开发的双萘法德(Bisnafide)[6].研究发现,连接基的长度、对称性及其电负性影响双萘酰亚胺类化合物与DNA的结合力.有关双萘酰亚胺连接基种类的研究已成为关注热点[7-9],但连接基的长度与化合物活性之间的关系尚无系统、深入的研究.本实验通过考察不同长度的烷基异硫脲阳离子作为连接臂的一系列新型双萘酰亚胺类化合物与DNA的相互作用,分析连接臂的长短对双萘酰亚胺类化合物嵌入能力的影响,以期为研究DNA与萘酰亚胺嵌入单元和连接基之间的特异性结合提供实验和理论依据,同时也为其他各类化合物的连接基的分子设计奠定基础.
1 实验部分
1.1 仪器与试剂
TU-1900双光束型紫外-可见分光光度计(北京普析通用仪器有限公司);日立F-4500荧光分光光度计(日本Hitachi公司);J-810型圆二色光谱仪(日本Jasco公司).
小牛胸腺DNA为Sigma公司产品,UV测得A260/A280>1.8,表明纯度符合要求,称取一定量配成溶液,测得浓度为6.67×10-4mol/L,4℃保存;吖啶橙(AO)配制为1mol/L母液保存;Tris-HCl缓冲溶液(0.02mol/L,pH7.2)为临时配制;实验用水采用二次蒸馏水,其他试剂均为分析纯.
本实验中的新型双萘酰亚胺类化合物(DN2~DN6)是由大连理工大学化工学院肖义合成的,并已取得专利[10],合成路线如图1所示(n=2~6).
合成的化合物命名为 DN2:N,N′-双(2,2′-乙基双萘酰亚胺)-S-甲基-异硫脲;DN3:N,N′-双(3,3′-丙基双萘酰亚胺)-S-甲基-异硫脲;DN4:N,N′-双(4,4′-丁 基 双 萘 酰 亚 胺)-S-甲 基-异 硫 脲;DN5:N,N′-双(5,5′-戊基双萘酰亚胺)-S-甲基-异硫脲;DN6:N,N′-双(6,6′-己基双萘酰亚胺)-S-甲基-异硫脲.
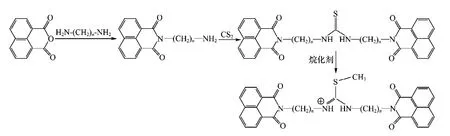
图1 新型双萘酰亚胺类化合物的合成路线Fig.1 The synthesis route for the novel bis-naphthalimide derivatives
1.2 实验方法
1.2.1 紫外吸收光谱 在一系列10mL比色管中分别加入终浓度为10μmol/L的DN2~DN6,再加入不同体积的DNA溶液,用Tris-HCl缓冲溶液稀释至刻度后摇匀,室温放置15min后,以相应的Tris-HCl缓冲溶液为参比,扫描300~400nm的紫外吸收光谱.
1.2.2 荧光光谱
(1)DNA对化合物荧光光谱的影响
在一系列10mL比色管中分别加入终浓度为10μmol/L的DN2~DN6,再加入不同体积的DNA溶液,用Tris-HCl缓冲溶液稀释至刻度后摇匀,室温放置15min后,以344nm为激发波长,扫描320~650nm的荧光光谱,激发与发射狭缝均为5nm,扫描速度为2 400nm/min.
(2)化合物和AO对DNA的竞争结合实验
在一系列10mL比色管中依次加入相同体积的AO溶液、DNA溶液,用Tris-HCl缓冲溶液稀释至刻度后摇匀,室温放置15min后,再于上述比色管中分别加入一定体积的DN2~DN6,每次加入溶液后摇匀并放置15min,以502nm为激发波长,扫描450~750nm的荧光光谱.
1.2.3 圆二色光谱 在一系列10mL比色管中加入相同体积的DNA溶液,再分别加入一定体积的DN2~DN6,使化合物与DNA的物质的量比分别为0.02、0.04、0.10、0.20、0.50和1.00,用 Tris-HCl缓冲溶液稀释至刻度后摇匀并放置15min,于圆二色光谱仪上扫描220~350nm的摩尔椭圆度θ.
2 结果与讨论
2.1 DNA对化合物紫外吸收光谱的影响
化合物DN2~DN6在231和343nm处有特征吸收峰(见图2),随着DNA的加入,化合物的吸收峰在231nm处均出现明显的减色效应,根据减色率计算公式:减色率=(A0-A1)/A0×100%,其中A0为未加DNA时化合物的吸光度(各化合物初始浓度相同),A1为加DNA后化合物吸光度(各化合物中DNA浓度保持一致),当DNA浓度为2.00μmol/L时,DN2~DN6的减色率分别为6.1%、16.3%、15.8%、21.7%和25.2%,且均伴有微弱的红移现象,化合物DN6的减色效应最为显著,说明烷基链的长短起到了重要作用.化合物分子中的芳环平面插入到DNA碱基对之间[11],化合物的π轨道与碱基的π轨道发生耦合,使部分电子填充进来,导致π→π*跃迁几率减小,从而产生减色效应[12];化合物的烷基链越长,异硫脲基团对其电子云的吸引力就越强,芳环共轭体系的电子云密度就越低,有助于化合物的芳环与DNA碱基平面之间发生堆积作用[13],因此在总体变化趋势上,化合物的减色效应随其烷基链的延长而增强.
2.2 DNA对化合物荧光光谱的影响
由荧光光谱结果可见,5种化合物均具有较强的内源性荧光,其中DN2在400nm处有较强特征发射峰,而其他4种化合物在495nm处有较强特征发射峰(见图3),这种差异性可能是由异硫脲基团的电荷分布所致.随着DNA的加入,各化合物的荧光光谱均呈现有规律的猝灭,这是由于化合物嵌入DNA碱基对产生电荷转移,进而改变自身激发态的电子态,导致荧光强度降低[14].经比较分析发现,DNA对化合物的猝灭作用随烷基链的延长而增强,这与紫外吸收光谱实验结果相一致.

图2 DNA对DN2~DN6的紫外吸收光谱(pH=7.2)Fig.2 The UV absorption spectra of the DNA to DN2-DN6(pH =7.2)
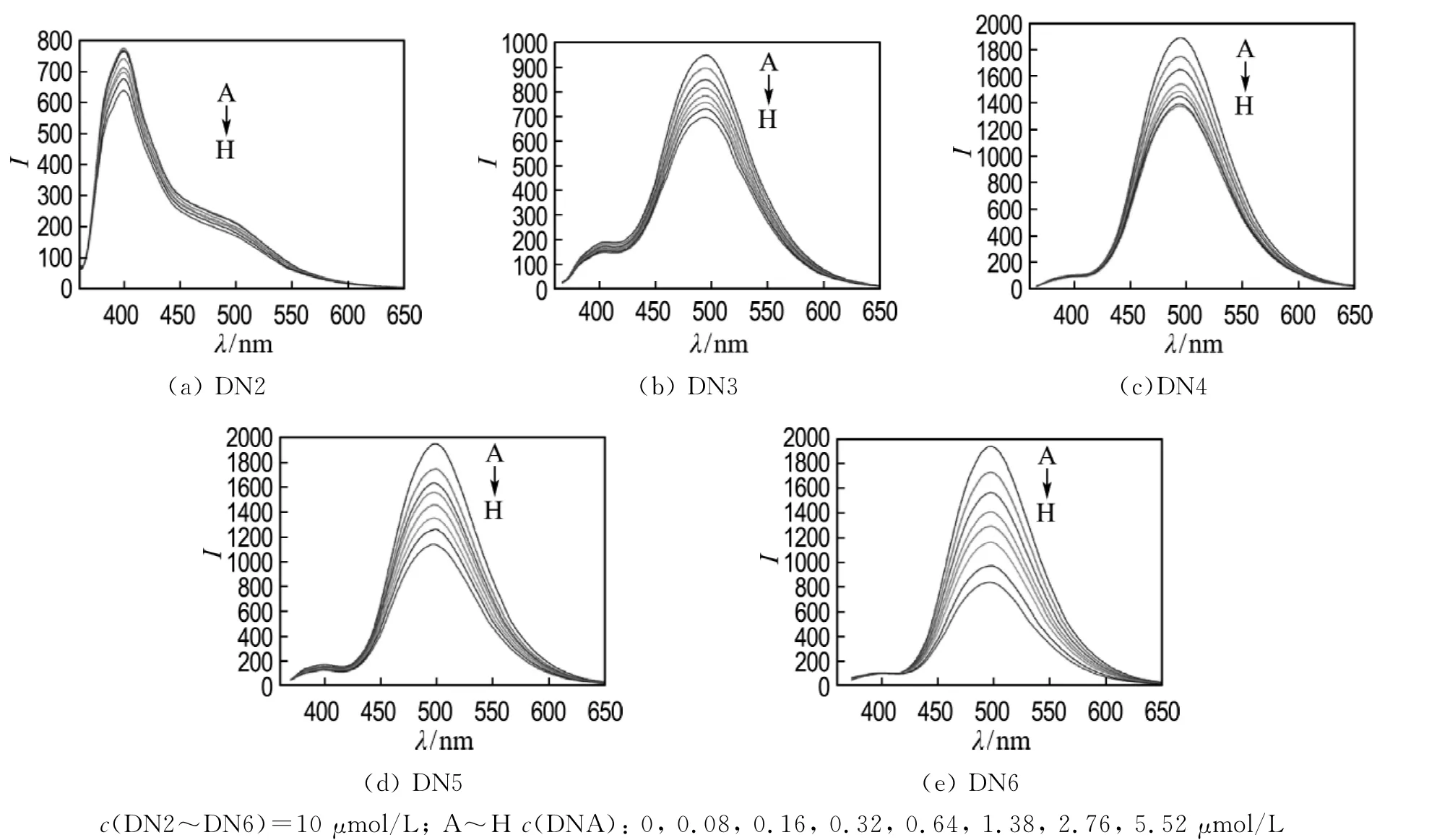
图3 DNA存在下DN2~DN6的荧光光谱Fig.3 The fluorescence spectra of DN2-DN6in the presence of DNA
2.3 DNA对化合物荧光的猝灭方式
荧光猝灭分为动态猝灭和静态猝灭两类,根据经典的荧光猝灭理论,如果猝灭是单一的静态或动态过程,以F0/F对c(DNA)作图将得到一条直线,若非直线,则为混合猝灭方式[15].如图4所示,本实验结果均符合直线关系,说明反应体系中只存在一种荧光体,即猝灭剂DNA和荧光体双萘酰亚胺类化合物之间形成了不发荧光的基态络合物,据此推断两者的猝灭方式不是动态猝灭,而是形成化合物-DNA复合物的静态猝灭.根据Stern-Volmer方程[15-16]

计算得猝灭常数Ksv(DN3-DNA)=0.46×105L/mol,Ksv(DN4-DNA)=0.42×105L/mol,Ksv(DN5-DNA)=1.00×105L/mol,Ksv(DN6-DNA)=2.05×105L/mol,其中c(Q)为猝灭剂DNA的浓度.DN2的特征发射波长与其他4种化合物不一致,因此未对其进行相关计算.

图4 DN3~DN6的Stern-Volmer方程线性拟合Fig.4 The linear fitting of Stern-Volmer equation of DN3-DN6
双萘酰亚胺类化合物与DNA分子中某一位点作用时,体系中发生作用的小分子与未发生作用的小分子之间处于一种平衡状态,这种平衡状态可以用以下方程进行描述:

式中:n为结合位点数,K为结合常数.以lg[(F0-F)/F]对lgc(Q)进行一元线性回归,得到线性方程(图形见图5),由表1可见,DN3~DN6的结合常数与结合位点均逐渐增大,表明烷基链越长的化合物与DNA的结合能力越强.
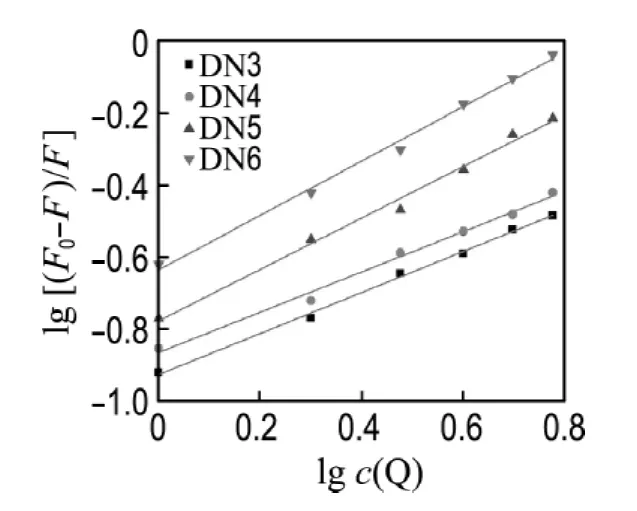
图5 lg[(F0-F)/F]对lg c(Q)的工作曲线Fig.5 The working curve of lg[(F0 -F)/F]to lg c(Q)
2.4 化合物与AO对DNA的竞争结合实验
如图6所示,激发波长为502nm时,AO在534nm处有一特征吸收峰(曲线a),加入DNA后,AO的吸收峰降低(曲线b),即DNA对AO发生了猝灭作用,这是AO嵌入到DNA的碱基对中所致;随后在AO-DNA体系中加入不同浓度的各类化合物,结果见图6中(c)、(d),化合物在此激发波长下于505nm处出现了一个特征吸收峰.实验结果表明,DN2对体系的荧光影响最小,即与AO竞争能力最弱;DN3~DN6在534 nm处的荧光强度有不同程度的上升,说明化合物能够将AO-DNA体系中的AO脱离DNA碱基对,成为游离状态,使AO的吸收峰增强.对比分析可知化合物与AO的竞争力随烷基链的延长而增强,即DN6>DN5>DN4>DN3>DN2.
2.5 圆二色光谱
DNA在200~300nm有典型的B-型构象[17],从圆二色光谱(CD光谱)分析结果可见(见图7),正峰表示DNA的碱基堆积程度,负峰表示DNA的螺旋松散程度.DNA的圆二色光谱在276和243nm处分别有一个正峰和负峰,DN2~DN6的加入均可引起DNA的圆二色光谱正峰的增强和负峰的减弱,表明该类化合物都能嵌入DNA分子中[18].经对比分析可知,化合物的正峰和负峰强度增加和减弱程度随连接基长度的增加而上升,即DN2<DN3<DN4<DN5<DN6.由此推测,化合物嵌入DNA影响DNA的双螺旋结构和碱基堆积力,其作用强度随烷基链的延长而增强.
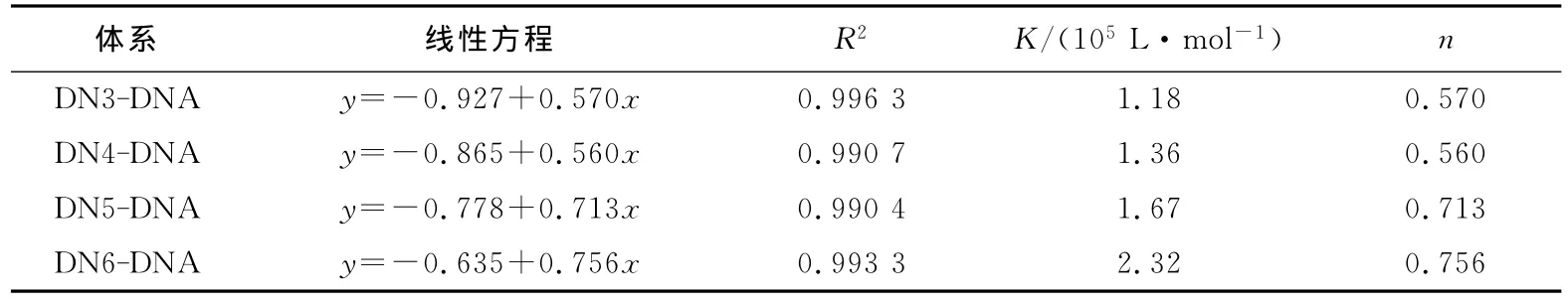
表1 DN3~DN6对DNA的结合常数K与结合位点数nTab.1 Binding constants Kand binding sites nof the interaction between DN2-DN6and DNA

图6 DN2~DN6对AO-DNA体系荧光光谱的影响Fig.6 The effect of DN2-DN6on the fluorescence of AO-DNA system

图7 化合物DN2~DN6对DNA的CD光谱的影响Fig.7 The effect of DN2-DN6on the CD spectra of DNA
3 结 论
研究结果表明,烷基异硫脲阳离子作为连接基的新型双萘酰亚胺类化合物主要以嵌入方式与DNA发生作用,在DN2~DN6五种化合物中,烷基链的长短直接影响嵌入基团的电子云密度和化合物自身的柔性,烷基链越长化合物的柔性越强,对DNA的嵌入能力也越强,即DN6>DN5>DN4>DN3>DN2.
[1]Brana M F, Cacho M, Gradillas A,etal.Intercalators as anticancer drugs [J].Current Pharmaceutical Design,2001,7(17):1745-1780.
[2]Rosell R,Carles J,Abad A,etal.PhaseⅠstudy of mitonafide in 120hours continuous infusion in non small cell lung cancer[J].Investigational New Drugs,1992,10(3):171-175.
[3]Malviga V K,Liu P Y,Alberts D S,etal.Evaluation of amonafide in several cancer,phaseⅡ.A SWOG study [J].American Journal of Clinical Oncology,1992,15(1):41-44.
[4]Brana M F,Castellano J M,Moran M,etal.Bisnaphthalimides.2.Synthesis and biological activity of 5,6-acenaphthalimidoalkyl-l,8-naphthalimidoalkyl amines [J].European Journal of Medicinal Chemistry,1995,30(3):235-239.
[5]Bousquet P F,Brana M F,Conlon D,etal.Preclinical evaluation of LU 79553:a novel bisnaphthalimide with potent antitumor activity [J].Cancer Research,1995,55(5):1176-1180.
[6]Nitiss J L,Zhou J,Rose A,etal.The bis(naphthalimide)DMP-840causes cytotoxicity by its action against eukaryotic topoisomerase Ⅱ [J].Biochemistry,1998,37(9):3078-3085.
[7]Eric V Q,Tine M,Patrick D,etal.2,2,2-Trichloro-N-({2- [2-(dimethylamino)ethyl]-1,3-dioxo-2,3-dihydro-1H-benzo[de]iso-quinolin-5-yl}carbamoyl)acetamide (UNBS3157),a novel nonhematotoxic naphthalimide derivative with potent antitumor activity [J].Journal of Medicinal Chemistry,2007,50(17):4122-4134.
[8]Marta S,Agata S M,Kamila K,etal.Synthesis and in vitro biological evaluation of new polyamine conjugates as potential anticancer drugs [J].European Journal of Medicinal Chemistry,2010,45(12):5744-5751.
[9]Ferreira R,Baleizao C,Munoz-Molina J M,etal.Photophysical study of bis(naphthalimide)-amine conjugates:toward molecular design of excimer emission switching [J].The Journal of Physical Chemistry A,2011,115(6):1092-1099.
[10]肖 义,金礼吉.甲基异硫脲阳离子作为连接基的脱氧核糖核酸双嵌入剂:中国:CN200610045945.0[P].2006-03-03.XIAO Yi,JIN Li-ji.DNA bi-intercalator using methyl isothiourea cation as linker:CN200610045945.0[P].2006-03-03.
[11]Tysoe S A, Morgan R J,Baker A D,etal.Spectroscopic investigation of differential binding modes ofΔ-andλ-Ru(bpy)2(ppz)2+with calf thymus DNA [J].The Journal of Physical Chemistry,1993,97(8):1707-1711.
[12]吕 娟,王公轲,张贵生,等.光谱法研究柔红霉素衍生物与DNA相互作用[J].光谱学与光谱分析,2010,30(5):1324-1328.LV Juan,WANG Gong-ke,ZHANG Gui-sheng,etal.Study on the interaction between DNR-D3(daunorubicin derivative) and ctDNA by spectroscopic methods [J].Spectroscopy and Spectral Analysis,2010,30(5):1324-1328.(in Chinese)
[13]林秋月,陆晓红,陈建荣,等.吡啶酰胺与DNA作用的光谱法研究[J].光谱学与光谱分析,2008,28(6):1359-1363.LIN Qiu-yue,LU Xiao-hong,CHEN Jian-rong,etal.Synthesis and DNA-binding properties ofthree compounds containing pyridinecarboxamide[J].Spectroscopy and Spectral Analysis,2008,28(6):1359-1363.(in Chinese)
[14]XIE Li-juan,XU Yu-fang,WANG Fang.Synthesis of new amonafide analogues via coupling reaction and their cytotoxic evaluation and DNA-binding studies [J].Bioorganic & Medicinal Chemistry,2009,17(2):804-810.
[15]陈国珍,黄贤智,郑朱梓,等.荧光分析法[M].北京:科学出版社,1990.CHEN Guo-zhen, HUANG Xian-zhi, ZHENG Zhu-zi,etal.Fluorescence Analysis[M].Beijing:Science Press,1990.(in Chinese)
[16]胡 兴,张国文,李蔚博,等.农药异丙威与小牛胸腺DNA的作用研究[J].分析科学学报,2010,26(2):195-198.HU Xing,ZHANG Guo-wen,LI Wei-bo,etal.Studies on the interaction of aminocarb with calf thymus DNA [J].Journal of Analytical Science,2010,26(2):195-198.(in Chinese)
[17]ZHOU Ying-lin, LI Yuan-zong.Studies of interaction between poly(allylamine hydrochloride)and double helix DNA by spectrol methods [J].Biophysical Chemistry,2004,107(3):273-281.
[18]Maheswari P U,Palaniandavar M.DNA binding and cleavage properties of certain tetrammine ruthenium (Ⅱ )complexes of modified 1,10-phenanthrolines-effect of hydrogen-bonding on DNA-binding affinity [J].Journal of Inorganic Biochemistry,2004,98(2):219-230.

