金振口服液质量标准研究△
刘晓秋,付云云,徐佳佳,潘英妮,秦虹,王振中,萧伟*
(1.沈阳药科大学,辽宁 沈阳 110016;2.江苏康缘药业股份有限公司,江苏 连云港 222001; 3.中药制药过程新技术国家重点实验室,江苏 连云港 222001)
金振口服液质量标准研究△
刘晓秋1*,付云云1,徐佳佳1,潘英妮1,秦虹1,王振中2,3,萧伟2,3*
(1.沈阳药科大学,辽宁 沈阳 110016;2.江苏康缘药业股份有限公司,江苏 连云港 222001; 3.中药制药过程新技术国家重点实验室,江苏 连云港 222001)
目的:提高和完善金振口服液的薄层鉴别和含量测定方法。方法:改进《中国药典》(2010版)中金振口服液项下大黄、黄芩、人工牛黄和甘草薄层鉴别方法。采用HPLC同时测定处方中黄芩苷和甘草酸含量,用Waters C18(150 mm×4.6 mm,5 μm)色谱柱,以乙腈-0.1%甲酸为流动相,梯度洗脱,流速为0.8 mL·min-1,检测波长为250 nm,柱温为室温。结果:简化了供试液的制备方法,4种中药的薄层鉴别共用1个供试品溶液,取样量由120 mL降为10 mL。黄芩苷和甘草酸的质量浓度分别在8.29~99.5 mg·L-1(r=0.999 7,n=5)和3.90~46.8 mg·L-1(r=0.999 2,n=5)与峰面积呈良好的线性关系;平均加样回收率分别为97.6%和97.8%,RSD分别为2.4%和2.6%。结论:改进后的薄层鉴别法简便、易于操作、节约实验样品和实验时间,含量测定方法科学准确、重复性高,均可作为金振口服液的质量控制方法。
金振口服液;薄层色谱鉴别;含量测定
金振口服液收载于《中国药典》2010年版一部,具有清热解毒、祛痰止咳的功能,用于小儿痰热咳嗽的急性支气管炎[1],其疗效可靠、安全性好、依从性高,已列为我国儿童医疗保险品种。金振口服液由羚羊角、平贝母、大黄、黄芩、青礞石、生石膏、人工牛黄、甘草8味药组成,在治疗[2]和辅助治疗小儿支气管炎[3]、抗病毒[4-5]和儿童手足口病[6]等方面具有良好的效果。《中国药典》2010年版一部中采用薄层色谱法鉴别金振口服液中大黄、黄芩、人工牛黄和甘草4味中药,分别制备了3种不同的供试品溶液,且采用热回流、大孔吸附树脂等提取手段,实验操作繁琐,没有体现出薄层色谱法简便易行、协同等优势;含量测定中采用HPLC仅测定了黄芩苷一个指标成分的含量。笔者在前期对金振口服液的药效及质量控制相关性研究中发现,方中除黄芩外,甘草等成分与药效也直接相关,甘草酸是甘草中的特异性成分,常作为甘草及其制剂的指标成分,易于紫外检测。笔者对供试液的制备方法、展开系统、显色方法等进行了考察,简化了该制剂的TLC鉴别法;采用HPLC同时测定制剂中2种主要药效成分黄芩苷和甘草酸的含量,为进一步完善金振口服液质量标准的制订提供实验基础。
1 仪器与试药
LC-20AB高效液相色谱系统、SPD-20A紫外检测器(日本Shimadzu公司),DENVER INSTRUMENT TB-25分析天平(北京丹佛仪器有限公司)。
硅胶G板(自制,薄层色谱用硅胶G,青岛海洋化工有限公司);金振口服液(批号:110608,110609,110610,110611,110612,110613,120203,120306,120214)及处方中的各味中药由江苏康缘药业股份有限公司提供;猪去氧胆酸对照品(批号:0087-9708)、胆酸对照品(批号:0078-9312)、黄芩苷对照品(批号:715-200010)、甘草次酸对照品(批号:723-200109)、甘草酸铵对照品(批号:110731-200615)、大黄对照药材(批号:121249-200402)、甘草对照药材(批号:120904-200512),购自中国食品药品检定研究院;娃哈哈纯净水(杭州娃哈哈集团有限公司),所用试剂均为分析纯。
2 方法及结果
2.1 薄层色谱鉴别
2.1.1 供试品溶液的制备 取金振口服液10 mL,加盐酸1 mL,摇匀,加乙酸乙酯50 mL,超声10 min,分离乙酸乙酯层,蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。
2.1.2 大黄的鉴别 取大黄对照药材0.1 g,加甲醇15 mL,超声30 min,滤过,滤液蒸干,残渣加水10 mL使溶解,转移至圆底烧瓶中,加盐酸1 mL及二氯甲烷15 mL,加热回流1 h,分取二氯甲烷液,水溶液用二氯甲烷振摇提取3次,每次10 mL,合并二氯甲烷液,蒸干,残渣加二氯甲烷1 mL使溶解,作为大黄对照药材溶液。另取大黄阴性样品,同供试品溶液的制备方法制成阴性对照液。照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)试验,吸取大黄对照药材溶液5 μL,供试品溶液10 μL,大黄阴性对照液10 μL,分别点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-甲酸乙酯-甲酸(15∶8∶1)为展开剂,展开,取出,晾干,置紫外灯(365 nm)下检视,结果如图1。供试品色谱中,在与对照药材相应的位置上,显相同颜色的荧光主斑点;置氨蒸气中熏后,日光下检视,显相同的红色斑点,阴性对照无干扰。
2.1.3黄芩的鉴别 取黄芩苷对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为黄芩苷对照品溶液。另取黄芩阴性样品,同供试品溶液的制备方法制成阴性对照液。照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)试验,吸取黄芩苷对照品溶液 5 μL,供试品溶液及黄芩阴性对照液各2 μL,分别点于同一含有4%醋酸钠的羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以乙酸乙酯-丁酮-甲酸-水(5∶3∶1∶1)为展开剂,展开,取出,晾干,喷以5%三氯化铁乙醇溶液[7],加热至斑点显色清晰,结果如图2。供试品色谱中,在与黄芩苷对照品色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。
2.1.4 人工牛黄的鉴别 取胆酸对照品、猪去氧胆酸对照品,分别加甲醇制成每1 mL含1 mg的溶液,分别作为胆酸对照品和猪去氧胆酸对照品。另取人工牛黄阴性样品,同供试品溶液的制备方法制成阴性对照液。照薄层色谱法(《中国药典》2010年版一部附录ⅥB)试验,吸取胆酸对照品溶液、猪去氧胆酸对照品溶液5 μL,供试品溶液及人工牛黄阴性对照液各2 μL,分别点于同一硅胶G薄层板上,以正己烷-乙酸乙酯-甲酸-甲醇(3∶6∶0.5∶0.5)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰,结果如图3。供试品色谱中,在与胆酸对照品和猪去氧胆酸对照品色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。
2.1.5 甘草的鉴别 取甘草对照药材1 g,加乙醚40 mL,加热回流1 h,滤过,弃去滤液,药渣加甲醇30 mL,加热回流1 h,滤过,滤液蒸干,残渣加水40 mL使溶解,用正丁醇提取3次,每次20 mL,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液蒸干,残渣加甲醇5 mL使溶解,作为甘草对照药材溶液。另取甘草次酸对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为甘草次酸对照品溶液。另取甘草阴性样品,同供试品溶液的制备方法制成阴性对照液。照薄层色谱法(《中国药典》2010年版一部附录Ⅵ B)试验,吸取甘草对照药材溶液5 μL,供试品溶液及甘草阴性对照液各2 μL,分别点于同一硅胶G薄层板上,石油醚-正己烷-乙酸乙酯-冰醋酸(10∶15∶7∶0.5)为展开剂,展开,取出,晾干喷以2%硫酸乙醇溶液[8],加热至斑点显色清晰,结果如图4。供试品色谱中,在与甘草对照药材色谱相应的位置上,显相同颜色的荧光斑点和相同的橙黄色斑点,阴性对照无干扰。
2.2 含量测定
2.2.1 对照品溶液的制备 分别精密称取黄芩苷对照品10.0 mg,甘草酸铵对照品5.0 mg,分别置25 mL量瓶中,加甲醇溶解至刻度,得黄芩苷对照品贮备溶液和甘草酸铵对照品贮备溶液。分别精密吸取上述各贮备溶液10 mL,置25 mL量瓶中,加甲醇稀释至刻度,混匀,得混合对照品贮备溶液。精密吸取混合对照品贮备溶液0.5,1,2,4,6 mL,置10 mL量瓶中,加甲醇至刻度,即得各浓度混合对照品溶液。
2.2.2 供试品溶液的制备 精密量取金振口服液1 mL,置25 mL量瓶中,加水溶解并稀释至刻度,摇匀,用0.45 μm滤膜滤过,取续滤液,即得。
2.2.3 阴性对照溶液的制备 按处方比例分别称取除黄芩、除甘草、除黄芩和甘草以外的其余中药,按金振口服液的制备工艺分别制备缺黄芩、缺甘草、缺黄芩和甘草的阴性样品。按2.2.2项方法操作,分别制成缺黄芩、缺甘草、缺黄芩和甘草的阴性对照溶液。

1.大黄对照药材2.金振口服液3.大黄阴性对照液图1 金振口服液中大黄TLC鉴别

1.黄芩苷对照品2.金振口服液3.黄芩阴性对照液图2 金振口服液中黄芩TLC鉴别

1.胆酸对照品 2.猪去氧胆酸对照品3.金振口服液4.人工牛黄阴性对照液图3 金振口服液中人工牛黄TLC鉴别

1.甘草对照药材2.甘草次酸对照品3.金振口服液4.甘草阴性对照液图4 甘草TLC鉴别
2.2.4色谱条件 色谱柱:Waters C18(150 mm×4.6 mm,5 μm),流动相:乙腈(A)-0.1%甲酸溶液(B);梯度洗脱程序:0~5 min:29%A;5~12 min:29%~47%A;12~17 min:47%~50%A;17~20 min:50%A;流速:0.8 mL·min-1;检测波长:250 nm;柱温:室温;进样量20 μL。
2.2.5 线性关系考察 取2.2.1项各浓度混合对照品溶液,按2.2.4项色谱条件测定。以对照品质量浓度为横坐标(X,mg·L-1),以峰面积为纵坐标(Y),绘制标准曲线,黄芩苷和甘草酸回归方程分别为Y=2.674×104X-2.594×104(r=0.999 7),Y=1.939×104X+1.280×104(r=0.999 2)。表明黄芩苷质量浓度在8.29~99.5 mg·L-1,甘草酸质量浓度在3.90~46.8 mg·L-1(相当于甘草酸铵质量浓度3.98~47.8 mg·L-1)线性关系良好。
2.2.6 专属性试验 取2.2.3项阴性对照溶液,在2.2.4色谱条件下进样,观察被测组分峰保留时间处是否有其他组分峰干扰。结果表明被测组分峰保留时间处无其他组分峰干扰,即阴性对照溶液对供试品测定无干扰,见图5。
2.2.7 精密度试验 精密吸取同一混合对照品溶液,按2.2.4项色谱条件,连续进样6次,测定黄芩苷和甘草酸的峰面积,计算RSD分别为1.7%,1.2%,表明仪器精密度良好。
2.2.8 稳定性试验 取金振口服液(批号:110608)按2.2.2项制备供试品溶液,分别在0,2,4,6,8,12 h按2.2.4项色谱条件进样分析,测定黄芩苷和甘草酸的峰面积,计算RSD分别为2.0%,1.8%。表明金振口服液供试溶液在12 h内稳定。
2.2.9 重复性试验 取金振口服液(批号:110608)按2.2.2项平行制备供试品溶液6份,按2.2.4项色谱条件进样分析,计算黄芩苷和甘草酸含量的RSD分别为1.6%和1.9%。结果表明该方法重复性良好。
2.2.10 加样回收率试验 精密吸取已知含量的金振口服液供试品(批号:110608)9份,每份0.5 mL,分别置25 mL量瓶中,分别加黄芩苷和甘草酸对照品贮备溶液适量,按2.2.2项操作,按2.2.4色谱条件测定,计算加样回收率。结果见表1。

表1 金振口服液中黄芩苷和甘草酸的回收率试验
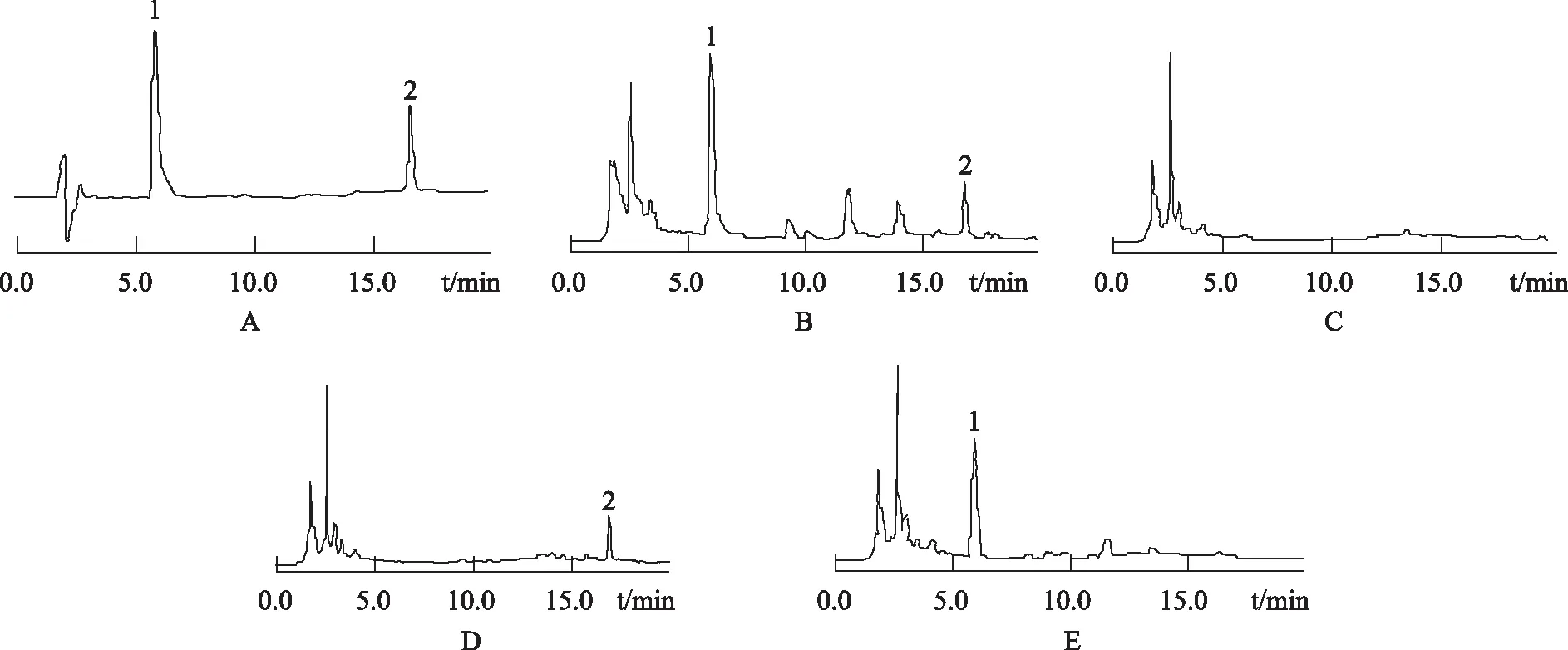
1.黄芩苷 2.甘草酸A.混合对照品 B.供试品 C.缺黄芩和甘草的阴性对照品 D.缺黄芩的阴性对照品 E.缺甘草的阴性对照品图5 金振口服液及对照品HPLC图
2.2.11 样品含量测定 取9批样品,按2.2.2项制备供试品溶液。按2.2.4色谱条件进样分析,记录峰面积值,依照标准曲线法计算样品中黄芩苷和甘草酸含量,结果见表2。

表2 金振口服液中黄芩苷和甘草酸的含量测定 /mg·L-1
3 讨论
3.1 TLC鉴别供试液制备方法的简化
《中国药典》2010版金振口服液项下大黄、黄芩、人工牛黄和甘草的薄层鉴别合计取样量为120 mL,共制备了3个供试品溶液,本研究取样量仅需10 mL,用1个供试品溶液,取样量明显减少,不仅节约样品,并且减化了繁琐的供试液制备过程,节约了实验成本。文献报道[9-11]人工牛黄、甘草、黄芩以及大黄主要药效成分分别为甾体胆酸类、三萜类和黄酮类以及蒽醌类,均具有一定的酸性,因此在制剂萃取过程加入盐酸可有效提高药效成分提取率,实验结果表明乙酸乙酯有利于黄芩、大黄、甘草、人工牛黄药效物质的提取,故可同时用于大黄等4种中药薄层鉴别的供试品溶液制备。
3.2 TLC鉴别色谱条件的优选
实验展开系统替换了《中国药典》中黄芩、人工牛黄和甘草薄层鉴别项中有毒溶剂甲苯和三氯甲烷,减少对实验操作人员身体和环境的危害。同时,实验结果表明人工牛黄和甘草的薄层色谱采用硫酸乙醇显色斑点清晰,与《中国药典》方法相比,实验方法显色方便,且色谱斑点集中,分布均匀,Rf值更好。
3.3 含量测定波长的选择
由黄芩苷和甘草酸紫外全波长扫描发现,甘草酸在250 nm有最大吸收,黄芩苷在280,320 nm附近有较大吸收,其相应信号要比甘草酸的响应信号强,通过二极管阵列检测器,检查在280,250 nm计算黄芩苷对含量没有显著差异。为了提高对甘草酸的检测灵敏度,本实验选择250 nm为检测波长,该波长下样品中黄芩苷和甘草酸均可被检出,且分离度良好。
3.4 样品含量测定结果
9批样品含量测定结果显示,金振口服液中黄芩苷的含量在0.55 mg·mL-1以上,符合《中国药典》规定(含量不少于0.25 mg·mL-1)。各批制剂中均可明显检测出甘草酸的色谱峰,其含量较高且稳定,均在0.24 mg·mL-1以上,建议《中国药典》2015年版增加甘草的含量测定,以提高该制剂的质量标准。
3.5不同批次样品中的含量差异
不同批次样品中黄芩苷和甘草酸的含量存在一定差异,应密切关注生产过程中中药来源、提取转移率、中间体的稳定性及制剂成型性等,以确保金振口服液质量的稳定可靠。
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:829-830.
[2] 李娅凤,平雯.金振口服液治疗小儿支气管炎临床观察[J].现代中西医结合杂志,2006,15(4):467.
[3] 张晓红.金振口服液辅佐治疗小儿急性支气管炎疗效观察[J].现代中西医结合杂志,2010,19(17):214.
[4] 萧伟,郑丽舒,尚强,等.金振口服液抗甲型H1N1流感病毒作用实验研究[J].中草药,2009,40(9):1443-1445.
[5] 侯安存,刘玉华,辛德莉,等.金振口服液体外抑制呼吸道合胞病毒、SARS病毒及肺炎支原体进行实验研究[J].中国基层医药,2009,16(8):1454-1455.
[6] 徐航,韩国坤,李红芳,等.金振口服液治疗儿童手足口病普通型96例临床观察[J].河北中医,2011,33(2):259-260.
[7] 赵志军,王连水.小柴胡颗粒薄层鉴别及黄芩苷含量测定方法的研究[J].中国实验方剂学杂志,2005,11(3):2223.
[8] 王慕邹.常用中草药高效液相色谱分析[M].北京:科学出版社,1999:79.
[9] 严克东,张启明,王玉萍.培植牛黄与天然牛黄化学成分比较研究[J].中药材,1990,13(10):11.
[10] 李彤彤,李宏,侯茂君,等.黄芩化学成分及黄芩苷提取方法研究进展[J].天津药学,2002,14(3):7-8.
[11] 李秀才.大黄的研究进展[J].中国药学杂志,1998,33(10):581-584.
StudiesonQualityStandardofJinzhenOralLiquid
LIU Xiao-qiu1*,FU Yun-yun1,XU Jia-jia1,PAN Ying-ni1,QIN Hong1,WANG Zhen-zhong2,3,XIAO Wei2,3*
(1.ShenyangPharmaceuticalUniversity,Shenyang110016,China;2.JiangsukangyuanPharmaceuticalCompanyLimited,Lianyungang222001,China;3.StateKeyLaboratoryofNew-techforChineseMedicinePharmaceuticalProcess,Lianyungang222001,China)
Objective:To Improve TLC identification and determination for Jinzhen oral liquid.Methods:Improve the TLC identification of Rhei Radix Et Rhizoma,Scutellariae Radix,Bovis Calculus Artifactus and Glycyrrhizae Radix Et Rhizoma for Jinzhen oral liquid in Edition 2010 of Chinese Pharmacopoeia.The contents of baicalin and glycyrrhizic acid were determined simultaneously by HPLC.The HPLC was conducted on Waters C18column at room temperature.The mobile phase consisted of acetonitrile and 0.1% formic acid solution with gradient elution,the flow is 0.8 mL·min-1,wavelength is 250 nm.Results:The four test solution of the of Rhei Radix Et Rhizoma,Scutellariae Radix,Bovis Calculus Artifactus and Glycyrrhizae Radix Et Rhizoma were simplified into one.The sampling volume was reduced from 120 mL to 10 mL.The linear ranges were 8.29-99.5 mg·L-1for baicalin(r=0.999 7,n=5)and 3.90-46.8 mg·L-1for glycyrrhizic acid(r=0.999 2,n=5),respectively.The average recoveries rates were 97.6 % with RSD 2.4% for baicalin and 97.8% with RSD 2.6% for glycyrrhizic acid.Conclusion:The improved TLC identification method is simple,could save samples and time.The content determination is scientific,accurate,with high repeatability and could be used for the quality control of Jinzhen oral liquid.
Jinzhen oral liquid;TLC identification;Baicalin;Glycirrizic acid;Determination
2013-04-16)
中药制剂过程新技术国家重点实验室开放基金课题(SKL2010M0202)
*
刘晓秋,教授,博士生导师,主要从事中药质量标准化研究和新药研究,Tel:(024)23986469,E-mail:liuxiaoqiu3388@163.com;萧伟,研究员及高级工程师,从事中药新药剂型的研究与开发,E-mail:wzhzh-nj@tom.com

