巨噬细胞炎性蛋白1α在小鼠深静脉血栓模型中的表达及其意义*
刘海平,赵学凌,吴雪梅,李兴国,郑宏宇
(昆明医学院第一附属医院骨科,昆明 650032)
深静脉血栓(deep vein thrombosis,DVT)因其并发致命性的肺血栓栓塞症(pulmonary thromboembolism,PTE)及难治性的静脉血栓后遗症(postthrombotic syndrome,PTS)而引起临床、科研的极大关注[1]。在DVT到PTE、PTS过程中,血栓栓子的溶解、再通成为影响DVT预后的决定因素[2]。研究发现,与机体损伤修复过程相似,血栓形成后,单核细胞/巨噬细胞在各种趋化因子的诱导下聚集于血栓形成部位,参与栓子的溶解过程[3-4]。巨噬细胞炎性蛋白-1α(macrophage inflamma-tory protein 1α,MIP-1α)因其较强的趋化单核细胞/巨噬细胞作用而逐渐引起重视[5]。本研究拟在建立小鼠DVT模型的基础上观察血栓形成后MIP-1α的表达及其与血栓溶解的关系,为临床DVT的防治提供理论依据。
1 材料与方法
1.1 动物与试剂 100只昆明种小鼠购买于成都军区昆明总医院医学动物实验中心[动物质量合格证号:SYXK(滇)2005-0008],体质量18~22g,雌雄不限,适应性喂养1周后造模。实验对动物的处理方法符合中华人民共和国科技部颁发的《关于善待实验动物的指导性意见》[6]。Trizol试剂、SYBR@Premix Ex TaqTMⅡ 试剂盒购买于大连宝生物工程有限公司,MIP-1αELISA试剂盒购于美国RB公司,MIP-1α中和抗体(300μg/mL)购于美国Peprotecch公司,Q/CYAE111-2000显微手术器械购于上海医疗器械有限公司。
1.2 小鼠DVT模型的建立及分组 100只昆明种小鼠随机分为对照组(n=10)和模型组(n=90)。模型组以3%的戊巴比妥钠(1mL/kg)麻醉后,常规消毒铺巾,沿腹中线纵轴切2.0 cm切口,分离皮下组织至腹腔,将腹腔内容物轻轻推向左侧,暴露、分离下腔静脉,结扎可视侧支,神经血管钳钳夹约1.0 cm长的近远端各30s,5-0聚丙烯缝线沿下腔静脉纵轴放置,钳夹段血管中段以4-0的丝线连同静脉管壁及聚丙烯缝线结扎,随后抽出聚丙烯缝线,制造狭窄管腔。逐层闭合切口,术后均未应用任何抗生素,自由进饮食。参照文献[7-8],将模型组分为2个亚组:DVT组(小鼠不加任何干预,n=45)和DVT+MIP-1α-Ab组(小鼠造模后予以MIP-1α中和抗体0.5mL持续腹腔注射7d,n=45);随后各亚组于2、4、8、12、21d5个时间点各取8只小鼠过量麻醉处死,取静脉壁及栓子进行检测。根据文献[9]报道,以血栓栓子的质量/长度比值观察血栓溶解程度。
1.3 实时荧光定量PCR反应 cDNA制备:将小鼠过量麻醉处死后,冰盘上取静脉及血栓组织50~100mg,立即放入Trizol试剂中进行RNA抽提。以260nm及280nm吸光度值计算所获RNA含量及纯度,分装后-80℃保存。逆转录过程按试剂盒说明书操作。PCR引物设计:MIP-1α引物设计根据标准荧光定量PCR引物设计原则,应用Primer 5.0程序设计,引物由上海生工公司合成。见表1。
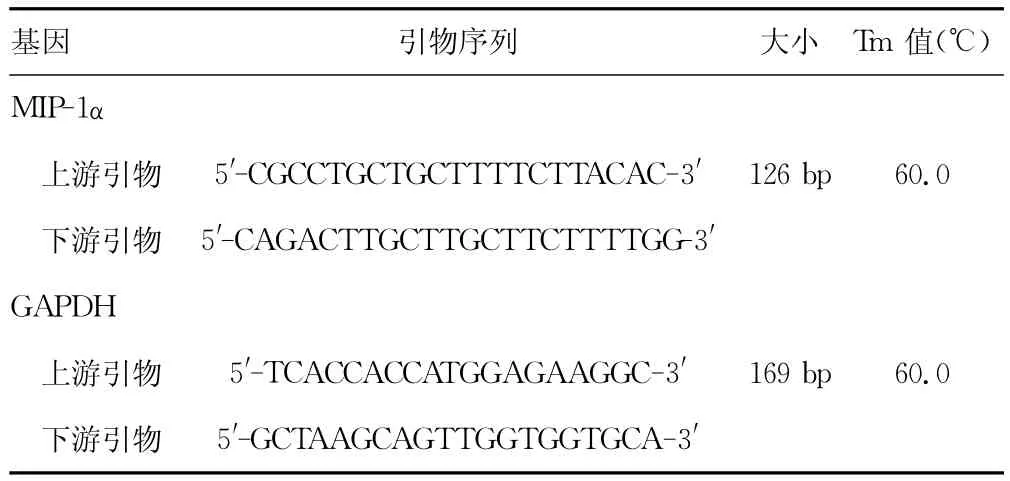
表1 引物设计
PCR 过程:SYBR@Premix Ex TaqTM(2×)12.5μL、MIP-1α/GAPDH 上游引物(10pmol/L)1μL、MIP-1α/GAPDH 下游引物(10pmol/L)1μL、模板cDNA 2μL、dd H2O 8.5μL(总体积25μL)于PCR反应管中,扩增条件如下:(1)95℃3min预变性;(2)95℃20s变性,60℃30s退火延伸,40个循环。
实时荧光定量PCR分析:分别测定每个样品 MIP-1α和GAPDH mRNA的Ct值,每个样品均作复孔以减少操作误差。Ct值表示每个反应管内的荧光信号达到设定的阈值时所经历的循环数,每个模板的Ct值与该模板的起始拷贝数的对数呈线性关系,起始拷贝数越多,Ct值越小。采用相对定量方式表示各样品 MIP-1α的ΔCt,ΔCt=Ct目的基因-Ct内参基因。再依据ΔΔCt=ΔCt目的基因-ΔCt参照基因,计算2-ΔΔCt。当目的基因与内参基因的扩增效率接近时,2-ΔΔCt表示所检测样品相对于作为参照因子样品的目的基因的表达倍数。对PCR反应过程中的每一循环的系统荧光强度进行实时监测,根据扩增曲线确定Ct值,利用2-ΔΔCt法计算MIP-1αmRNA相对拷贝数。
1.4 ELISA检测下腔静脉及血栓组织中MIP-1α表达 取10 g静脉及血栓样品匀浆化,称取3g匀浆化组织样品,转至玻管中,加6mL乙酸乙酯充分混合10min,2 000r/min离心10 min,随后4mL乙酸乙酯加入玻管中,在50℃温和氮流下蒸发掉乙酸乙酯。将残留物溶于1mL正己烷中,再加入1mL稀释缓冲液,涡旋混合1min,2 000~3 000r/min离心10min,如上层发生乳化,可将试管50℃水浴5min后再次3 000r/min离心,移取50μL(2g组织/mL)用于检测。
1.5 统计学处理 实验重复检测3次,使用SPSS11.5统计学软件进行统计学分析,计量资料采用表示,两组间比较采用t检验,多组组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 实验动物一般状况 模型组有1只小鼠因严重感染死亡,89只用于实验。所有小鼠于建模后2d解剖观察,模型组造模段静脉均有血栓形成,管壁暗红,轻压不瘪。
2.2 实时荧光定量PCR及ELISA检测结果 结果显示,DVT组MIP-1αmRNA、蛋白随时间点的改变呈逐渐升高趋势,8d升至最高点(P<0.05),后呈逐渐下降趋势,DVT+MIP-1α-Ab组 MIP-1αmRNA、蛋白表达亦呈上述趋势,但差异无统计学意义(P>0.05),相同时间点DVT组 MIP-1αmRNA、蛋白变化较为明显(P<0.05)。见图1。
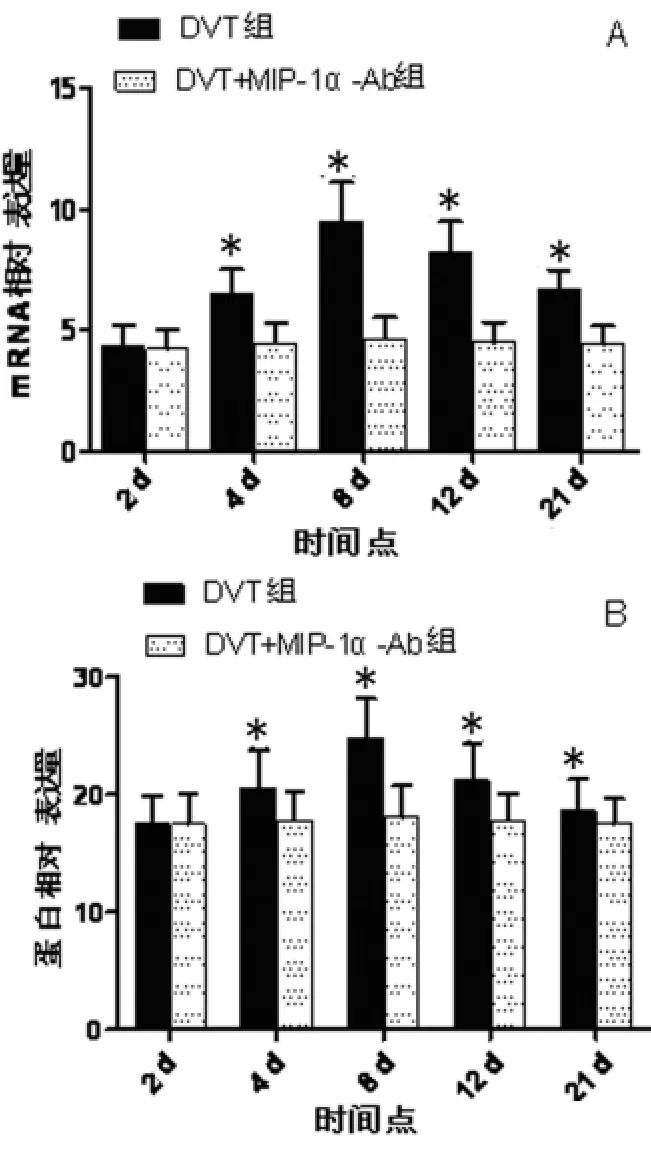
图1 各亚组不同时间点MIP-1αmRNA及蛋白的相对表达
2.3 血栓栓子质量/长度比值 造模后各亚组于2、4、8、12、21d5个时间点分别处死8只小鼠,切取造模段血管,结果显示DVT组及DVT+MIP-1α-Ab组栓子质量/长度比值随时间的延长呈逐渐缩小的趋势(P<0.05),相同时间点DVT组血栓栓子质量/长度比值减小更为明显(P<0.05)。见图2。
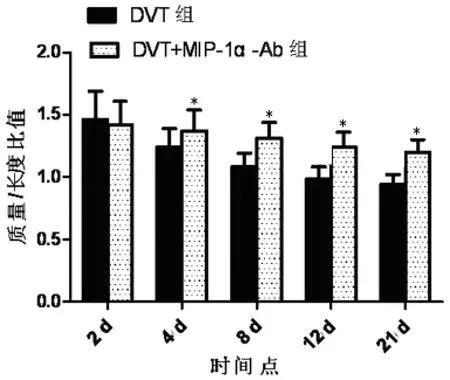
图2 各亚组不同时间点血栓质量/长度比值
3 讨 论
小鼠DVT模型的建立及血栓溶解规律DVT因其较高的发病率、病死率深受外科领域的关注[10]。在本研究中,参照文献报道由神经血管钳钳夹联合结扎下腔静脉建立小鼠DVT模型,符合静脉内皮细胞损伤及静脉血流淤滞的条件。在实验中作者观察到建模后小鼠DVT在2d内形成,提示在急性静脉内皮细胞损伤及静脉血流淤滞的条件下,2d内机体对损伤处于强烈应激状态,这种强烈反应状态易诱发病理性血栓形成过程;在本次研究中,模型组小鼠于血栓形成后栓子随时间的延长而呈逐渐缩小的趋势,2周后栓子基本无变化,这与文献报道相一致[11]。
研究发现,DVT的溶解、机化、再通过程取决于3个因素:局部静脉微环境中纤溶系统的激活,静脉壁、血栓栓子中基质金属蛋白酶系统的活性,血栓栓子中血管新生情况[12]。现已得到共识:DVT形成及溶解、机化、再通是一个炎症及免疫反应参与的过程,与机体组织的损伤修复过程类似,DVT的溶解、机化、再通过程伴随着中性粒细胞、巨噬细胞等炎性细胞的活化、迁移、浸润,表达各种细胞因子如IL-1β、TNF-γ等,这些炎性/免疫细胞因子可活化影响血栓栓子溶解、再通的下游调控基因u-PA、MMPs等,从而促进血栓栓子的溶解、再通[13-14]。
MIP-1α是趋化因子C-C家族成员,主要由巨噬细胞、单核细胞、中性粒细胞、成纤维细胞产生,局部组织中产生的MIP-lα能特异性地趋化淋巴细胞、单核细胞向炎症、损伤部位迁移,促进损伤部位的自我修复过程[15]。Chen等[16]在大鼠DVT模型造模后腹腔注射rh G-CSF后发现,血栓栓子中MIP-1α、MCP-1在栓子中呈逐渐升高趋势,同时单核细胞、巨噬细胞在术后3d显著升高,与血栓栓子缩小程度相一致,这提示MIP-1α在DVT溶解中起重要作用。
在本研究中作者观察到,DVT组造模段静脉及其血栓栓子中的MIP-1αmRNA、蛋白随时间点的改变呈逐渐升高趋势,8d升至最高点(P<0.05),后呈逐渐下降趋势;同时,血栓栓子的质量/长度比值亦随时间点的改变而呈逐渐缩小趋势;在应用 MIP-1α中和抗体腹腔注射后,DVT+MIP-1α-Ab组MIP-1αmRNA、蛋白表达虽呈上述趋势,但差异无统计学意义(P>0.05);相同时间点DVT组血栓栓子质量/长度比值减小较DVT+MIP-1α-Ab组更为明显(P<0.05)。提示 MIP-1α在DVT形成后参与了栓子的溶解过程,MIP-1α中和抗体可阻滞其溶解血栓的作用。
值得注意的是,在血栓形成后 MIP-1αmRNA、蛋白的表达在8d左右达到高峰,而栓子的质量/长度比值呈逐渐下降的趋势,这提示在血栓栓子溶解过程中还有其他参与因素,MIP-1α的作用主要表现在血栓形成后2周内。分析后作者认为,在血栓形成后,局部静脉微环境处于损伤应激状态,此时中性粒细胞/巨噬细胞在MIP-1α等趋化因子的诱导下迁徙到血栓形成部位,参与局部静脉的损伤修复;在1~2周后,栓子的溶解、缩小主要为血栓再通作用引起。
在本研究中作者通过建立小鼠下腔静脉DVT模型观察MIP-1α与血栓溶解之间的关系,进而应用MIP-1α中和抗体明确其促进血栓溶解的作用;在实验中未能进一步明确其促进血栓溶解的确切机制,有待于下一步研究。
[1]Heit JA.The epidemiology of thromboembolism in the community[J].Arterioscler Thromb Vasc Biol,2008,28(3):370-372.
[2]Sakuma M,Nakamura M,Yamada N,et al.Venous thromboembolism:deep vein thrombosis with pulmonary embolism,deep vein thrombosis alone,and pulmonary embolism alone[J].Circ J,2009,73(2):305-309.
[3]Günzl P,Bauer K,Hainzl E,et al.Anti-inflammatory properties of the PI3Kpathway are mediated by IL-10/DUSP regulation[J].Leukoc Biol,2010,88(6):1259-1269.
[4]Henke PK,Wakefield T.Thrombus resolution and vein wall injury:dependence on chemokines and leukocytes[J].Thromb Res,2009,123(Suppl 4):S72-S78.
[5]Yuan Y,Li P,Ye J.Lipid homeostasis and the formation of macrophage-derived foam cells in atherosclerosis[J].Protein Cell,2012,3(3):173-181.
[6]中华人民共和国科学技术部.关于善待实验动物的指导性意见[EB/OL].(2006-09-30)[2011-06-15].http://www.most.gov.cn/fggw/zfwj/zfwj2006/200609/t20060930_54389.htm.
[7]Humphries J,Gossage JA,Modarai B,et al.Monocyte urokinase-type plasminogen activator up-regulation reduces thrombus size in a model of venous thrombosis[J].J Vasc Surg,2009,50(5):1127-1134.
[8]莫建文,黄河,张春强,等.创伤性深静脉血栓形成中补体相关基因表达变化的实验研究[J].中国急救医学,2008,3(28):244-246.
[9]Henke PK,Varga A,De S,et al.Deep vein thrombosis resolution is modulated by monocyte CXCR2-mediated activity in a mouse model[J].Arterioscler Thromb Vasc Biol,2004,24(6):1130-1137.
[10]邓姝.预防关节置换术后深静脉血栓的管理措施[J].重庆医学,2011,40(10):969-970.
[11]李玉林.病理学[M].7版.北京:人民卫生出版社,2008:608.
[12]Hallevi H,Walker KC,Kasam M,et al.Inflammatory response to intraventricular hemorrhage:time course,magnitude and effect of t-PA[J].J Neurol Sci,2012,315(1/2):93-95.
[13]Wakefield TW,Henke PK.The role of inflammation in early and late venous thrombosis:are there clinical implications[J].Semin Vasc Surg,2005,18(3):118-129.
[14]张利,张永川,赵渝.深静脉血栓形成后综合征研究进展[J].重庆医学,2011,40(11):1123-1125.
[15]Smits HA,Rijsmus A,van Loon JH.Amyloid-beta-induced chemokine production in primary human macro-phages and astroeytes[J].J Neurolrnrnunol,2002,127(1/2):160-168.
[16]Chen YK,Jiang XM,Gong JP.Recombinant human granulocyte colony-stimulating factor enhanced the resolution of venous thrombi[J].J Vasc Surg,2008,47(5):1058-1065.

