荔枝核总黄酮抗肝纤维化作用的实验研究*
罗伟生,欧士钰,靳雅玲,覃 浩,孙旭锐,喻 勤,傅向阳
(1.桂林医学院附属医院消化内科,广西桂林 541001;2.广西中医药大学第一附属医院消化科,南宁 530001)
肝纤维化是肝脏细胞外基质的合成与降解平衡被破坏,导致细胞外基质过度沉积的病理过程,是各种慢性肝病进一步向肝硬化发展的必经阶段[1-2]。目前认为,肝纤维化乃至早期肝硬化均可逆[3]。因此,对肝纤维化的防治具有重要意义。荔枝为广西东南部特产,其核仁作为广西特色中药已有几千年的应用历史。荔枝核总黄酮(total flavone from Litchi chinensis Sonn,TFL)是从荔枝核提取的有效药理成分。实验研究表明,TFL可通过促进活化肝星状细胞(hepatic stellate cell,HSC)凋亡而发挥抗肝纤维化作用[4]。本实验旨在进一步观察TFL抗肝纤维化作用,并对其可能机制进行探讨。
1 材料与方法
1.1 材料 本实验采用40只健康雄性SD大鼠,SPF级,质量(200±20)g,由桂林医学院实验动物中心提供(合格证号:SCXK桂2007-0001)。主要试剂及药品:丙二醛(malondialdehyde,MDA)测试盒,超氧化物歧化酶(superoxide dismutase,SOD)测试盒购于南京建成生物工程研究所;兔抗大鼠核转录因子-κB(nuclear transcription factors-kappa B,NF-κB)多克隆抗体购于北京中杉金桥生物技术有限公司;免疫组织化学二抗试剂、3,3′-二氨基联苯胺(3,3′-Diaminobenzidine,DAB)显色购于福建迈新生物科技有限公司;秋水仙碱-二甲基亚硝胺(DMN)购于Sigma公司;TFL购于广州广弘中药材公司,经鉴定为无患子科植物荔枝的成熟种子,桂林医学院药理实验室提取分离,荔枝核总黄酮含量达54.2%,用蒸馏水稀释为40g/L溶液。
1.2 方法
1.2.1 大鼠分组及处理 大鼠随机分为正常对照组、模型组、TFL给药组、秋水仙碱组,每组10只。正常对照组以等体积的生理盐水灌胃。模型组、TFL给药组、秋水仙碱组按Ala-Kokko等方法腹腔注射0.5%DMN制作肝纤维化模型[5]。造模与给药同时。模型组、TFL给药组、秋水仙碱组分别用5 mL/kg生理盐水、200mg·kg-1·d-1TFL及0.1mg·kg-1·d-1秋水仙碱灌胃[4],每日1次,共6周。6周后处死大鼠,抽取下腔静脉血,常规分离血清,取部分肝脏组织加冷生理盐水制成10%肝组织匀浆,取同一部位新鲜肝脏组织固定于体积分数为10%的中性甲醛溶液中1d,制作石蜡切片。大鼠处死前禁食不禁水24h。
1.2.2 血清及肝组织匀浆生化指标检测 血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)用全自动生化分析仪测定,严格按试剂盒说明进行MDA、SOD指标的检测。
1.2.3 肝组织病理学检查 苏木素-伊红(hematoxylin and eosin staining,HE)染色、马松染色按常规方法进行。纤维化分级评分参照2002年中华肝脏病学会肝纤维化分级法进行胶原纤维增生程度半定量分析[6],最低0分,最高29分;得分越高,表示纤维化程度越重。
1.2.4 免疫组化检测NF-κB蛋白的表达 防脱切片经过常规脱蜡、脱水;2% 乙二胺四乙酸二钠(ethylenediaminetetraaceticacid,EDTA)高温修复20min冷却后磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗;3%过氧化氢(hydrogen peroxide,H2O2)阻断10min,PBS冲洗;滴加NF-κB多克隆抗体(1∶200),1h后PBS洗;滴加二抗,15min后PBS冲洗;DAB显色;苏木精复染,常规脱水,透明,中性树胶封固,光镜下观察。用已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。NF-κB p65采用半定量计分方法,以细胞核或胞浆呈棕黄色为(+)。参照免疫组化显色标准[7]:按显色程度分弱、中、强3种,分别记以1、2、3分。每个指标的每个标本,取10个较好的高倍视野,按显色范围分为4度:+为显色范围占高倍视野小于25%;++为显色占高倍视野25%~50%;+++为显色占高倍视野>50%~75%;++++为显色占高倍视野大于75%。将每个高倍视野显色程度和范围换算成显色指数,显色指数=显色程度×显色范围(+为1分、++为2分、+++为3分、++++为4分),取其均数作为每个检测指标的最终显色指数。
2 结 果
2.1 一般情况 实验过程中共有4只大鼠死亡,尸检及肝脏HE染色检查,死因均为急性肝衰竭,死亡动物不计入统计学处理。
2.2 TFL对肝纤维化大鼠血清AST、ALT水平的影响 模型组AST、ALT水平最高,与正常对照组比较差异有统计学意义(P<0.05),TFL给药组、秋水仙碱组ALT、AST水平明显低于模型组(P<0.05)。TFL给药组ALT、AST与秋水仙碱组比较差异有统计学意义(P<0.05)。见表1。
表1 TFL对各组大鼠血清AST、ALT水平的影响()

表1 TFL对各组大鼠血清AST、ALT水平的影响()
*:P<0.05,与正常对照组比较;#:P<0.05,与模型组比较;△:P<0.05,与秋水仙碱组比较。
组别 n ALT(U/L) AST(U/L)10 45.45±11.05 84.95±14.50模型组 8 194.63±22.86* 293.99±23.78*TFL给药组 9 109.78±18.69*#△ 156.50±26.29*#△秋水仙碱组 9 147.11±27.29*# 213.83±31.53*#正常对照组
2.3 TFL对肝纤维化大鼠肝组织MDA、SOD的影响 与正常对照组比较,模型组大鼠肝组织MDA含量显著升高,SOD含量明显减低(P<0.05)。与模型组比较,TFL给药组大鼠肝组织MDA的含量明显降低,SOD含量显著升高(P<0.05)。TFL给药组与秋水仙碱组比较差异无统计学意义(P>0.05)。结果提示:TFL能显著降低DMN诱导的肝纤维化大鼠肝组织中MDA含量,升高SOD含量。见表2。
表2 TFL对各组大鼠肝组织MDA、SOD的影响()

表2 TFL对各组大鼠肝组织MDA、SOD的影响()
*:P<0.05,与正常对照组比较;#:P<0.05,与模型组比较;△:P>0.05,与秋水仙碱组比较。
组别 n MDA(nmol/mg) SOD(U/mg)10 6.19±1.35 345.30±20.02模型组 8 15.08±2.93* 242.73±48.32*TFL给药组 9 8.54±1.96*#△ 286.68±30.15*#△秋水仙碱组 9 8.64±2.30*# 276.60±29.26*#正常对照组
2.4 肝组织病理学检测结果 光镜观察,与正常对照组相比,模型组肝细胞索排列紊乱,肝细胞水肿,脂肪变性,增生纤维分割、包绕肝小叶,多数正常小叶结构破坏或消失,汇管区周围粗大胶原沉积,纤维隔内大量炎细胞浸润。TFL给药组和秋水仙碱组HE、马松染色均显示肝细胞水肿及变性不明显,肝小叶结构破坏明显减轻,胶原纤维增生较少,纤维疏松变窄,炎性细胞浸润较少。见图1、表3。
2.5 免疫组化NF-κB p65蛋白表达结果 正常肝组织NF-κB呈弱阳性表达,分布在汇管区、窦周及少数肝细胞中,显色淡;模型组NF-κB呈强阳性表达,与正常对照组比较表达明显增强(P<0.05),主要表达于汇管区和纤维间隔及肝细胞中,显色最深呈棕黄色;TFL给药组NF-κB蛋白表达与模型组比较明显下降(P<0.05),显色较淡;秋水仙碱组NF-κB蛋白表达水平低于模型组(P<0.05)。TFL给药组与秋水仙碱组比较具有统计学意义(P<0.05)。见图2、表3。
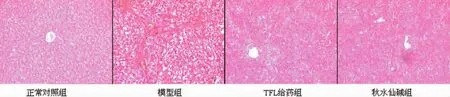
图1 各组肝组织光镜检查(HE×100)
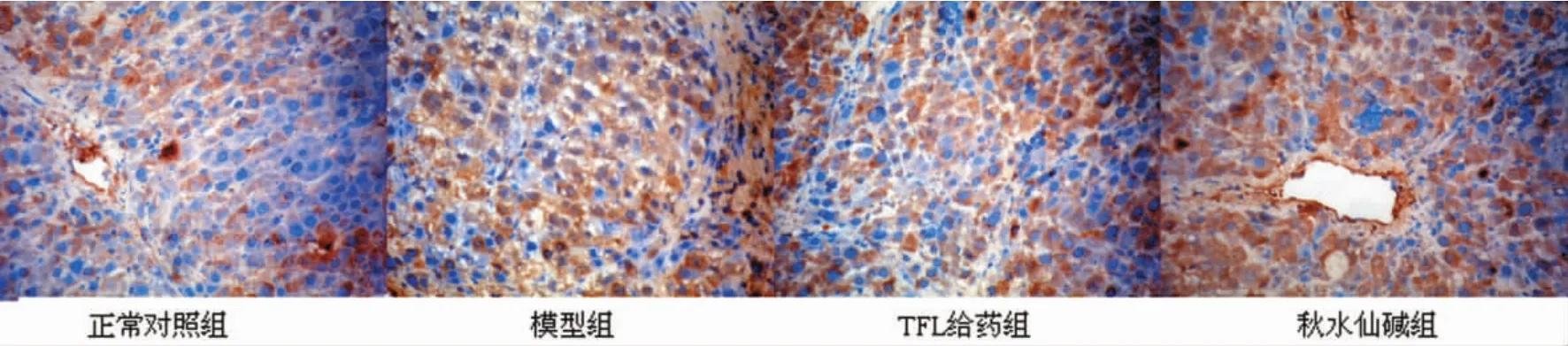
图2 各组肝组织NF-κB蛋白的表达(×400)
表3 各组肝组织纤维化评分及NF-κB表达情况()
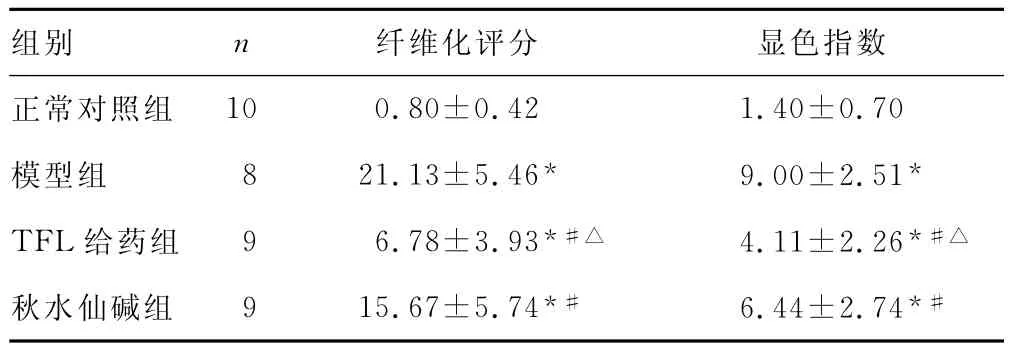
表3 各组肝组织纤维化评分及NF-κB表达情况()
*:P<0.05,与正常对照组比较;#:P<0.05,与模型组比较;△:P<0.05,与秋水仙碱组比较。
组别 n 10 0.80±0.42 1.40±0.70模型组 8 21.13±5.46* 9.00±2.51*TFL给药组 9 6.78±3.93*#△ 4.11±2.26*#△秋水仙碱组 9 15.67±5.74*# 6.44±2.74*#纤维化评分 显色指数正常对照组
2.6 肝纤维化评分与 MDA、SOD、NF-κB相关性分析 肝组织病理学肝纤维化评分与 MDA、NF-κB呈正相关(r=0.72,0.66),与SOD呈负相关(r=-0.57)。
3 讨 论
本实验中,作者采用DMN建造大鼠肝纤维化模型研究TFL抗肝纤维化的作用机制。DMN诱导的肝纤维动物模型,与人类肝硬化早期改变的胶原沉积特点相似,DMN是一种肝毒性化合物,一方面可在线粒体中代谢为乙醛,进而与蛋白质交联;另一方面DMN代谢产生活性甲基化基因,引起核酸、蛋白质的甲基化,导致肝细胞坏死与肝脏脂质过氧化,刺激HSC活化与胶原基因表达,导致肝纤维化。
脂质过氧化反应是连结组织损伤与纤维化两个过程的纽带,抑制过氧化反应,不仅可促进肝损伤修复,而且也可防止纤维化的发生和发展[8]。本实验研究发现,模型组肝组织有较多的成纤维细胞出现,肝索排列紊乱,纤维结缔组织增生纤维间隔形成,提示大鼠肝纤维化模型复制成功。TFL防治干预6周后,血清ALT、AST、MDA含量明显降低,SOD水平明显升高,肝组织损伤程度呈好转趋势,肝细胞坏死减少,病理学检查肝纤维化程度明显改善。结果提示,TFL有较好的保护肝细胞、改善肝功能及抗肝纤维化作用,其机制可能与其提高SOD活性,降低MDA含量,清除氧自由基,保护肝细胞,抑制机体脂质过氧化反应有关。
NF-κB是一种具有转录激活功能的蛋白质,普遍存在于多种组织的多种细胞中。研究表明,静止的HSC向活化的HSC转化时,NF-κB的结合活性增加,在细胞受到病毒、细菌毒素感染、缺血缺氧、组织损伤等各种因素作用下NF-κB活化,进入细胞核与相应的靶基因结合,启动细胞黏附分子NOS和环氧化酶-2等基因转录,导致促炎因子、自由基、前列腺素等炎症介质的大量产生,从而引起相应病变,并同时以自分泌或旁分泌的形式激活未活化枯否细胞中的NF-κB,产生更多的炎性介质,形成“炎性瀑布”,造成肝脏炎症反应,激活HSC参与肝脏纤维化进程[9-10]。而且NF-κB还具有抗 HSC凋亡的作用,使得活化的HSC的数量维持在一定的水平,一定程度上促进了纤维化的发生和发展[11-12]。因此,抑制NF-κB的表达和增殖,可以作为抗肝纤维化治疗的有效途径之一[13-14]。
在本次实验中发现正常对照组NF-κB呈弱阳性表达,模型组强阳性表达,而运用TFL及秋水仙碱处理后治疗组肝组织NF-κB的表达明显减弱,表明NF-κB参与了DMN诱导的肝纤维化进程。模型组肝组织病理学表现为广泛纤维组织增生假小叶形成;而采用TFL处理后TFL组肝组织NF-κB活性显著下降,病理学显示其纤维化程度较模型组明显改善,仅见少量纤维间隔及炎细胞浸润,肝小叶结构基本正常,无肝硬化形成。相关性分析表明,NF-κB在肝内表达的增强程度与病理学上纤维化程度评分呈一定正相关,提示TFL抗肝纤维化作用可能与其下调NF-κB表达,进而抑制HSC活化、促进活化的HSC凋亡有关。
综上所述,TFL对DMN诱导的肝纤维化具有较好的防治作用,其机制可能与减轻机体脂质过氧化反应、抑制NF-κB的高表达有关。然而TFL抗肝纤维化的具体体内生物过程尚有待进一步研究。
[1]Tsukada S,Parsons CJ,Rippe RA.Mechanisms of liver fibrosis[J].Clin Chim Acta,2006,364(1/2):33-60.
[2]Manning DS,Afdhal NH.Diagnosis and quantitation of fibrosis[J].Gastroenterology,2008,134(6):1670-1681.
[3]Benyon RC,Iredale JP.Is liver fibrosis reversible[J].Gut,2000,46(4):443-446.
[4]覃浩,孙旭锐,欧仕玉,等.荔枝核总黄酮预防大鼠肝纤维化的初步研究[J].第三军医大学学报,2011,33(22):2353-2356.
[5]Ala-Kokko L,Pihlajaniemi T,Myers JC,et al.Gene expression of typeⅠ,ⅢandⅣcollagens in hepatic fibrosis induced by dimethylnitrosamine in the rat[J].Biochem J,1987,244(1):75-79.
[6]曾民德,王泰龄,王宝恩.肝纤维化及疗效评估共识[J].肝脏,2002,7(2):3-4.
[7]徐列明,刘平,吕刚,等.Ⅰ、Ⅳ型胶原及板层素在肝纤维化大鼠肝窦周围的变化[J].中华消化杂志,1995,15(3):146-147.
[8]杨杰,周力.凯西莱抗大鼠免疫性肝纤维化的实验研究[J].重庆医学,2006,35(8):697-702.
[9]Elsharkawy AM,Mann DA.Nuclear factor-kappa B and the hepatic inflammation-fibrosis-cancer axis[J].Hepatology,2007,46(2):590-597.
[10]吕鹏,罗和生,Shelley Chireyath Paul,等.沙立度胺对大鼠肝纤维化核因子-κB和肿瘤坏死因子-α表达的影响[J].中国病理生理杂志,2007,23(9):1811-1816.
[11]Ruddell RG,Hoang-Le D,Barwood JM,et al.Ferritin functions as a proinflammatory cytokine via iron-independent protein kinase Czeta/nuclear factor kappa B-regulated signaling in rat hepatic stellate cells[J].Hepatology,2009,49(3):887-889.
[12]Son G,Iimuro Y,Seki E,et al.Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCL4-induced liver injury and fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2007,293(3):G631-G639.
[13]吴义春,吴强,杨雁,等.肝组织中 NF-κB、TGF-β1及其Ⅰ型受体mRNA和HSC在肝纤维化中的改变及护肝片对其的影响[J].中国组织化学与细胞化学杂志,2011,20(3):212-219.
[14]宋维芳,徐军全,许瑞玲,等.核转录因子-κB在实验性肝纤维化中的表达、分布及意义[J].中国病理生理杂志,2010,26(1):12-16.

