荧光实时定量PCR对肺癌相关基因检测及其临床意义
王明贤,杨 华,杨志强
(1.乐山职业技术学院,四川乐山 614000;2.中山大学医学院,广州 510080)
肺癌是最常见的恶性肿瘤之一,严重威胁人类生命及健康,发病率较高,且有继续增高的趋势。通过影像学及病理学检查虽可发现,但由于无法发现隐性病灶、亚临床病灶及微小转移灶的资料与证据,目前做到早期发现尚存在一定的难度,大部分患者在出现临床症状而就诊时疾病已经处于中晚期,从而错过手术时间窗。据统计,肺癌的5年生存率不足15%[1]。近年来,肿瘤基因类标志物研究取得长足进展,已经成为肿瘤分子诊断的重要内容之一,通过分析肿瘤相关基因的关系、类型、表达及缺陷等,最终达到肿瘤早期诊断的目的[2]。本研究采用荧光实时定量PCR对肺癌相关基因LUNX、CK19、CEA、MUC1及Survivin进行检测分析并建立辅助诊断指数,现报道如下。
1 资料与方法
1.1 一般资料 选择2009年9月至2011年9月于中山大学医学院胸外科行手术治疗的肺癌患者34例,其中男19例,女15例;年龄27~67岁,平均(46.72±5.88)岁;所有患者均经过术后病理检查确诊。应用世界卫生组织(WHO)1999年对肺癌的组织学分类方法,发现小细胞肺癌(SCLC)患者12例,非小细胞肺癌(NSCLC)患者22例;按照国际抗癌联盟(UICC)1997年对肺癌TNM分期方法进行分期,其中Ⅰ期6例,Ⅱ期10例,Ⅲ期14例,Ⅳ期4例。收集患者手术切除的肿瘤、肿瘤切缘组织及切缘周围2cm组织。另取同期10例行肺大泡切除术患者肺组织作为正常对照组。本研究对术前评价具有手术适应证患者进行手术,有些SCLC以及Ⅳ期的NSCLC均为术后补充诊断。
1.2 方法
1.2.1 mRNA提取 将组织置入1.5mL的RNA裂解液(购自美国Promega公司),再加入11μLβ-巯基丙醇进行匀浆,分装入离心管中,加入水饱和酚与氯仿,充分震荡后冰浴30min后,于4℃以12 000r/min离心10min,吸取上清液,加入等体积异丙醇后12 000r/min离心15min。重新加入β-巯基丙醇、RNA裂解液与异丙醇,12 000r/min离心后留取沉淀。使用RNA提取试剂盒RNAgents(购自美国Promega公司)提取mRNA,具体步骤参照该试剂盒说明书。
1.2.2 逆转录 逆转录过程采用逆转录试剂盒ImRrom-Ⅱ(购自美国Promega公司)与 M-MLV试剂盒(购自美国Promega公司),采用随机引物,整个过程均参照试剂盒说明书进行。
1.2.3 引物设计 引物设计均根据GenBank中LUNX、CK19、CEA、MUC1及Survivin的mRNA序列进行,采用AllelelD 4.0软件进行设计,最终由北京博奥森科技有限公司进行合成,具体序列如下。LUNX基因,上游:5′-CTC ATT GTC TTC TAC GGG CTG TT-3′,下游:5′-GGC AGG GCT GGA TTC ACA T-3′,片段大小104bp;CK-19基因,上游:5′-AGGTGG ATT CCG CTC CGG GCA-3′,下游:5′-AGC TCC CTG TCC TTC TAG TG-3′,片段大小338bp;CEA基因,上游:5′-TGC TCA CAG CCT CAC TTC-3′,下游:5′-CCA TCC ACT CTT TCA CCT T-3′,片段大小169bp;MUC1基因,上游:5′-CGT CGT GGA CAT TGA TGG TAC C-3′,下游:5′-GGT ACC TCC TCT CAC CTC CTC CAA-3′,片段大小287bp;Survivin基因,上游:5′-CCG CAT ACA GTC GAG AGA-3′,下游:5′-GTG TAG GGT GTA GAA TCC TGT TCA-3′,片段大小121bp。
表1 肝癌相关基因的差异表达()
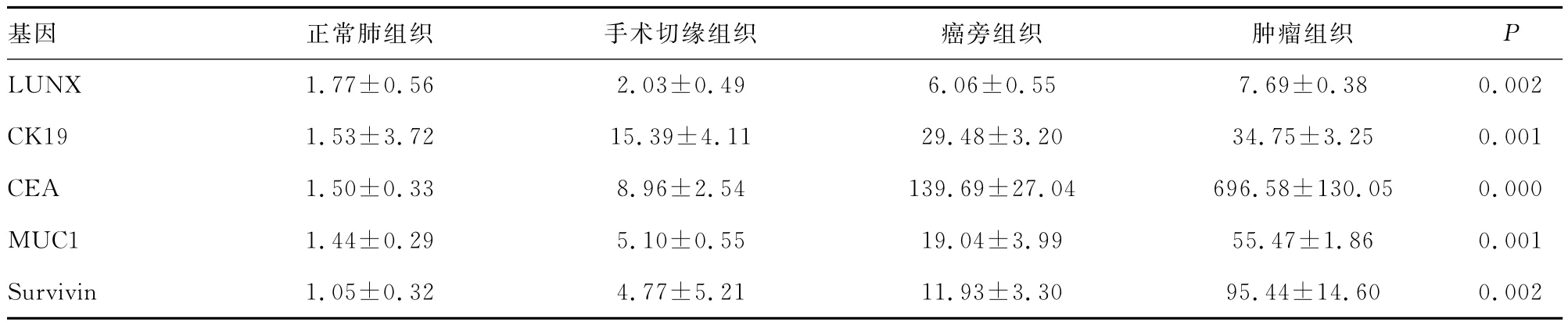
表1 肝癌相关基因的差异表达()
基因 正常肺组织 手术切缘组织 癌旁组织 肿瘤组织P 8 0.002 CK19 1.53±3.72 15.39±4.11 29.48±3.20 34.75±3.25 0.001 CEA 1.50±0.33 8.96±2.54 139.69±27.04 696.58±130.05 0.000 MUC1 1.44±0.29 5.10±0.55 19.04±3.99 55.47±1.86 0.001 Survivin 1.05±0.32 4.77±5.21 11.93±3.30 95.LUNX 1.77±0.56 2.03±0.49 6.06±0.55 7.69±0.3 44±14.60 0.002
1.2.4 实时荧光定量PCR 采用SYBR GreenⅠ染料法对样本进行实时定量PCR反应,应用Ex Tap试剂盒以及荧光定量ABI 7900型(ABI,美国)实时定量PCR系统进行,操作均按照厂家及试剂盒说明书进行。PCR反应条件如下:95℃预变性2min,94℃变性45s,60℃退火1min,71℃延伸1min,共进行45个循环,循环结束后于71℃下延伸1min,所得结果用IQ5软件进行读数分析,内参采用G3PHD基因。待测基因相对表达量采用2-△△CT法进行计算(△CT=CT待测-CT内参;△△CT=△CT待测-△CT),当计算出的2-△△CT值相差3倍时,即认为相关基因有差异表达。
1.3 多个相关基因荧光实时定量PCR反应体系建立 将合成好的相关基因cDNA混合,连续进行2倍梯度稀释,得到相关基因与内参G3PHD的荧光曲线,计算得到logcDNA浓度对△CT值直线,内参与待测基因扩增效率抑制,应用2-△△CT法适合对本研究结果进行分析。
1.4 统计学处理 采用SPSS10.0软件进行统计学处理,计量资料采用表示,组间差异比较采用t检验;计数资料采用百分比表示,组间差异比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 2-△△CT法相关基因相对表达水平检测 LUNX、CK19、CEA、MUC1及Survivin基因表达均上调,分别上调88.23%,75.42%,85.01%,66.42%和70.66%;在正常肺组织、手术切缘组织、癌旁组织与肿瘤组织中表达两两比较或多个比较差异有统计学意义(P<0.05),均具有从正常肺组织到肿瘤组织明显递减的趋势。见表1。
2.2 建立分子辅助诊断指数 根据2-△△CT法所得数值,该5种肺癌相关基因在组织中上调3倍或3倍以上的个数建立分子辅助诊断指数(与正常肺组织相对表达量相差3倍者计为辅助诊断指数增加1)[3],因此本研究中分子辅助诊断指数为0~5。经过计算可知,正常肺组织辅助诊断指数为1.2±0.51,手术切缘组织为2.4±0.64,癌旁组织为3.36±0.43,肿瘤组织为4.65±0.38。手术切缘组织、癌旁组织与肿瘤组织均较正常肺组织显著升高,以肿瘤组织最为明显。当以正常肺组织作为对照,设定辅助诊断指数大于或等于3.5为肺癌时,受试者工作特征曲线(ROC曲线)敏感度为95%,特异度为92%,阳性结果预示值(PPV)=95.33%,阴性结果预示值(NPV)=98.00%,说明分子辅助诊断指数可提高诊断准确性。
2.3 分子辅助诊断指数与WHO组织分型及UICC TNM分期的关系 对于12例SCLC患者及22例NSCLC患者,两组辅助诊断指数分别为3.69±0.24与3.98±0.30,二者之间比较差异无统计学意义(P>0.05);对于TNM分期,以Ⅳ期患者得分最高,Ⅰ期患者得分最低,得分比较差异有统计学意义(P<0.05)。
3 讨 论
随着肿瘤分子生物学技术的不断发展,对于肿瘤的发生、发展的认识亦在不断更新。分子生物学技术对肿瘤基因标志物的检测用于肿瘤发现与诊断,是目前的研究热点之一[4]。传统对于单基因的研究用于诊断肿瘤时,存在较高的假阳性与假阴性,从而造成漏诊与误诊的发生[5]。因此,采用多个相关基因标志物联合检测并寻找新的标志物,可降低漏诊、误诊的发生率,最终提高肿瘤的诊断率。
LUNX即肺特异性蛋白X,该基因定位与20p11.1-q12,长度为1 015bp,共编码26个氨基酸,具有较强的组织特异度,在肺外未发现表达。LUNX对肺癌患者外周血/淋巴等部位的未转移具有较高的特异度,因此可以作为一种新型的肺癌基因标志物[6]。LUNX mRNA在肺癌Ⅲ期与Ⅳ期的检出率显著高于Ⅰ、Ⅱ期患者,即LUNX mRNA的表达随着TNM分期的提高而增高[7]。LUNX mRNA水平与肿瘤负荷及转移程度密切相关[8]。CK-19属于细胞角蛋白,是角蛋白的可溶性片段,可以作为上皮来源肿瘤的敏感标志物[9]。CEA是正常组织不表达的一种分泌糖蛋白,其基因水平检查的敏感度高于蛋白水平。现认为,如果检出CEA mRNA,可以从理论上推断有肿瘤细胞的存在[10]。已经有学者检测患者体内 MUC1作为肺癌发生播散转移的生物学标志,通过logistic回归分析发现NSCLC患者外周血MUC1mRNA水平与TNM分期及肿瘤细胞分化程度均存在密切关系[11]。Survivin基因全长15kb,主要生理功能与胚胎细胞及增殖细胞的生长、分化有关。在大多数人类肿瘤存在高表达情况。研究发现,肺癌组织中Survivin mRNA水平高的患者预后较差,可作为判断肺癌预后的指标[12]。
本研究在查阅文献的基础上,选择肺癌组织中表达高、特异度好的上述基因,采用荧光实时定量PCR进行检测并初步建立辅助诊断指数。LUNX、CK19、CEA、MUC1及Survivin基因在肺癌组织中表达最高,正常组织中表达最低,符合既往文献。统计得出的分子辅助诊断指数对于诊断肺癌有良好的特异度与敏感度。此外,该分子辅助诊断指数还与肺癌的TNM分期有关,分期愈高,分子辅助诊断指数愈高,说明该分子辅助诊断指数对于肺癌的临床分期亦具有一定的预测与指导意义。
[1]Oklibo K,Bando T,Miyahara R,et al.Resection of pulmonary metastasis of non-small cell lung cancer[J].J Thoracic Oncology,2009,4(2):203-207.
[2]Tufman A,Huber R.Biological markers in lung cancer:a clinician′s perspective[J].Cancer Biomarkers,2010,6(3/4):123-135.
[3]王昌生.肿瘤标志物在肺癌诊断中的联合应用[J].河北医学,2012,18(4):499-501.
[4]Sieber O,Heinimann K,Tomlinson I.Genornic stability and tumorigenesis[J].Seminars Cancer Biology,2005,15(1):61-66.
[5]Yu Q.Stem cells and cancer stem cells[J].J Clin Rehabilit Tissue Engineer Res,2007,11(15):2948-2951.
[6]邓永键,王爽,郑林,等.LUNX基因增强子的克隆及调控活性分析[J].南方医科大学学报,2010,30(8):2025-2059.
[7]Tan S,Cheng Z,Ma Y,et al.LUNX mRNA in regional lymph nodes of,non-small cell lung cancer patients byRT-PCR and its clinical significance[J].J Central South University,2010,35(12):1236-1241.
[8]Zhu G,Liu D,Wang X.Detection of micrometastasis of lung cancer by using lunx mRNA specific reverse transcription-polymerase chain reaction[J].Chinese J Clin Oncol,2003,30(2):124-127.
[9]郑智,潘铁成,李军,等.CK-19抗体在检测非小细胞肺癌淋巴结微转移中的应用[J].华中科技大学学报:医学版,2004,33(5):606-608,618.
[10]廖秋林,李莲花,陈铭声,等.比较研究 TPS、CEA、CYFRA21-1和STNFR四种肿瘤活性标志物在肺癌中的诊断价值[J].中国肺癌杂志,2005,8(4):309-312.
[11]Hirasawa Y,Kohno N,Yokoyama A,et al.Natural autoantibody to MUC1is a prognostic indicator for nonsmall cell lung cancer[J].Am J Res Critical Care Med,2000,161(2):589-594.
[12]Donahue J,Chang E,Xiao L,et al.The RNA-binding protein Hur stabilizes survivin mRNA in human oesophageal epithelial cells[J].Biochemical J,2011,437(1):89-96.

