一起皮肤炭疽疫情病原的实验室检测及毒力基因鉴定
谈忠鸣,张忠献,顾 玲,胡建利,朱叶飞,祁 贤,董 晨,汤奋扬,周明浩,鲍倡俊
炭疽(Anthrax),是由炭疽杆菌(Bacillus anthracis)引起的人兽共患传染病。人感染炭疽,根据感染途径的不同,又分为皮肤炭疽、胃肠炭疽和肺炭疽。皮肤炭疽最为常见,主要为人接触感染炭疽杆菌牲畜的毛皮和肉类所致,病死率不高,可以彻底治愈,甚至自愈。人也可经呼吸道传播导致肺炭疽,或由食用感染炭疽的牲畜肉类而引起胃肠炭疽,严重感染者可引发炭疽性脑膜炎,甚至死亡。炭疽杆菌在极端环境中形成芽孢,可长期存在于自然界中,无法消除。由于炭疽芽孢杆菌的稳定性[1]和致病性,使其成为较常见的生物战剂和生物恐怖袭击武器[2]。
2012年8月,连云港市疾病预防控制中心接到连云港市第四人民医院关于发现疑似皮肤炭疽病例的报告,遂组织人员与当地县疾病预防控制中心共同赶赴病例所在地进行流行病学调查。通过调查发现4例疑似皮肤炭疽病例,并采集疑似病例标本和病牛肉标本送至我实验室进行检测。现将本实验室的检测结果报告如下。
1 材料与方法
1.1 标本采集和处理 采集4例疑似皮肤炭疽病例的血清、血球、焦痂及宰杀的病死牛肉标本。血块和牛肉各取200μg,放入2mL无菌E-P管中;病人焦痂标本直接放入2mL无菌E-P管中。各管加入200μL无菌生理盐水,研磨混匀成组织悬液。采用QIAGEN 公 司 试 剂 盒 (QIAamp DNA mini kit,Qiagen)提取DNA,操作步骤参照试剂盒使用说明书,核酸-80℃保存待用。
1.2 Real-time PCR 检测 采用 Real-time PCR 方法检测炭疽杆菌染色体上RNA聚合酶β亚单位编码基因(rpoB)[3]、质粒 PXO1上保护性抗原基因pag[3]、质粒PXO2上荚膜基因(poly-γ-D-glutamic capsule)的片段capA[4],引物序列见表1。反应体系为:10μL Master Mix(ABI Universal TaqMan Master Mix,Applied Biosystems),300nmol/L 上下游引物,250nmol/L探针,2μLDNA 模板,H2O补至20μL。循环程序为:50 ℃ 2min,95 ℃10min,40个循环为95℃15s,60℃1min并收集信号。荧光定量PCR仪为ABI的7500Real Time PCR System。

表1 炭疽杆菌rpoB基因、pag基因和capA基因实时荧光PCR引物及探针序列Tab.1 Primers and probes of real-time PCR for detection on specific genes(rpoB,pag,and capA)of Bacillus anthracis
1.3 毒力基因检测 建立普通PCR方法检测炭疽杆菌质粒上的毒力基因。靶基因为位于质粒PXO1上编码炭疽杆菌毒素的水肿因子 (edema factor)cya基因,致死因子(lethal factor)lef 基因,保护性抗原(protective antigen)pag基因,以及位于质粒PXO2上的荚膜基因(poly-γ-D-glutamic capsule)cap基因[5]。引物序列见表2。反应体系为:10×TaKaRa LA buffer 2.5μL,dNTPs 2μL,10pmol/μL上下游引物各1μL,5UTaKaRa LA Taq酶0.15μL,DNA模板5μL,H2O补足25μL。循环程序为:94℃4min;35个循环为94℃1min,51℃40s,72℃30s;72℃5min。PCR扩增仪为ABI的9800Fast Thermal Cycler。PCR产物1.5%琼脂糖电泳分析结果。
1.4 序列分析 炭疽杆菌毒力基因的PCR产物TaKaRa试剂盒回收(TaKaRa Mini Best Agarose Gel DNA Extraction Kit,TaKaRa)并测序,测序仪为 Applied Biosystems/HITACHI 3500xL(Hitachi High-technologies Corporation,Tokyo,Japan)。测序结果MEGA 4.0软件进行分析。
2 结 果
2.1 流行病学调查 2012年7月来源于外省的200余头牛,运达江苏省连云港市赣榆县时发现其中1头病牛,当地10名村民对其进行了放血、宰杀。之后,有4人陆续出现发热、局部皮肤肿胀等症状。收到报告后,江苏省疾病预防控制中心立即介入调查,确定4例疑似皮肤炭疽病例中2例为临床诊断病例,另外2例因症状不典型被列为医学观察对象,并通过“中国疾病预防控制信息系统”及时进行了病例个案报告。经当地疾病预防控制中心的主动搜索,又发现3名医学观察对象。7例病例的详细情况见表3。
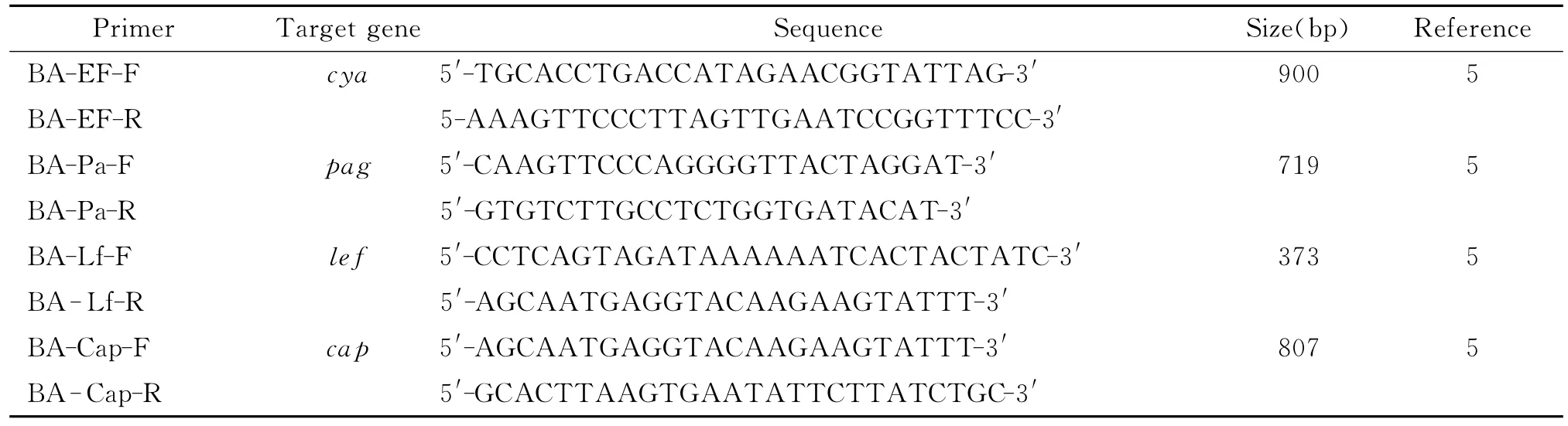
表2 毒力基因引物序列Tab.2 PCR primers for virulence genes of Bacillus anthracis

表3 流行病学调查对象基本信息及Real-time PCR检测结果Tab.3 Results of epidemiological investigation and real-time PCR
2.2 Real-time PCR 鉴定 对4例疑似皮肤炭疽病人的临床标本和病牛肉标本分别进行实时荧光PCR检测。检测的靶基因为染色体上rpoB基因、质粒PXO1上的pag基因和质粒PXO2上的capA基因。结果显示只有病人的焦痂标本和病牛肉标本检测出3种基因的荧光信号,CT值均小于35(图1)。病人血标本中未检测出荧光信号。
2.3 毒力基因检测 对4例皮肤炭疽病例的焦痂标本和病牛肉标本分别进行毒力基因检测。cya、pag和lef基因位于质粒PXO1上,分别编码水肿因子、保护性抗原和致死因子。与芽孢形成有关的基因如capA、capB、capC等则位于pXO2质粒上,本次实验以capA为靶基因。结果显示在900bp、719bp、373bp和807bp处分别出现目的条带,阴性对照无扩增条带(图2)。
2.4 序列分析 为验证DNA片段的正确性,所有阳性的毒力基因PCR产物回收测序,GenBank中进行比对,结果证实4份病人的标本和病牛肉标本全部为炭疽杆菌质粒上的毒力基因,且序列完全一致。挑选 JS-2012-1、JS-2012-2 和 JS-2012-beef的序列与GenBank中的国际参考株序列进行比对。4个毒力基因与炭疽杆菌的国际参考株同源性均在99%以上,仅1~3个碱基的差异。cya基因序列通过比对发现与美国的3株参考株(str.CDC 684,str.A 0248,str.Ames Ancestor)及意大利2株参考株(str.IT-Carb1-6241,str.IT-Carb3-6254)序列最为接近,仅相差1个碱基。pag基因序列与A16R疫苗株、美国的A0248、Ames Ancestor株及以色列的ISR1980株的序列完全相同。lef基因测序比对结果显示江苏序列与大部分国际参考株序列基本一致。cap基因序列比对结果显示3株美国参考株与韩国株(str.H9401)序列完全一致,与江苏序列存在一个碱基的差异。序列分析结果说明炭疽杆菌毒力基因相当保守,同源性非常高。与蜡样芽孢杆菌炭疽生物型参考株(str.CI)的序列同源性在99%以上。

图1 实时荧光PCR检测炭疽杆菌rpoB基因、pag基因和capA基因Fig.1 Detection on specific genes(rpoB,pag,and capA)of Bacillus anthracis by real-time PCR

图2 4种毒力基因PCR产物电泳图Fig.2 Detection on virulence genes of Bacillus anthracis by PCRFigure above M:100bp DNA ladder marker;1:cya-JS-2012-1;2:cya-JS-20120-2;3:cya-JS-2012-3;4:cya-JS-2012-4:5:Negative:6:pag-JS-2012-1;7:pag-JS-20120-2:8:pag-JS-2012-3;9:pag-JS-2012-4;10:Negative;11:lef-JS-2012-1;12:lef-JS-20120-2;13:lef-JS-2012-3;14:lef-JS-2012-4;15:Negative.Figure below M:100bp DNA ladder marker;1:cap-JS-2012-1;2:cap-JS-20120-2;3:cap-JS-2012-3;4:cap-JS-2012-4;5:Negative;6:cya-beef;7:Negative;8:lef-beef;9:Negative;10:cap-beef;11:Negative;12:pag-beef.
3 讨 论
炭疽杆菌是一种危害极大的人兽共患病原微生物,形成芽孢以后可长期存在于土壤、草木和动物的骨骼中,所以炭疽杆菌很难根除。当牛、羊等家畜啃食草根或翻动泥土时会感染炭疽杆菌而发病,人类主要通过接触感染了炭疽的家畜毛皮或食其肉而得病。我国主要以散发或小爆发为主,皮肤炭疽最为常见,病例多集中在西、北及西南几个省,感染后很少出现人与人相互传播[6]。
2012年7-8月我省连云港赣榆县发生一起炭疽疫情,10名当地村民对1头病牛进行放血、宰杀,随后7名村民出现不同程度的皮肤炭疽症状。为了在第一时间诊断病原,本实验室对4名病例的临床标本(血、焦痂)和病死牛肉标本进行 Real-time PCR快速检测。检测的3种靶基因分别是炭疽杆菌染色体上rpoB基因、质粒PXO1上选择保护性抗原pag基因和质粒PXO2上荚膜基因cap。rpoB基因负责合成RNA聚合酶β-亚单位,是一种高度保守的管家基因,可作为鉴定细菌的标签序列[7]。检测pag和cap可知晓炭疽杆菌是否携带对应的质粒PXO1和PXO2。如只携带其中一个质粒,为弱毒株;若两个质粒均携带,即为强毒株;如果两个质粒均丢失,则为无毒株。实验结果显示在病人的焦痂标本和病牛肉中rpoB基因、pag和cap阳性。表明本次疫情是炭疽杆菌强毒株导致。血标本中未检测出信号,可能与病人已使用抗生素(青霉素、左氧氟沙星)有关,但不能排除炭疽杆菌不入血的可能。
为进一步验证实时荧光PCR的结果,我实验室对阳性标本进行四种毒力基因的鉴定并测序分析。包括质粒PXO1上分别编码水肿因子(edema fcator)、保护性抗原PA(protective antigen)和致死因子(lethal factor)的cya基因、pag基因和lef 基因以及质粒PXO2上编码 多聚-γ-D-谷氨酸荚膜的cap基因。测序结果表明,4例病人标本和病牛肉的4种毒力基因序列完全相同,进一步验证了流行病学调查和Real-time PCR结果。通过 GenBank比对国际参考株,江苏标本质粒PXO1上毒力基因序列与美国 CDC 684株、Ame Ancestor株、A 0248株及疫苗株A16R最为接近,仅相差1~2个碱基,pag基因序列甚至完全相同,同源性非常高。这可能与炭疽杆菌形成芽孢后可长期保存于自然环境中,从而减少了进化频率,使得炭疽杆菌菌株间极端同源。GenBank中炭疽杆菌质粒PXO2的cap基因上传序列较少。
综上所述,本此疫情中使用的炭疽杆菌分子诊断方法可检测病人临床标本及动物标本,此方法快速、便捷、可靠,能区分强毒株、弱毒株和无毒株,可应用在炭疽疫情及生物反恐的快速检测中。毒力基因的序列分析可对疫情中的炭疽杆菌进行简单的溯源追踪,江苏序列与疫苗株A16R同源性很高,说明A16R在我国炭疽菌株中具有代表性。测序的结果可以用来佐证流行病学调查结果。
[1]Food and Agriculture Organization of the United Nations,World organisation for Animal health.Anthrax in humans and animals(Fourth Edition)[M].World health organization,2008:36-38.
[2]Inglesby TV,O'toole T,Henderson DA,etal.Anthrax as a biological weapon,2002:updated recommendations for management[J].JAMA,2002,287(17):2236-2252.DOI:10.1001/jama.287.17.2236
[3]Sohni Y,Kanjilal S,Kapur V.Performance evaluation of five commercial real-time PCR reagent systems using TaqMan assays for B.anthracis detection[J].Clin Biochem,2008,41(7-8):640-644.DOI:10.1016/j.clinbiochem.2008.01.007
[4]Qu S,Shi QH,He N,etal.Real time quantitative PCR and its reagent product for rapid detection of Bacillus anthracis[J].Bull Acad Military Med Sci,2010,34(3):275-279.(in Chinese)曲识,史清海,何宁,等.定量PCR快速检测炭疽芽孢杆菌的实验研究[J].军事医学科学院刊,2010,34(3):275-279.
[5]Kumar S,Tuteja U.Detection of virulence-associated genes in clinical isolates of bacillus anthracis by multiplex PCR and DNA probes[J].J Microbiol Biotechnol,2009,19(11):1475-1481.DOI:10.4014/jmb.0902.0101
[6]Liang XD.Anthrax surveillance in China[J].Dis Surveill,1999,14(2):69-71.(in Chinese)梁旭东.中国炭疽监测状况[J].疾病监测,1999,14(2):69-71.
[7]Hoffmaster AR,Meyer RF,Bowen MD,etal.Evaluation and validation of a real-time polymerase chain reaction assay for rapid identification of Bacillus anthracis[J].Emerg Infect Dis,2002,8(10):1178-1182.

