浅析焰色反应*
陈晓峰 吴勇
(南京师范大学化学与材料科学学院 江苏南京 210046)
焰色反应是指某些金属或其挥发性化合物在火焰中灼烧时使火焰呈现特征颜色的反应,是定性鉴定金属离子的方法之一。节日里五彩缤纷的焰火就是焰色反应在生活中的应用。在现行的中学化学、大学普通化学、无机化学和分析化学理论和实验教材[1-2]中都有焰色反应的内容,作为一种有趣而引人入胜的演示实验,焰色反应可以激发学生学习化学的兴趣和积极性。目前,对于焰色反应的讨论大多局限于实验操作方面,对于各种常见金属焰色的具体成因讨论则不够深入[3-5],本文拟从热力学和原子结构角度讨论常见金属的焰色与其原子结构的关系。
1 关于焰色反应的探讨
(1)焰色反应是元素的特征,与原子的化合状态和物质的聚集状态无关。
焰色反应实验所用的样品大多是盐类,在常温下多为固体,其中的元素是以离子形式而非原子形式存在。实验时通常用其盐溶液在酒精灯或煤气灯火焰上灼烧。有些无机实验教材中认为煤气灯氧化焰的温度约为800~900℃[2]。实际上,煤气自然燃烧时,焰心温度为800~1000℃,边焰温度为1300~1400℃;空气助燃时,温度可以达到1650~1700℃。固体或液体的样品物质被火焰加热后经过蒸发转变成气态,火焰提供能量使化学键断裂,形成基态的气态原子或离子。基态气态原子或离子再继续相互碰撞变为激发态。激发态的原子或离子不稳定,跃迁回基态,多余的能量会以光的形式释放出来。实验表明,焰色反应是元素的特征,与原子的化合状态和物质的聚集状态无关。即在火焰作用下,元素是以原子而非离子形式存在,正好与常温下情况相反。这可以从热力学角度进行分析。
以碱金属卤化物为例,样品在火焰中的变化可以用以下3个过程表示:
① 固体或液体样品在火焰作用下蒸发成气态:

② 火焰提供能量使化学键断裂,样品变成基态气态原子或气态离子:

从基态气态原子到基态气态离子过程的吉布斯自由能变ΔG可以通过如下公式得到:
ΔG=ΔH-TΔS=(I1+(-EA))-T(S(M+,g,基态)+S(X-,g,基态)-S(M,g,基态)-S(X,g,基态))
式中I1为碱金属第一电离能,EA为卤素电子亲和能;S(M,g,基态)、S(M+,g,基态)、S(X,g,基态)和S(X-,g,基态)分别为基态气态金属原子和金属离子以及基态气态卤素原子和卤素离子的熵。由于气态离子的热化学数据不全[6],无法定量计算出上述过程的熵变ΔS。但是,气态金属原子失去一个电子成为气态金属离子是混乱度增加过程,而气态卤素原子得到一个电子变为气态卤素离子是混乱度减小过程,两个过程的熵变可以大致相互抵消。因此,从基态气态原子到基态气态离子过程的总熵变ΔS很小,在吉布斯自由能变ΔG中起主要作用的应该是焓变ΔH。若ΔH>0,则ΔG>0,说明气态原子较气态离子稳定;若ΔH<0,则ΔG<0,说明气态离子较气态原子稳定。
表1给出了碱金属原子第一电离能和卤素原子电子亲和能数值[7]。表2给出了碱金属卤化物分解为基态气态原子和基态气态离子时的焓变ΔH(由公式ΔH=I1-EA计算得到)。从表2可知,ΔH均大于0且ΔG均大于0,表明在火焰作用下,碱金属卤化物主要分解为气态原子。这与常温下的情况相反。在固态金属卤化物或金属卤化物的水溶液中,金属和卤素均以离子形式稳定存在。但在高温下离子键断裂后,气态原子较气态离子稳定。因此,从平衡的观点看,发生焰色反应的主要是金属原子而非金属离子。

表1 碱金属原子第一电离能和卤素原子电子亲和能[7]

表2 碱金属卤化物分解为基态气态原子和基态气态离子时的焓变
③ 在火焰中,气态金属原子一方面有可能获得能量从基态跃迁至激发态,另一方面也有可能获得能量先失去最外层电子变成离子,离子再从基态跃迁至激发态。从表3可知,气态碱金属或碱土金属原子获得能量从基态跃迁至第一激发态所需的能量(可近似用轨道能级差估算)要比碱金属或碱土金属原子失去一个电子成+1价阳离子所需的能量(第一电离能)要低,例如,Li原子价电子从2s轨道跃迁到2p轨道的能量近似为1.85eV,小于其第一电离能5.393eV。由于火焰加热是热激发,能量不是很高,因而处于激发态的原子数目要比处于激发态的离子多得多。因此,从发光强度角度看,发生焰色反应的主要是金属原子而非金属离子。处于激发态的金属原子不稳定,大约经过10-8s,电子就会从高能量状态返回到低能量状态,如果多余的能量以光的形式释放出来,且波长在可见光区,就会形成特殊的焰色。

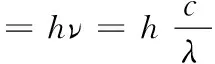
(2)焰色与原子结构有关,不同元素的原子,其电子跃迁的能量不同,产生的焰色也不同。
碱金属元素基态时价电子组态均为ns1,光谱支项为2S1/2,而激发态则有许多个,如np1,nd1,(n+1)s1,(n+1)p1,(n+1)d1,(n+2)s1,(n+2)p1,(n+2)d1等,对应的光谱支项为2S1/2,2P1/2,2P3/2,2D1/2,2D3/2等。根据光谱跃迁规则[8]:ΔS=0,ΔL=1,ΔJ=0或1。碱金属元素的焰色主要是电子由激发态2P3/2和2P1/2向基态2S1/2跃迁产生的。随着有效核电荷增大,旋-轨耦合作用增强,2P3/2和2P1/2间距增大,2P3/2和2P1/2向2S1/2跃迁的谱线间距增大。表3列出了碱金属、碱土金属以及Cu的基态及激发态原子价电子组态、第一电离能、光谱支项、电子跃迁、谱线波长以及元素的特征焰色,表中E为轨道能,ΔE为轨道能量差。从表3可知,Li的焰色主要是22P3/2和22P1/2向22S1/2跃迁产生,波长为670.8nm,焰色呈红色[3]。Na的原子光谱比较复杂,其中有主系、锐系、漫系和基系等谱线[8],而Na的焰色则主要是主系中的32P3/2和32P1/2向32S1/2跃迁产生的,对应着Na原子光谱中主系的D线[8],位于可见光区的黄色区, 因此Na的焰色呈黄色[3]。K的焰色主要是42P3/2和42P1/2向42S1/2跃迁(766.5nm和769.9nm)以及52P3/2和52P1/2向42S1/2跃迁(404.4nm和404.7nm)的混合,呈紫红色。Rb的焰色主要是52P3/2和52P1/2向52S1/2跃迁(780.8nm和794.8nm)以及62P3/2和62P1/2向52S1/2跃迁(420.2nm和421.6nm)的混合,呈红紫色[3]。由于Cs的62P3/2和62P1/2向62S1/2跃迁的波长为852.1nm和894.3nm,位于红外区,故Cs的焰色主要来自72P3/2和72P1/2向62S1/2的跃迁,对应的波长为455.5nm和459.3nm,呈蓝色[3,5],而不是呈紫色[4]。
基态铜原子的价电子组态为3d104s1,最外层电子结构与碱金属相似,其光谱支项为2S1/2,比基态能量稍高一些的组态是3d94s2,其光谱支项为2D5/2。铜原子激发态3d104p1的光谱支项为2P3/2和2P1/2。从激发态42P3/2和42P1/2向基态42S1/2的跃迁波长分别为324.7nm和327.4nm,位于紫外区,故铜的焰色主要是电子从激发态42P3/2向较低能级32D5/2跃迁而产生的,波长为510.5nm,呈绿色。
基态碱土金属元素价电子组态为ns2,对应的光谱支项为1S0。主要激发态的电子组态为ns1np1和ns1(n+1)p1,对应的光谱支项分别为1P0、3P2、3P1和3P0。根据跃迁选律,碱土金属的焰色主要是1P0→1S0跃迁产生的,但也存在3P1向1S0(系际交叉)的跃迁。由于3P1→1S0是自旋禁阻跃迁,强度相对较低。从表3可知,Ca的焰色主要是41P0→41S0和43P1→41S0(系际交叉)两种跃迁产生的,跃迁波长分别为422.7和657.3nm,而不是714.9nm[3],呈橙红(砖红)色。Sr的焰色主要是51P0→51S0和53P1→51S0(系际交叉)两种跃迁产生的,跃迁波长分别为460.7和689.3nm,呈深红色[3]。Ba的焰色主要来自61P0→61S0跃迁,波长为553.5nm,呈绿色[3];系际交叉63P1→61S0跃迁强度低且波长为791.1nm,位于红外区。
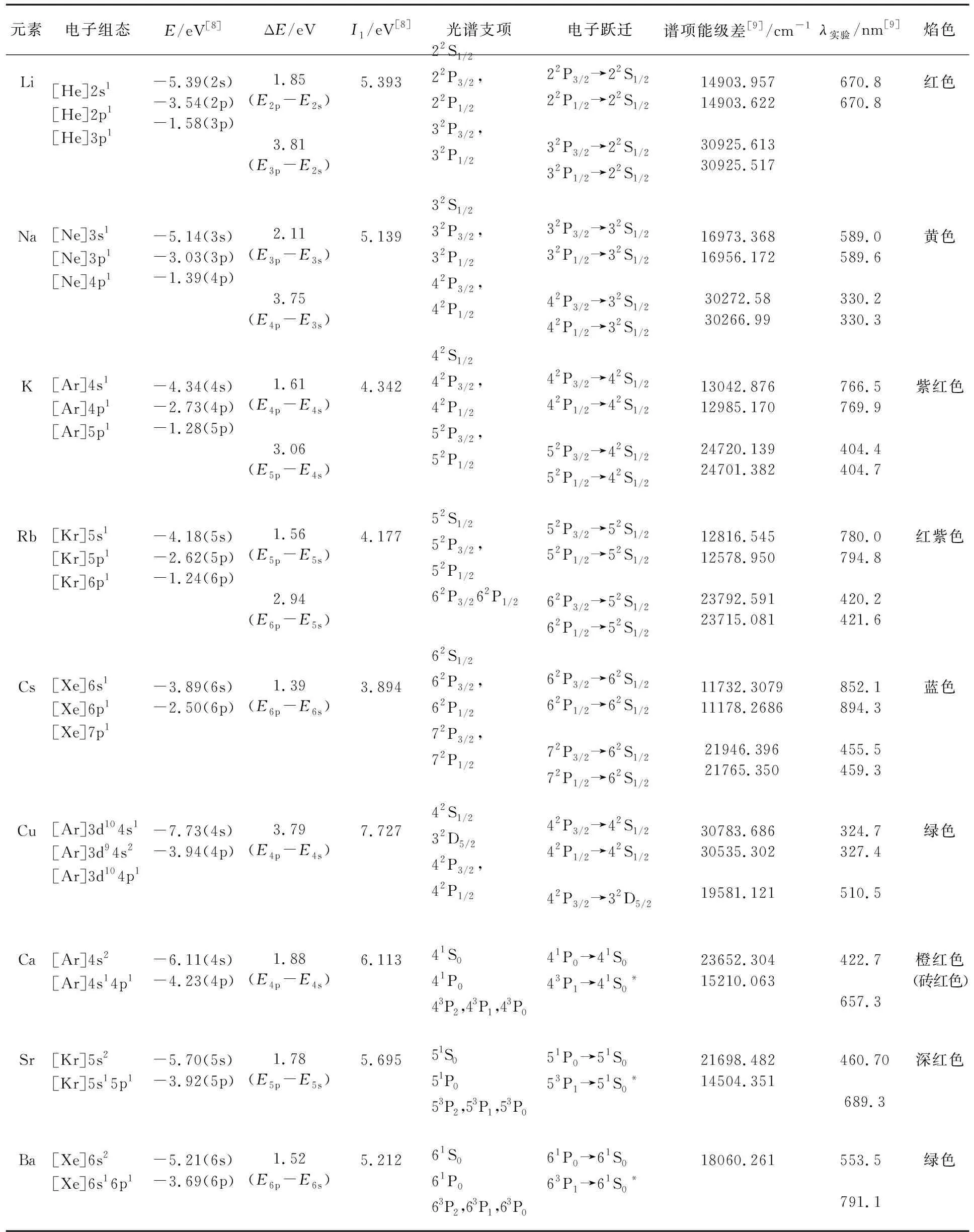
表3 碱金属、碱土金属及Cu基态及激发态的一些相关参数
*系际交叉
对于一些非金属元素如F、Cl、Br、I、C、N、O等,由于核外电子跃迁需要吸收较高的能量,在火焰中不易被激发,而且非金属元素激发态原子的电子跃迁所产生的波长大多在200nm以下,位于远紫外区[9],因此,进行焰色反应时,F、Cl、Br、I、C、N、O等非金属元素不会对金属元素的鉴别产生干扰,也不能用焰色反应鉴别非金属元素。
以上仅从原子结构和原子发射角度分析了焰色反应产生的原因,实际上焰色反应还可能与吸收有关。在原子跃迁到激发态的过程中,有可能会吸收一定波长的光,这也可能对焰色产生一些影响。
2 结语
焰色反应是元素的特征,与原子的化合状态及物质的聚集状态无关。化合物在高温下分解成气态原子,处于高温状态的原子运动速度加快,各种原子间发生非弹性碰撞,交换能量,使原来处于低能级的电子跃迁到较高能级而使金属原子受到激发。激发态的金属原子不稳定,又跃迁回基态或低能态,多余的能量以光的形式释放出来。不同金属元素的原子,其电子跃迁的能量不同,产生的焰色也不同。
参 考 文 献
[1] 北京师范大学无机化学教研室.无机化学实验.第3版.北京:高等教育出版社,2001
[2] 李巧云,庄虹.无机及分析化学实验.南京:南京大学出版社,2010
[3] 大连理工大学无机化学教研室.无机化学.第5版.北京:高等教育出版社,2006
[4] 北京师范大学,华中师范大学,南京师范大学无机化学教研室,等.无机化学.第4版.北京:高等教育出版社,2003
[5] 尹敬执,申泮文.基础无机化学(下册).北京:人民教育出版社,1980
[6] Dean J A.兰氏化学手册.第2版.北京:科学出版社,2003
[7] 麦松威,周公度,李伟基.高等无机结构化学.第2版.北京:北京大学出版社,2006
[8] 徐光宪,王祥云.物质结构.第2版.北京:高等教育出版社,1987
[9] Sansonetti J E,Martin W C.JPhysChemRefData,2005,34(4):1559

