再谈钠钾元素的焰色反应
李俊生
焰色反应实验是中学化学实验教学的重点实验之一,2017年高考理综(全国Ⅰ卷)35题更是出现了考核钾元素焰色反应的理论问题。近年来的实验教学表明,很多人对焰色反应实验的理解存在一定的偏差,焰色反应实验成功的操作要点还不明晰,特别是钠元素或钾元素焰色反应的机理还有很多使学生迷惑的问题,因此有必要对焰色反应的机理以及实验操作要点做进一步的分析。
1焰色反应的机理
火焰中金属元素的物理化学历程是很复杂的,一般认为,试液雾粒在火焰中有如图1所示的复杂的反应历程。
对于蘸在铂丝表面的NaCl(aq)而言,图1表明NaCl(aq)经过脱水、蒸发、分解等物理化学变化形成基态Na原子,基态Na原子再被热能激发。激发的结果使Na原子的最外层电子吸收一定的能量而离开原来的能级,跳跃到较高的能级,处于较高能级的电子是不稳定的,跃迁回基态或低能态,产生不同波长的辐射,从而得到不同的焰色。其中辐射光的频率满足如下公式:
E1、E2表示电子在低能级或高能级时的能量,h为普朗克常数。钠光谱的一个光谱系和钠原子的简单能级图如图2所示。
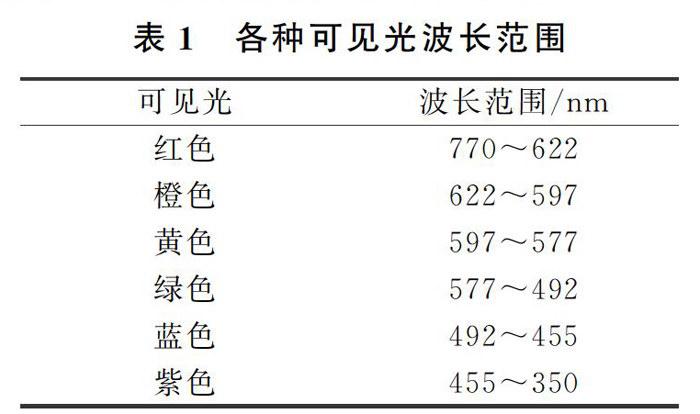
图2表明了钠原子[Na]3s1中3s1电子在不同能级的跃迁情况。在这些光谱线中,最强的是3s→3p的跃迁,波长分别是589.0~589.6nm双线,它是钠的特征双线,称作D线(黄色),而事实上人眼感知的可见光的波长范围见表1。
由表1可以看到,钠元素的3s一3p跃迁对应的波长处于可见光黄色区域,因此钠元素的焰色反应为黄色。对钾元素的焰色反应原理也进行了类似钠元素焰色反应的研究,具体情况见表2。
通过表2,可以进一步理解钠元素电子跃迁的情况,同时也可以清晰地看到钾元素的焰色反应机理和钠元素有一定的区别。这个区别就是钾元素的电子跃迁存在于4s→4p(可见光红色区域)或4s→5p(可见光紫色区域),其对应辐射光波长都处于可见光波长范围,因此钾元素的焰色反应才会呈现为紫红色。
2焰色反应实验操作关键
焰色反应实验操作的准确与否决定了这个实验的成败,因此明确焰色反应的实验操作关键,是做好课堂教学以及指导学生实验的重中之重,具体分析如下。
2.1实验步骤
(1)把装在玻璃棒上的铂丝(或铁、镍、铬、钨丝)在酒精灯的火焰里灼烧,直至与原来火焰的颜色相同。
(2)用铂丝蘸取金属的盐溶液,放在火焰上灼烧,观察火焰所呈现的颜色。每次实验完毕,都要用稀盐酸洗净铂丝,再用蒸馏水清洗,然后在火焰上灼烧到无色,才能进行下一次实验。
(3)在观察钾的焰色时,若有钠的干扰,最好透过蓝色的钴玻璃观察,这样就可以滤去黄色的光,让紫色的光通过。
2.2实验时注意的问题
每次实验,火焰如果都呈现明显的特征颜色,钠——黄色、钾——紫色(透过蓝色钴玻璃),这就是实验成功的表征。而实验中经常出现火焰所呈现的颜色不明显,且一闪即逝的现象,要保证实验成功,应注意如下几个问题。
(1)酒精灯芯不能被污染,应尽量采用未被污染的酒精灯芯,使酒精灯火焰趋近无色。
(2)应用酒精灯外焰灼烧蘸取金属盐的铂丝时,呈现明显特征颜色后,再移至内焰下部,使整个火焰均呈现特征颜色。
(3)铂丝一定要洗涤干净,避免沾有较多的其他金属阳离子而影响实验效果。
3焰色反应实验的改进方法
焰色反应实验有很多改进方法,而作为课堂演示实验,应该具有操作简单、实验时间短、现象明显便于观察及具有一定的趣味性等特点。
3.1改进方法一
先将粉笔的一端小心地打出一个2cm深的小孔,在小孔中放入一定量的钾盐或钠盐并压实。实验时可以将粉笔中有钾盐或钠盐的一端浸泡在酒精中,一定时间后点燃粉笔上的酒精,这时可以拿着粉笔绕教室一周,使每位学生都能近距离观察到钾盐或钠盐的焰色,现象十分明显。实验完毕后,可以把粉笔保存好待下次实验时使用。改进后实验的特点是,观察钾或钾的化合物的焰色根本无需使用蓝色钴玻璃,实验操作方便简单,焰色反应的时间较长,便于观察清楚,在酒精中浸泡过的粉笔可长期使用。
3.2改进方法二
准备一个玻璃片,在玻璃片上放适量的要进行焰色反应的物质的固体粉末,用浸泡有酒精的医用棉球蘸少许粉末,用酒精灯点燃酒精棉球,然后把燃着的医用棉球迅速从酒精灯火焰上移开,这时可以非常明显地观察到粘有固体粉末的酒精燃烧时的火焰颜色。改进后的实验特点是,观察钾的化合物根本无需用蓝色钴玻璃,就可以清楚地看见紫红色的火焰。
3.2改进方法三
将钠、钾金属的盐研碎,然后将研碎的钠盐或钾盐放入蒸发皿或坩埚中,再加入少量酒精后点燃。开始时火焰颜色为酒精燃烧的颜色,随后立即出现金属的焰色。该方法操作简单,可见度大,现象明显,效果很好。
4对一个问题的思考
中学教学中关于钠、钾元素的焰色反应通常描述为“钠呈黄色、钾呈紫色”。这种描述和实验结果以及一些化学论著是一致的。而2017年高考理综(全国工卷)35题认为“钾呈紫红色”;这种“钾呈紫红色”的描述使学生感到迷惑,是不是以前的描述不准确呢?对这一问题有必要结合具体实验加以分析。
(1)虽然高考题给出了钾元素的焰色反应呈“紫红色”的描述,这种描述也符合理论上的研究结果,但是很多的实验表明,实验中很难观察到明显的“红色”出现,而“紫色”的出现倒是常态,这说明红色辐射很微弱。
(2)中学教学中关于金属钾的焰色反应的实验一般强调使用蓝色的钴玻璃,目的是消除钠对钾焰色的干扰,但是很少有人注意到蓝色的钴玻璃虽然消除了“钠的黄色”,但是对金属钾焰色反应中呈现的微弱的红色也吸收了。因此,中学实验中强调使用“蓝色的钴玻璃”,必然使学生难以观察到高考试题中所描述的金属钾的焰色反应所出现的结果。
综上所述,高考试题中关于金属钾焰色反应的焰色和中学现阶段的关于金属钾焰色反应的焰色的描述没有矛盾,可以認为红色可见光的辐射很微弱,难以观察到,同时也说明蓝色的钴玻璃在金属钾的焰色反应实验中不是必备的。