单核细胞趋化蛋白-1在内源性神经干细胞迁移中的作用①
丁鹏,周长胜,戴孝森,陆斌,王崇谦,王伟民,王进昆
20世纪90年代初,Reynolds和Richards等先后从成年鼠的纹状体和海马中分离出神经干细胞(neural stem cells,NSCs)[1-2],打破了成体哺乳动物神经细胞不能再生的传统观念。NSC除在特定的胚胎发育期存在外,在成年哺乳动物大脑中也分布广泛,其中侧脑室壁的脑室下区和海马齿状回的颗粒下区是NSCs分布的两个主要区域[3]。研究表明,中枢神经系统发生病理改变后,NSCs会特异性地向损伤部位迁移,并可替代缺失的细胞,从而恢复受损脑组织结构和功能[4-8]。我们先前通过体外实验证实,单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)体外可趋化神经干细胞迁移,其趋化迁移作用与浓度正相关。本实验探讨MCP-1在体对NSCs迁移的趋化作用。
1 材料和方法
1.1 实验动物
健康雄性Sprague-Dawley大鼠36只,鼠龄4~5个月,体重(300±25)g,购于昆明医学院实验动物中心。实验过程对动物的处理符合2006年科技部《关于善待实验动物的指导意见》的规定[9]。
1.2 试剂与仪器
兔抗大鼠nestin多克隆抗体、兔抗大鼠MCP-1多克隆抗体、兔SP Kit、DAB Kit、HE染色试剂盒购自北京中杉金桥生物技术有限公司;革兰氏阴性菌胞壁脂多糖(LPS)购自SIGMA公司;大鼠脑立体定向仪购自中西远大科技有限公司。
1.3 模型制备
参照文献脑皮质微量注射内毒素建立脑损伤模型[10]。分为:①对照组:颅内注射生理盐水5µl;②实验组:颅内注射脂多糖5µl(脂多糖5µg溶于生理盐水5µl)。两组均再分为3 d、5 d、7 d组,每组6只。实验过程死亡者,按相同数量补充。
1.4 标本采集与处理
按文献方法于造模后3 d、5 d、7 d取材[10]。3%H2O2去离子水(无色液体)孵育8 min,PBS冲洗5次,每次3 min;滴加山羊血清工作液室温孵育10 min,倾去;滴加1∶100一抗(兔抗大鼠nestin多克隆抗体、兔抗大鼠MCP-1多克隆抗体、兔SP Kit),4℃冰箱过夜,PBS冲洗5次,每次5 min;滴加生物素标记二抗工作液,37℃孵育15 min。PBS冲洗5次,每次5 min;滴加辣根酶标记链霉卵白素工作液,37℃孵育15 min,PBS冲洗5次,每次5 min;显色剂显色(DAB),自来水充分冲洗,苏木素复染,常规脱水,透明,封片。
切片高倍镜下采用图像分析软件ImagePro-Plus 6.0分析,记录累积吸光度值(IA值)表示,免疫反应产物的IA值减去背景的IA值,得到矫正IA值(CIA值)即免疫反应产物的实际累积吸光度值。
1.5 统计学分析
2 结果
2.1 MCP-1
MCP-1阳性产物为棕黄色点状或颗粒状沉积,主要分布细胞胞质中。各时间点对照组MCP-1在皮质、海马、脑干部位均有少量表达。实验组造模后3 d时,MCP-1除了在上述部位表达外,主要在损伤边缘表达;造模后5 d表达到峰值,范围扩大至损伤周围;造模后7 d表达量和范围较前减少(图1)。
对照组各时间点MCP-1 CIA值无显著性差异(P>0.05)。实验组MCP-1各时间点CIA值均显著高于对照组(P<0.001)。见表1。
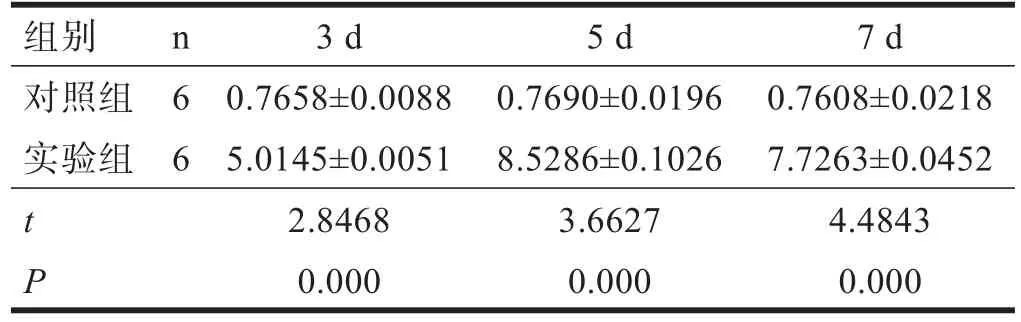
表1 各组MCP-1表达(CIA值)

图1 各组MCP-1表达(免疫组化染色,200×)
2.2 nestin
nestin阳性产物为棕黄色点状或颗粒状沉积,主要在细胞内。各时间点对照组大鼠nestin阳性细胞在海马区表达,量较少。实验组造模后3 d见中等量nestin阳性细胞在海马区表达;5 d海马区大量表达,并向损伤区迁移;7 d损伤区可见nestin阳性细胞(图2)。
对照组各时间点nestin CIA值无显著性差异(P>0.05)。实验组各时间点均显著高于对照组(P<0.001)。见表2。

表2 各组nestin表达(CIA值)
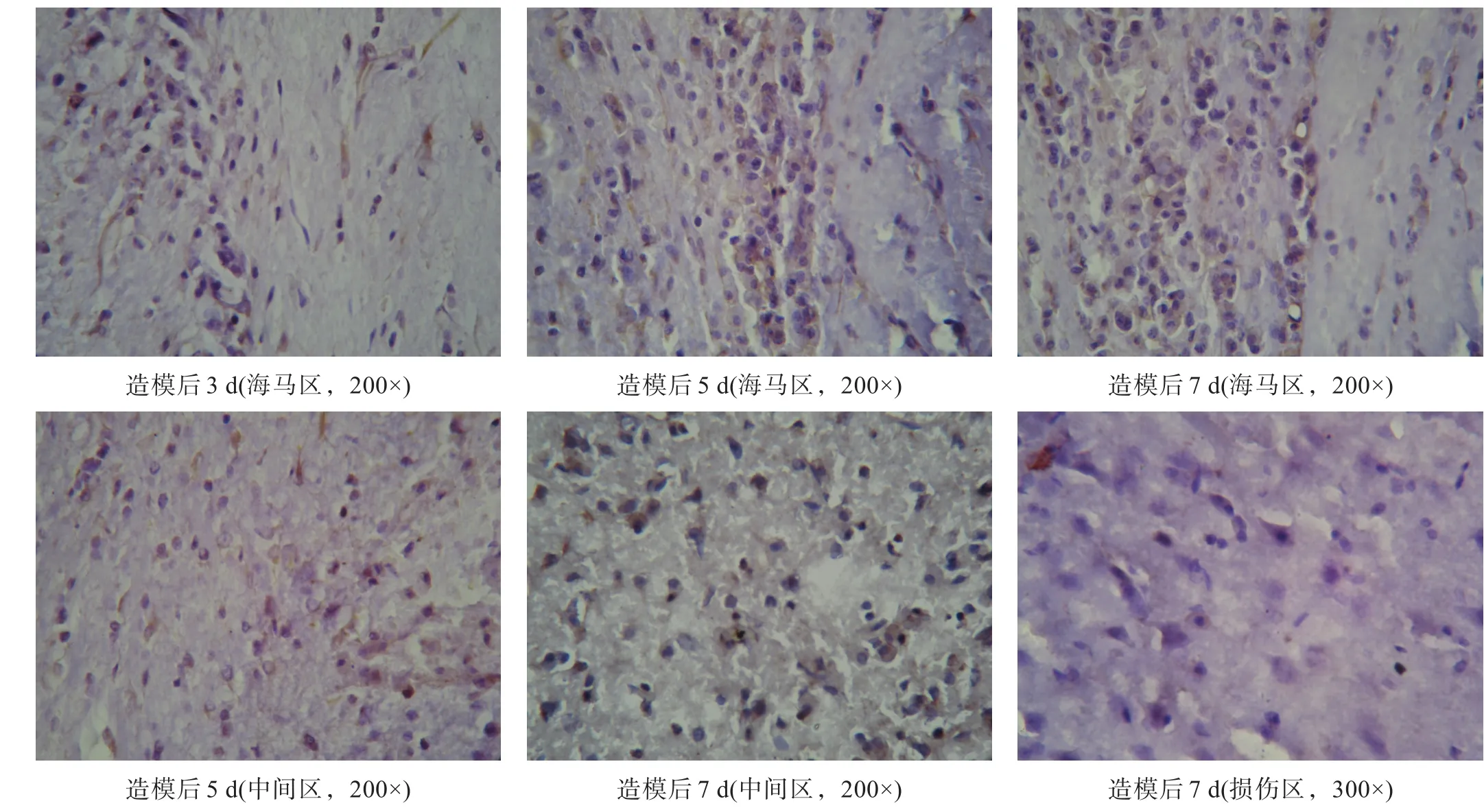
图2 实验组nestin表达(免疫组化染色)
3 讨论
在脑损伤、癫痫、神经细胞变性等[4-8]时,NSCs可被激活,发生增殖、迁移和分化,恢复神经系统的正常结构和功能。目前调控NSCs增殖和迁移的机制还不完全清楚,可能与以下因素有关[11-15]:细胞周围环境、细胞代谢产物、细胞因子、黏附分子、激素和递质等。
有学者认为以MCP-1为代表的趋化因子可能发挥着重要作用[16]。MCP-1属于CC类趋化因子,由Yoshimura于1989年首次从神经胶质瘤系U-105MG分离纯化得到[17],是一种具有多种生物学功能的趋化因子。它通过与表面受体CCR2结合,激活细胞内信号转导通路,引起与细胞迁移或激活相关的一系列细胞内变化[18-19]。脑内MCP-1主要在星形胶质细胞、小胶质细胞和神经元表达。正常脑组织MCP-1维持在较低水平,当受到损伤时,表达水平上调。
Yamagami等的研究显示,在小鼠局灶性脑缺血模型中,缺血区皮质和基底节MCP-1表达上调,脑室下区的NSCs向缺血区定向迁移[20]。Belmadani等的研究显示,敲除小鼠MCP-1或CCR2基因后,NSCs向损伤区的迁移显著减少[21]。本课题组先前证实,MCP-1在体外可趋化神经干细胞迁移,其趋化作用与浓度成正相关,并发现NSCs表达趋化因子MCP-1的特异性受体CCR2[22]。以上研究提示,MCP-1-CCR2轴可能参与了神经修复的过程。但是其在体内促进NSCs的增殖与迁移的机制尚不清楚。
本实验通过制备脑皮质微量注射脂多糖脑损伤模型,应用冰冻切片免疫组织化学染色法,动态监测MCP-1和nestin阳性细胞的时相变化。发现损伤后,MCP-1表达的量和范围增加,5 d时达到高峰;同时观察到海马区nestin阳性细胞增殖,7 d时损伤区可见nestin阳性细胞。考虑可能是趋化因子MCP-1的升高趋化表达其特异性受体的NSCs向损伤区迁移,即在脑皮质微量注射脂多糖脑损伤模型中,MCP-1有一过性增加,而升高的MCP-1对NSCs从海马区向损伤区迁移可能具有正性诱导作用。
[1]Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255(5052):1707-1710.
[2]Richards LJ,Kilpatrick TJ,Bartlett PF.De novo generation of neuronal cells from the adult mouse brain[J].Proc Natl Acad Sci USA,1992,89(18):8591-8595.
[3]Temple S.The development of neural stem cells[J].Nature,2001,4140(6859):112-117.
[4]Yu TS,Zhang G,Liebl DJ,et al.Traumatic brain injury-induced hippocampal neurogenesis requires activation of early nestin-expressing progenitors[J].J Neurosci,2008,28(48):12901-12912.
[5]Mazurek GH,Reddy V,Marston BJ,et al.DNA fingerprinting by infrequent-restriction-site amplification[J].J Clin Microbiol,1996,34(10):2386-2390.
[6]Guo Y,Shi D,Li W,et al.Proliferation and neurogenesis of neural stem cells enhanced by cerebral microvascular endothelial cells[J].Microsurgery,2008,28(1):54-60.
[7]Jessberger S,Zhao C,Toni N,et al.Seizure-associated,aberrant neurogenesis in adult rats characterized with retrovirus-mediated cell labeling[J].J Neurosci,2007,27(35):9400-9407.
[8]Galvan V,Bredesen DE.Neurogenesis in the adult brain:implications for Alzheimer's disease[J].CNS Neurol Disord Drug Targets,2007,6(5):303-310.
[9]中华人民共和国科学技术部.关于善待实验动物的指导性意见[S].2006-09-30.
[10]戴孝森,丁鹏,董岳,等.基质细胞衍生因子1及其受体CXCR4在内源性神经干细胞迁移中的作用[J].中国组织工程研究,2012,16(23):4237-4241.
[11]Nakatomi H,Kuriu T,Okabe S,et al.Regeneration of hippocampal pyramidal neurons after ischemic brain injury by recruitment of endogenous neural progenitors[J].Cell,2002,110(4):429-441.
[12]Leker RR,Soldner F,Velasco I,et al.Long-lasting regeneration after ischemia in the cerebral cortex[J].Stroke,2007,38(1):153-161.
[13]Hoglinger GU,Rizk P,Muriel MP,et al.Dopamine depletion impairs precursor cell proliferation in Parkinson disease[J].Nat Neurosci,2004,7(7):726-735.
[14]Lemkine GF,Rai A,Alfama G,et al.Adult neural stem cell cycling in vivo requires thyroid hormone and its alpha receptor[J].FASEB J,2005,19(7):863-865.
[15]Robin AM,Zhang ZG,Wang L,et al.Stromal cell-derived factor 1 alpha mediates neural progenitor cell motility after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2006,26(1):125-134.
[16]Itoh T,Satou T,Ishida H,et al.The relationship between SDF-1 alpha/CXCR4 and neural stem cells appearing in damaged area after traumatic brain injury in rats[J].Neurol Res,2009,31(1):90-102.
[17]Yoshimura T,Robinson EA,Tanaka S,et al.Purification and amino acid analysis of two human glioma-derived monocyte chemoattractants[J].J Exp Med,1989,169(4):1449-1459.
[18]Gong JH,Clark-Lewis I.Antagonists of onocytechemoattractant protein-1 identified by modification of functionally critical NH2-terminal residues[J].J Exp Med,1995,181(2):631-640.
[19]Hemmerich S,Paavola C,Bloom A,et al.Identification of residues in the monocyte chemotactic protein-1 that contact the MCP-1 receptor,CCR2 [J].Biochemistry,1999,38(40):13013-13025.
[20]Yamagami S,Tamura M,Hayashi M,et al.Differential production of MCP-1 and cytokine induced neutrophil chemoattractant in the ischemic brain after transient focal ischemia in rats[J].J Leukoc Biol,1999,65(6):744-749.
[21]Belmadani A,Tran PB,Ren D,et al.Chemokines regulate the migration of neural progenitors to sites of neuroinflammation[J].J Neurosci,2006,26(12):3182-3191.
[22]董岳,康波,丁鹏,等.单核细胞趋化蛋白1与神经干细胞的体外迁移[J].中国组织工程研究,2012,16(23):4279-4283.

